核桃楸叶降血糖和抗氧化有效部位的筛选及其成分分析△
王会,刘汇,张楠茜,张辉*,高文义*,孙佳明
1.长春中医药大学,吉林 长春 130117;2.吉林省延边朝鲜族自治州食品药品检验所,吉林 延吉 133000
核桃楸叶是胡桃科胡桃属植物核桃楸JuglansMandshuricaMaxim.的树叶。原植物核桃楸,又名胡桃楸[1],落叶乔木,生长在中国东北、华北、河北等地区[2-3],其青果皮、茎、叶和树皮均可入药[4]。糖尿病是近年来发病率迅速增加并严重危害人类健康的疾病之一,糖尿病分为1型糖尿病和2型糖尿病,后者是最常见的,占糖尿病患者的90%以上[5-6]。α-葡萄糖苷酶抑制剂对餐后高血糖和高胰岛素血症有良好的防治效果,用于治疗由碳水化合物代谢紊乱而引起的疾病;α-淀粉酶抑制剂对唾液淀粉酶和胰液淀粉酶活性具有良好的抑制作用,阻碍食物中碳水化合物的代谢,降低体内的血糖和血脂水平,防止餐后高血糖[7-8]。
近年来对核桃楸其他部位的研究报道较多,但是对核桃楸叶的研究报道较少。本文建立了α-葡萄糖苷酶、α-淀粉酶体外抑制和DPPH自由基清除模型[9-10],用于研究核桃楸叶乙醇提取物不同极性萃取部位对α-葡萄糖苷酶、α-淀粉酶的抑制作用和DPPH自由基清除活性,并采用紫外分光光度法测定总黄酮含量,筛选核桃楸叶降血糖和抗氧化有效部位,超高效液相色谱法(UPLC)分析确定其活性成分,为研究其药理作用奠定基础,对核桃楸叶的开发和应用具有指导意义[11]。
1 材料
1.1 药材
核桃楸叶药材采于吉林省通化市,由长春中医药大学张辉教授鉴定为核桃楸JuglansmandshuricaMaxim.的干燥叶。
1.2 试剂与仪器
α-葡萄糖苷酶、α-淀粉酶、维生素E、阿卡波糖(Sigma,美国),对硝基苯酚-α-D-葡萄糖苷(PNPG,Sigma,美国);1,1-二苯基-2-三硝基苯肼(DPPH,Sigma,美国);维生素C(Sigma,美国);对照品芦丁(纯度≥98%)、金丝桃苷(纯度93.3%)、异槲皮素(纯度≥98%)和紫云英苷(纯度>99%),均购自中国食品药品检定研究院;其余试剂均为分析纯。Agilent 1260 Infinity(美国安捷伦公司);BP211D型十万分之一电子天平(赛多利斯仪器有限公司);酶标仪(Bio-Rad);KQ3200B型超声波清洗器(昆山市超声仪器有限公司);紫外-可见分光光度计(Varian公司);DSHZ-300A型旋转式恒温振荡器(太仓市实验设备厂);96孔板;各种型号移液枪及枪头等。
2 方法与结果
2.1 核桃楸叶各部位的提取与分离
称取适量的核桃楸叶,置于圆底烧瓶中,先用90%的乙醇水溶液回流提取1次,再用70%的乙醇水溶液回流提取2次,料液比均为1∶10,每次1 h,滤过,合并提取液。回收乙醇,减压浓缩。取500 mL核桃楸叶乙醇提取液,挥至无醇味,剩余350 mL,取100 mL留为总提(A),剩余的250 mL依次用二氯甲烷、乙酸乙酯、水饱和正丁醇萃取,获得不同溶剂萃取部位,依次标记为B、C、D,萃取后溶液作为水层(E),萃取方法为等体积萃取3次。收集各层萃取液,减压浓缩、干燥至干膏,作为供试药物[12]。
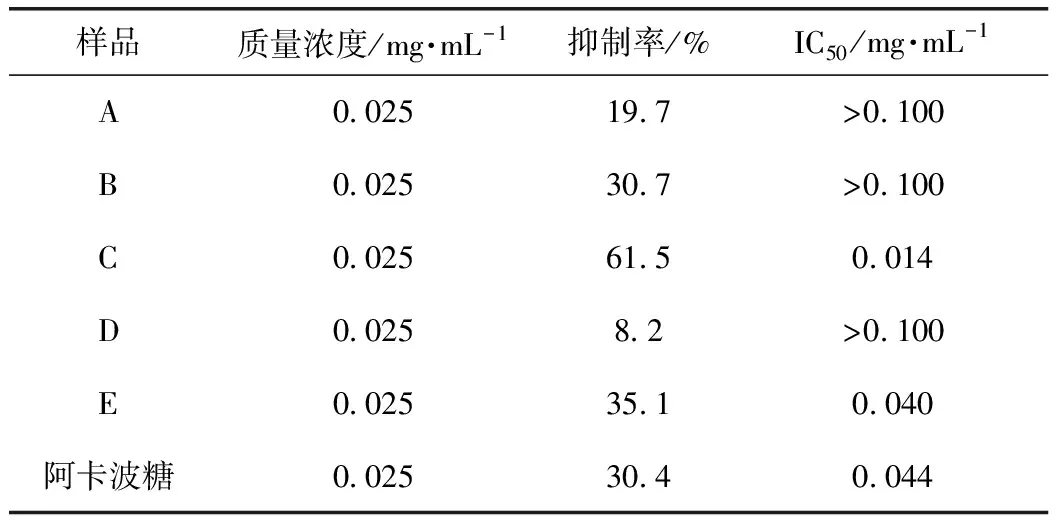
2.2 测定核桃楸叶不同萃取部位(A~E)对α-葡萄糖苷酶抑制活性
根据已有方法改进[13-14],检测在96孔板上进行,先加入20 μL不同浓度样品,再加入40 μL 0.5 U·mL-1的α-葡萄糖苷酶,37 ℃恒温振荡孵育5 min;加入20 μL 3 mmol·L-1的底物PNPG,37 ℃恒温振荡孵育15 min,最后加入100 μL 0.1 mol·L-1Na2CO3,立即测定405 nm处的吸光度(A)值[15]。每个浓度样品同时进行3个平行测定并取平均值。实验均设定空白对照、背景对照、阴性对照,按公式(1)计算抑制率,并计算相应的IC50值,A~E的α-葡萄糖苷酶抑制活性如表1所示。

(1)
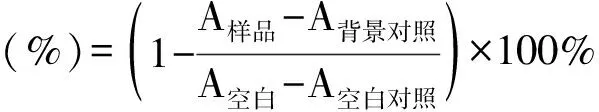
2.3 测定A~E对α-淀粉酶抑制活性
应用3,5-二硝基水杨酸(DNS)比色法测定α-淀粉酶活性[17],反应体系为0.2 mL的α-淀粉酶溶液,在37 ℃下预热5 min后,加入0.4 mL淀粉溶液和0.2 mL柠檬酸-柠檬酸钠缓冲液在37 ℃下反应30 min。反应完成后加入2 mL DNS,在沸水中反应10 min,取出,冷却,取0.5 mL反应溶液置于5 mL容量瓶中,用蒸馏水定容至刻度,用紫外可见分光光度计测定540 nm处的A值,实验均设有样品、背景对照、空白和空白对照。按公式(2)计算抑制率,并计算相应的IC50值。反应体系见表2,抑制率结果见表3。
(2)

表2 A~E对α-淀粉酶活性反应体系
注:—表示用同体积蒸馏水代替。
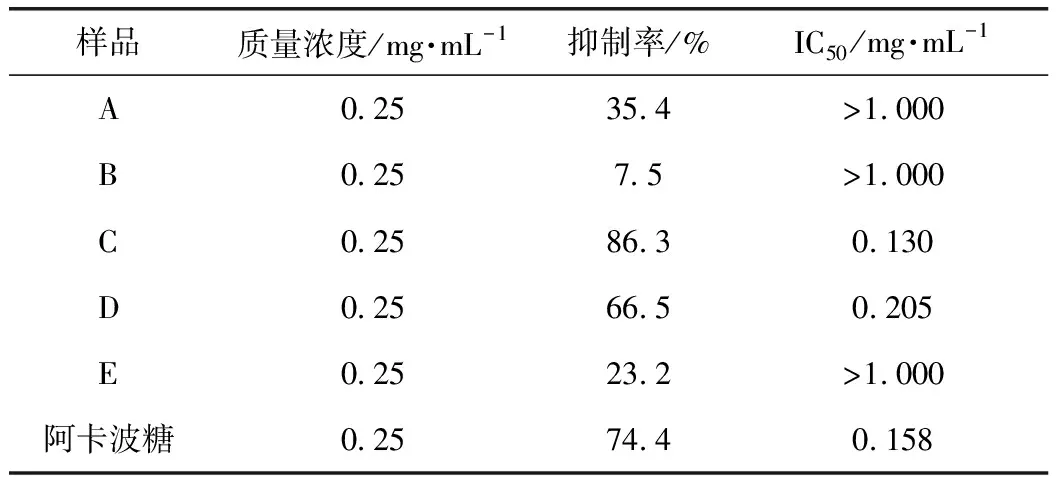
表3 A~E对α-淀粉酶抑制活性
2.4 测定A~E对DPPH自由基清除活性
采用DPPH法[17-18]对分离得到的核桃楸叶乙醇提取物进行体外抗氧化活性评价。精密量取2 mL质量浓度为26.4 mg·L-1的DPPH甲醇溶液,再分别加入2 mL不同浓度的用甲醇溶液制备的样品液,混合均匀,避光条件下反应30 min,测定其在517 nm处的A值[15,19]。同时,用2 mL甲醇溶液代替样品溶液作为空白对照,将2 mL样品溶液与2 mL甲醇溶液混合作为样品对照,将维生素E作为阳性对照,按公式(3)计算样品液对DPPH溶液清除率。

(3)
式中:Ai为与待测溶液混合后的DPPH溶液的吸光度;Aj为与待测溶液混后的溶剂的吸光度;A0为溶剂和DPPH溶液混后的吸光度。
A~E的DPPH清除率如表4所示,结果可知,C的清除率远高于其他4个部位,因此,C对DPPH自由基清除活性最好,表明C是核桃楸叶抗氧化的有效部位。
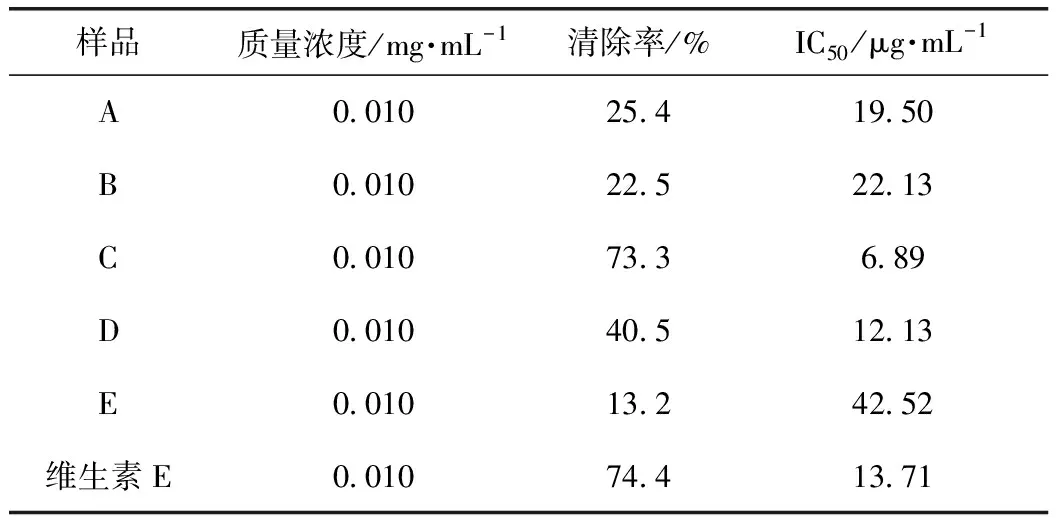
表4 A~E的DPPH自由基清除活性
2.5 A~E的总黄酮含量测定
运用紫外分光光度法[20],精密称取11.5 mg(于105 ℃干燥至恒重的)芦丁对照品,置于50 mL容量瓶中,先加入适量60%乙醇水溶液超声溶解,再用适量的60%乙醇水溶液稀释定容,制得芦丁对照品溶液(0.20 mg·mL-1)。精密吸取上述芦丁对照品溶液0、1.0、2.0、3.0、4.0、5.0 mL,置于25 mL容量瓶中,加入0.4 mL 5% NaNO2溶液,混合均匀,静置6 min,加入0.4 mL 10% Al(NO3)3溶液,混合均匀,静置6 min,加入4.0 mL 4% NaOH溶液,最后用50%乙醇水溶液稀释至刻度,混合均匀,静置15 min[21]。将50%乙醇水溶液作为空白对照,运用紫外分光光度法,测定512 nm处不同质量浓度芦丁对照品溶液的A值。以A值为纵坐标(Y),以芦丁对照品溶液的质量浓度为横坐标(X)进行线性回归,制备标准曲线,得回归方程为Y=0.654 3X-0.061 1(r=0.999 5,n=3),结果表明,芦丁质量浓度在0.23~1.15 mg·mL-1呈良好的线性关系。
吸取适量的A~E样品液置于不同的容量瓶中,依上述方法,测定其512 nm处的A值,将不加供试品的样品作为空白。结合标准曲线计算供试品中总黄酮的含量,结果如表5所示。
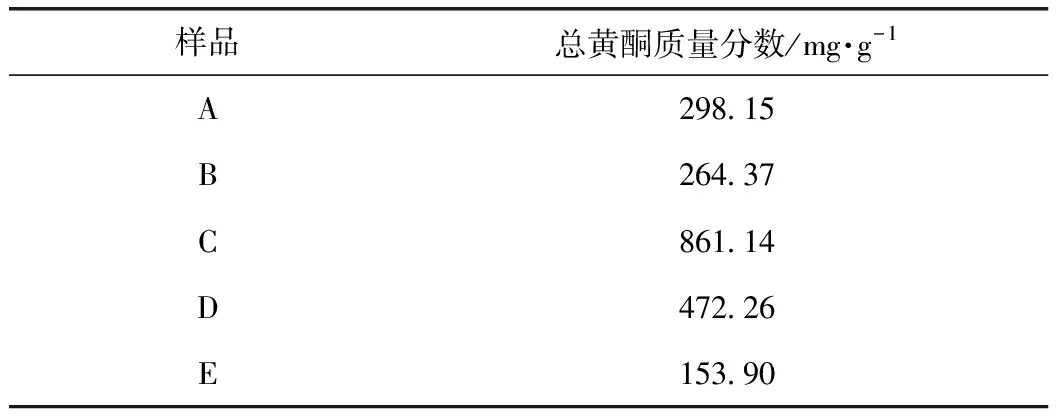
表5 A~E的总黄酮含量测定结果
2.6 UPLC分析
分析条件:Agilent SB-C18色谱柱(4.6 mm×100 mm,1.8 μm),流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~10 min:5%~20% A;10~40 min:20%~23% A;40~45 min:23%~25% A;45~70 min:25%~25% A;70~75 min:25%~100%A;75~95 min:100%~100% A)。流速为300 μL·min-1,检测波长为254 nm,柱温为25 ℃,溶液均为1 mg·mL-1。混合标准品进样体积为5 μL,乙酸乙酯样品进样体积为13 μL。色谱图显示有3个黄酮类成分的标准品与样品对应峰的保留时间一致,表明样品中存在金丝桃苷、异槲皮素和紫云英苷(见图1)。
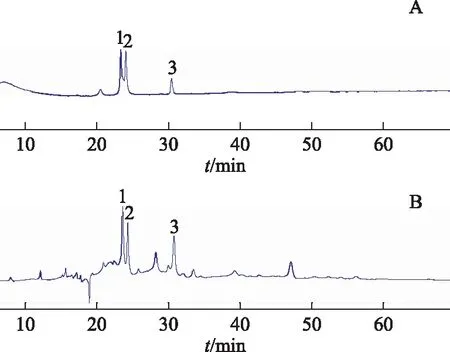
注:A.对照品;B.核桃楸叶乙酸乙酯样品;1.金丝桃苷;2.异槲皮素;3.紫云英苷。图1 核桃楸叶及对照品HPLC图
3 讨论
核桃楸叶乙醇提取物对α-葡萄糖苷酶和α-淀粉酶有一定的抑制作用,对DPPH具有清除作用,但没有具体深入的研究报道。因此,通过建立α-葡萄糖苷酶和α-淀粉酶的体外抑制模型,测定DPPH自由基清除活性和总黄酮含量,进行UPLC分析,筛选核桃楸叶的降血糖和抗氧化的有效部位及活性物质。对核桃楸叶各部位进行α-葡萄糖苷酶和α-淀粉酶的体外抑制活性以及DPPH清除活性的实验,结果表明核桃楸叶乙醇提取物的乙酸乙酯萃取部位在体外对α-葡萄糖苷酶和α-淀粉酶有明显的抑制作用,其IC50分别为0.014、0.13 mg·mL-1,而阳性药阿卡波糖的IC50分别为0.044、0.158 mg·mL-1,其对α-葡萄糖苷酶和α-淀粉酶的抑制作用均强于阳性药阿卡波糖;其乙酸乙酯萃取部位比其他萃取部位具有更明显的DPPH自由基清除能力,其IC50为6.89 mg·mL-1,应该是核桃楸叶的降血糖和抗氧化有效部位;乙酸乙酯活性部位中总黄酮质量分数为86.11%,是该部位的主要成分,其有效成分是金丝桃苷、异槲皮素和紫云英苷。通过本实验,可以初步确定该活性部位中主要活性物质为黄酮类化合物,且主要活性成分是金丝桃苷、异槲皮素和紫云英苷。该研究为进一步研究核桃楸叶的药理作用打下坚实基础,也为深入研究核桃楸叶的应用价值提供理论支持。

