基于UGT1A1酶抑制探讨何首乌中顺(反)式二苯乙烯苷体外肝微粒体中潜在毒性作用△
汪祺,王亚丹,文海若,马双成
中国食品药品检定研究院,北京 100050
何首乌为蓼科植物何首乌PolygonummultiflorumThunb.的干燥块根。生何首乌可解毒,消痈,润肠通便;制首乌具有补肝肾,益精血,乌须发,强筋骨之功效[1]。近年来国内外有关何首乌肝损伤病例报道逐年增多,何首乌导致的肝损伤占全部中药肝损害病例的5.69%,位居第一[2-7]。
何首乌所含化学成分众多,主要为二苯乙烯苷类、蒽醌类、蒽酮类等成分[8]。
本课题组前期已针对毒性焦点成分蒽醌等进行了初步研究,发现大黄素甲醚,大黄素-8-O-β-D-葡萄糖苷等成分具有较强肝毒性风险。本文重点研究对象为(制)何首乌中另一类重要成分——二苯乙烯苷类[9-10]。反式二苯乙烯苷是生首乌和制首乌中主要化学成分,在何首乌药材中可占到约1%~7%;而反式二苯乙烯苷结构不稳定,在何首乌晾晒、提取、干燥和贮存等生产炮制环节均可能经光转化而形成顺式二苯乙烯苷[11]。近期有学者指出,何首乌中反式二苯乙烯苷的代谢差异可能为何首乌致肝损伤的重要原因[10]。有研究使用人重组UGT同工酶证明反式二苯乙烯苷主要经由Ⅱ相代谢酶介导代谢外排出体外,UGT代谢能力依次为:UGT1A1>UGT1A9>UGT1A7>UGT1A10>UGT2B7>UGT1A8[12]。此外,顺式二苯乙烯苷同样被证明具有肝细胞毒作用[12]。可见反式、顺式二苯乙烯苷均具有潜在肝毒性风险,有必要对其毒性机制作进一步研究。
胆红素是人体内一种非常重要的内源性物质,它是血红素的代谢产物,主要经由UDP-葡萄糖醛酸转移酶1A1(UGT1A1)代谢转化为水溶性结合型葡萄糖醛酸结合物,外排至胆汁中。UGT1A1酶受到外源性物质抑制,可导致体内胆红素无法转化成结合型胆红素或转化量降低,继而可引发胆红素代谢障碍,并诱发胆红素在肝细胞和血液内蓄积,最终引起肝脏毒性反应[3]。因此,胆红素的升高是判定肝损害的重要生物标志物。而何首乌导致的肝损伤患者具有相似的临床表征,即胆红素水平显著升高,平均总胆红素浓度可达生理浓度的8~79倍[13]。由于UGT1A1酶是胆红素的唯一代谢酶,同时又是反式二苯乙烯苷的主要代谢酶,因此,考察反式、顺式二苯乙烯苷对UGT1A1的代谢影响,可有效预测其潜在致肝毒性风险。
由于肝内代谢主要包含Ⅰ相和Ⅱ相代谢两个重要环节,因此本文采用体外肝微粒体孵育方法,首先启动Ⅱ相代谢,考察顺式、反式二苯乙烯苷原型对UGT1A1酶的影响,阐明原型成分的肝毒性风险;其次,为了更加真实地模拟体内肝代谢,同时启动Ⅰ相和Ⅱ相代谢,将Ⅰ相代谢产物的因素涵盖进去,进一步阐明二者的潜在毒性作用。最终,本实验将从代谢角度阐明引起何首乌肝损伤的可能机制及潜在毒性物质。
1 仪器与试药
1.1 仪器
Waters AcquityTMUltra Performance LC超高效液相色谱仪(美国Waters公司);节能型智能恒温槽SDC-6(宁波新芝生物科技股份有限公司),METTLER TOLEDO AE240型电子天平(瑞士梅特勒-托利多公司),Thermo 17R型高速低温离心机(日本Thermo公司)。
1.2 材料与试剂
RLM(大鼠肝微粒体)购自美国BD Gentest公司;维生素C(Vc,纯度≥98%)、磷酸钾(纯度≥98%)、氯化镁(纯度≥98%)、氧化型辅酶II(NADPNa2)(纯度≥98%)、三羟甲基氨基甲烷(Tris,纯度≥98%)、D-葡萄糖-6-磷酸二钠(G-6-P)(纯度≥98%)、葡萄糖-6-磷酸脱氢酶V(G-6-PDH)(纯度≥98%)均购自百灵威科技有限公司,丙甲菌素(纯度≥98%)、葡萄糖二酸单内酯(纯度≥98%)、二甲基亚砜(DMSO,纯度≥98%)、尿苷二磷酸葡萄糖醛酸(UDPGA,纯度≥98%)均购自Sigma Aldrich公司。顺式二苯乙烯苷(批号:16091802,质量分数98%)、反式二苯乙烯苷(批号:16081506,质量分数98%)均购于成都普菲德生物技术有限公司。胆红素(批号:100077-201206,质量分数99.3%)购自中国食品药品检定研究院;甲酸、盐酸均为分析纯(北京化学试剂厂),乙腈、甲醇均为色谱纯(Fisher公司)。
2 方法与结果
2.1 UPLC色谱条件
分析柱:Acquity UPLC HSS C18(100 mm×2.1 mm,1.8 μm);预柱:Acquity UPLC HSS C18VanGuard Pre-column(5 mm×2.1 mm,1.8 μm);流动相:乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~2.1 min,40%→75% A;2.1~4.2 min,75%→95% A;4.2~8.0 min,95% A;8.0~8.5 min,95%→40% A;8.5~12.5 min,40% A);流速:0.4 mL·min-1;柱温:35 ℃;检测波长:450 nm;进样量:1 μL[14-15]。
2.2 溶液的配制
2.2.1 Tris-HCl缓冲液的配制 精密称取121.1 g Tris于1000 mL容量瓶,加入去离子水800 mL,浓HCl调节pH=7.4,定容即得。
2.2.2 UDPGA再生系统的配制 精密称取丙甲菌素、氯化镁、UDPGA、葡糖二酸单内酯适量,用Tris-HCl缓冲液溶解,使含葡糖二酸单内酯5 mmol·L-1、氯化镁5 mmol·L-1、丙甲菌素25 μg·mL-1、UDPGA5 mmol·L-1,即得。
2.2.3 还原型辅酶II(NADPH)生成系统的配制 精密称取NADPNa2、G-6-PDH、G-6-P、MgCl2适量,置100 mL容量瓶中,加超纯水使溶解并稀释至刻度,摇匀,制得体系中含有1 mmol·L-1NADPNa2、20 mmol·L-1G-6-P、2 U·L-1G-6-PDH、20 mmol·L-1MgCl2,现用现配[16-18]。
2.3 Ⅱ相反应温孵体系
以新鲜配制的UDPGA再生系统稀释RLM,肝微粒体体系蛋白终浓度为0.5 mg·mL-1,分别加入不同浓度的顺式、反式二苯乙烯苷及UGT1A1酶底物胆红素DMSO溶液(体系终体积200 μL,其中DMSO总用量不超过1%)。将体系置于37 ℃恒温水浴预孵育3 min,加入UDPGA(使含UDPGA终浓度为5 mmol·L-1)启动反应。反应15 min后加入600 μL冰乙腈-甲醇(体积比为2∶1,含Vc浓度为200 μmol·L-1)终止反应,沉淀蛋白,取上清液1 μL进行UPLC液相测定。每个样本重复3次[16-18]。
2.4 Ⅰ、Ⅱ两相反应温孵体系
以新鲜配制的UDPGA再生系统稀释RLM,肝微粒体体系蛋白终浓度为0.5 mg·mL-1,分别加入不同浓度顺式、反式二苯乙烯苷及胆红素DMSO溶液(体系终体积200 μL,其中DMSO总用量不超过1%)。将体系置于37 ℃恒温水浴预孵育3 min,加入UDPGA和NADPH再生系统(使含UDPGA终浓度为5 mmol·L-1)启动两相代谢反应。反应15 min后加入600 μL冰乙腈-甲醇,(体积比为2∶1,含Vc浓度为200 μmol·L-1)终止反应,沉淀蛋白,取上清液1 μL进行UPLC液相测定。每个样本重复3次[16-18]。
2.5 顺式、反式二苯乙烯苷对UGT1A1酶的抑制作用考察
本部分实验采用RLM孵育体系,考察顺式、反式二苯乙烯苷对UGT1A1酶的抑制作用,首先仅启动Ⅱ相代谢反应,考察待测物未经Ⅰ相代谢的原型成分对Ⅱ相代谢酶UGT1A1的作用;其次,同时启动两相代谢,将代谢产物的因素考察进去,通过比较不同通路代谢后的差异,可进一步阐明其潜在肝毒性风险。
2.5.1 启动Ⅱ相反应后考察顺式、反式二苯乙烯苷对UGT1A1酶的抑制作用 按上述方法,分别以UGT1A1酶底物胆红素代谢物生成量对底物浓度作图,以米氏方程双倒数作图法测定Vmax、Km,并以slop绘图法求得抑制常数Ki;考察顺式、反式二苯乙烯苷在RLM中对UGT1A1酶的抑制情况。结果见表1和图1。由实验结果可以看出:当仅启动Ⅱ相反应时,顺式、反式二苯乙烯苷均以原型形式直接作用于UGT1A1酶,两个单体分别表现出中等抑制和弱抑制作用,抑制类型均为竞争型抑制,即二者可与UGT1A1底物胆红素产生竞争性代谢,从而降低胆红素代谢效率,且顺式二苯乙烯苷抑制作用更强,提示原型成分对UGT1A1酶具有抑制作用,存在引发胆红素原型堆积继而产生肝毒性的风险。
2.5.2 同时启动Ⅰ、Ⅱ相反应后考察顺式、反式二苯乙烯苷对UGT1A1酶的抑制作用 按上述方法,分别以胆红素代谢产物生成量对胆红素浓度作图,以米氏方程双倒数作图法测定Vmax、Km,并以slop绘图法求得抑制常数Ki;考察顺式、反式二苯乙烯苷在RLM中对UGT1A1酶的抑制情况,结果见图2和表2。由实验结果可以看出:当同时启动Ⅰ、Ⅱ两相反应时,待测物同时经历两相代谢反应,待测物以Ⅰ相代谢产物或原型形式作用于UGT1A1酶,两个待测单体对UGT1A1酶的抑制作用均消失,提示两个单体存在Ⅰ相代谢过程,并且其Ⅰ相代谢产物对UGT1A1酶无抑制作用,Ⅰ相代谢降低了顺式、反式二苯乙烯苷的肝毒性风险。

表1 启动Ⅱ相代谢后待测物对UGT1A1酶的抑制作用考察(n=3)
注:Ki<1 μmol·L-1,强抑制;Ki>50 μmol·L-1,弱抑制[19]。
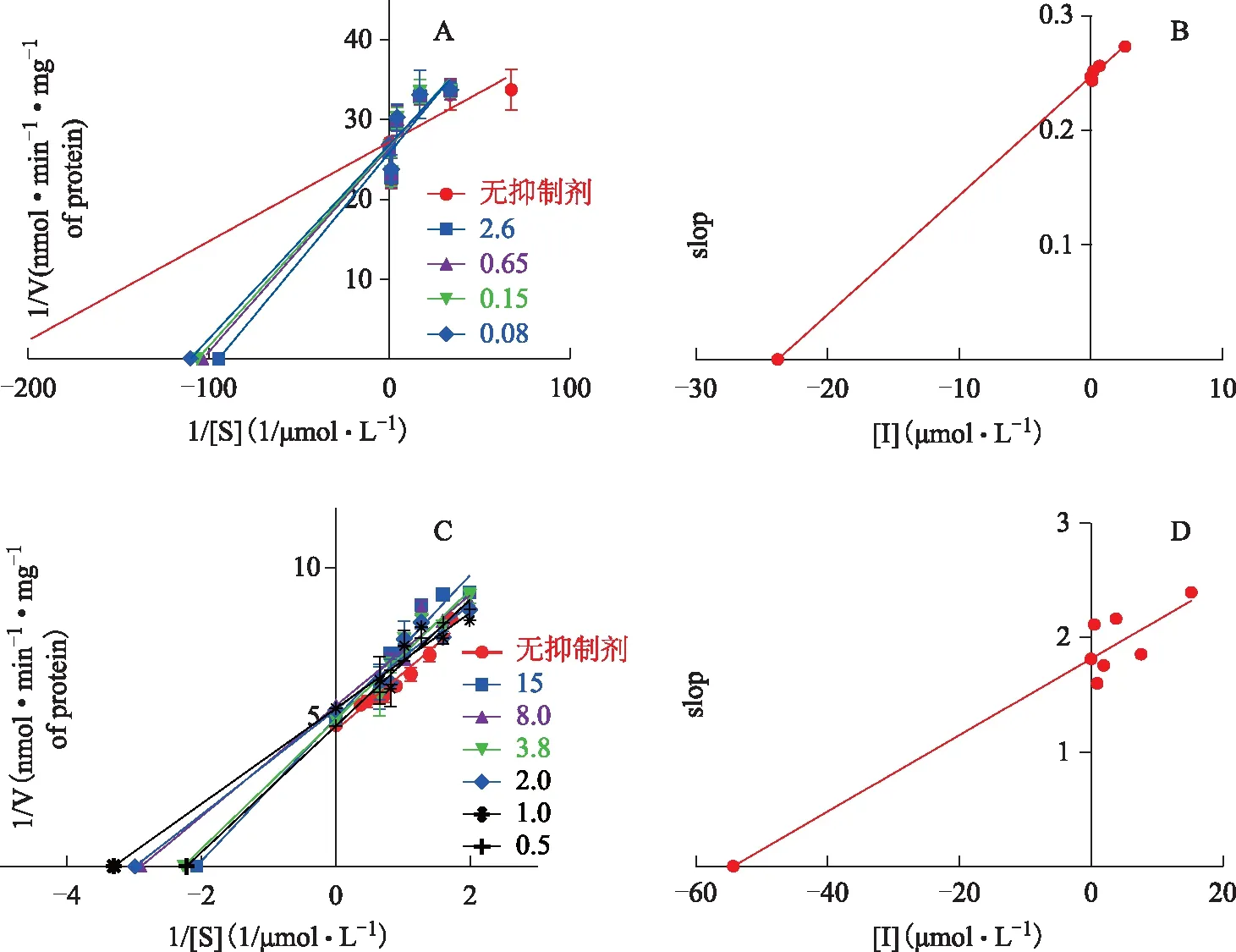
注:A.加入顺式二苯乙烯苷后UGT1A1酶双倒数方程;B.加入顺式二苯乙烯苷后UGT1A1酶slop图;C.加入反式二苯乙烯苷后UGT1A1酶双倒数方程;D.加入反式二苯乙烯苷后UGT1A1酶slop图。图1 启动Ⅱ相代谢反应待测药物对UGT1A1酶动力学参数的影响

注:A.加入顺式二苯乙烯苷后UGT1A1酶双倒数方程;B.加入顺式二苯乙烯苷后UGT1A1酶slop图;C.加入反式二苯乙烯苷后UGT1A1酶双倒数方程;D.加入反式二苯乙烯苷后UGT1A1酶slop图。图2 启动Ⅰ、Ⅱ相代谢反应待测药物对UGT1A1酶动力学参数的影响

表2 启动Ⅰ、Ⅱ相代谢后待测物对UGT1A1酶的抑制作用考察(n=3)
注:Ki<1 μmol·L-1,强抑制;Ki>50 μmol·L-1,弱抑制[17]。
3 小结与讨论
当前已有大量有关何首乌肝毒性作用机制和毒性物质的研究。综合现有文献报道发现,何首乌所致肝损伤与肝脏代谢酶缺陷、氧化还原循环、能量代谢脂质代谢、影响细胞膜运载胆盐受体及引起内质网应激导致的细胞损伤等因素有关[20-22]。本文试图从代谢酶角度出发进一步阐明何首乌所致肝损伤的可能机制。
何首乌毒性成分的研究结果提示制首乌毒性低于生首乌,其中经加工炮制后反式二苯乙烯苷降低至原来含量的20%,成分含量变化最为显著[23]。研究人员已针对该成分开展了多方面的研究。张乐等[11]提出何首乌中反式二苯乙烯苷不稳定,在贮藏过程中可转化为顺式二苯乙烯苷,而顺式二苯乙烯苷被证明与何首乌所致的特异质肝损伤相关。此外,李娜等[12]使用药物代谢酶抑制剂来考察代谢因素对反式二苯乙烯苷潜在的肝损伤作用,发现反式二苯乙烯苷主要经由UGT介导进行Ⅱ相代谢,通过抑制药物Ⅱ相代谢酶来增加反式二苯乙烯苷潜在的肝损伤风险。本研究从代谢酶角度展开研究,以UGT1A1酶介导的胆红素代谢受阻可引发肝毒性风险为出发点,通过体外方法测定顺式、反式二苯乙烯苷对Ⅱ相代谢酶UGT1A1的抑制作用,从而推测其肝毒性风险。首先启动Ⅱ相代谢反应,考察顺式、反式二苯乙烯苷未经Ⅰ相代谢的原型成分对Ⅱ相代谢酶UGT1A1的作用,结果提示,原型成分对UGT1A1酶存在抑制作用,且顺式二苯乙烯苷抑制作用大于反式二苯乙烯苷,表现为中强抑制。考虑到某些药物可能同时经过Ⅰ相、Ⅱ相代谢,且这两个通路可能会是竞争性的平行反应,又或者Ⅰ、Ⅱ两相代谢物可分别对Ⅰ、Ⅱ两相代谢通路产生促进或抑制作用,故单独监测NADPH或者UDPGA依赖的通路都可能会导致一定的偏差,不能代表体内的真实生物转化情况,应同时启动两相代谢反应。本研究结果提示,顺式、反式二苯乙烯苷抑制作用均消失,提示二者存在Ⅰ相代谢过程,同时该代谢过程产生的代谢产物可有效降其肝毒性风险。
综上,本研究尝试从二相代谢酶角度出发,阐释何首乌所致肝毒性的作用机制及其可能的潜在肝毒性物质。实验结果初步证明何首乌中顺式、反式二苯乙烯苷经由Ⅰ相代谢后,对Ⅱ相代谢酶UGT1A1抑制作用消失,肝毒性风险降低。

