可见光下TiO2协同过硫酸盐光催化降解罗丹明
刘杨,郭洪光,李伟,张永丽
(四川大学 建筑与环境学院,成都 610065)
染料在纺织、印染、造纸、制革等领域得到普遍应用,给人体健康和环境污染造成潜在威胁.传统的生物法、物理法及简单的化学法难以达到完全去除的效果.自20世纪70年代,Fujishima等报道光辐射TiO2可持续光解水产生O2和H2以来,基于TiO2的光催化技术在光解水、杀菌净化、太阳能电池及光降解水中污染物等领域已得到广泛关注[1,2].研究发现:在可见光条件下,染料可以被TiO2光分解,降解机理如下式(1~5)所示[3].
(1)
(2)
(3)
(4)
(5)

基于此,本文研究了在可见光条件下,PS协同TiO2工艺对RhB的降解情况,考察了该工艺的关键控制因素及相关反应动力学模型,验证了体系中主要氧化活性物质种类,比对了该工艺对目标物的矿化效率,探究了TiO2的稳定性,为该复合工艺的应用提供了理论依据.
1 材料与方法
1.1 试剂与仪器
二氧化钛(TiO2,99.9%,北京百灵威科技);罗丹明C28H31ClN2O3、过硫酸钠Na2S2O8、氢氧化钠NaOH、高氯酸HClO4、黄腐酸FAs、甲醇MA、叔丁醇TBA、1,4-对苯醌BQ(AR,成都市科龙化学试剂),使用时未经进一步纯化;玻璃纤维滤膜(上海安谱实验科技);超纯水(成都优普生物).
实验用氙灯(北京普林塞斯,PL-X500C,500W);紫外分光光度计(上海元析,UV-8000);TOC分析仪(德国elementar,TOC II);pH 计(上海雷磁,PHB-4);数字光度照度计(MS 6612, MASTECH).
1.2 实验方法
实验装置:采用双层玻璃光反应器(内径约11 cm, 高8 cm),通过中间夹层的冷却水控制反应温度.氙灯光强通过电流调节的方式控制,本实验固定电流10 A,数字照度计测得光强为1745 mw/cm2.
实验步骤:配置20 mg/L的罗丹明B溶液共200 mL,称取一定量的TiO2粉末于反应器中,避光搅拌30 min.打开氙灯光源稳定3~5 min,盖上遮光板及滤光片(>420 nm),移开遮光板,加入一定体积的0.5 mol/L的过硫酸盐溶液,并开始计时.每隔一定时间取样,用0.45 μm的玻璃纤维滤膜过滤后测定.
2 结果讨论
2.1 动力学研究
为考察TiO2在不同体系条件下,由可见光照射后对RhB的降解情况,进行了4组对比实验.实验条件为:TiO2投加量均为0.5 g/L,氧化剂(H2O2和PS)浓度为1.0 mmol/L,RhB初始浓度为20 mg/L,初始pH(4.2±0.2),结果如图1a.采用一级动力学模型拟合在不同体系条件下,RhB随反应时间的降解情况,结果如图1b,其中kobs为一级动力学反应速率常数(min-1),c(RhB)为罗丹明浓度.

a)ct/c0;b) 一级动力学拟合:PS的R2=0.86, Kobs=0.002 min-1; 可见光+TiO2的R2=0.97, Kobs=0.018 min-1; 可见光+TiO2+ H2O2的R2=0.98, Kobs=0.024 min-1; 可见光+TiO2+ PS的R2=0.98, Kobs=0.053 min-1图1 不同工艺对RhB降解的影响Fig.1 Effect of different processes on RhB degradation

一级反应动力学参数如表1所示.由表1可见:在可见光/TiO2/氧化剂的体系中,RhB的降解符合一级反应动力学,并呈现出很好的线性.
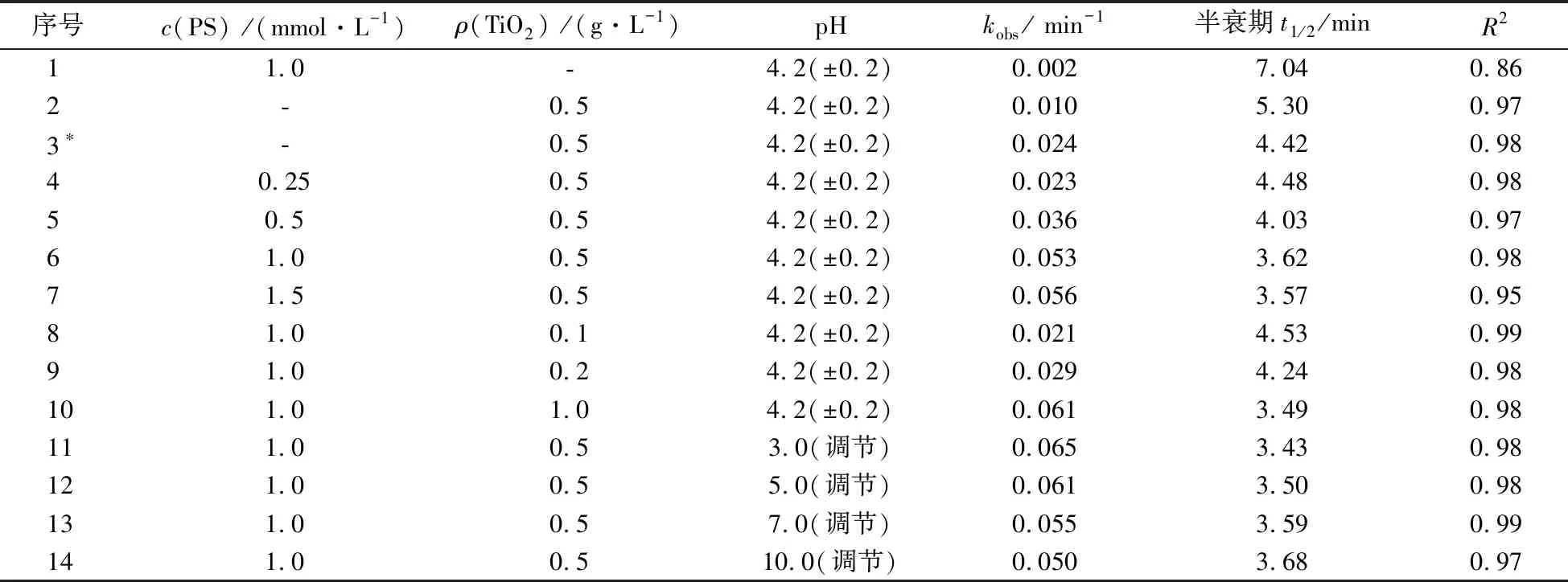
-dc(RhB) /dt = kobsc(RhB). (6)
注:*表示c(H2O2) =1.0 mmol·L-1
2.2 过硫酸钠浓度影响
当RhB浓度为20 mg/L,TiO2投加量为0.5 g/L,初始pH为4.2±0.2时,PS浓度在0.25 ~1.5 mmol/L过程中,可见光/TiO2/PS/体系RhB降解变化,结果如图2所示.

图2 PS浓度对RhB降解的影响 Fig.2 Effect of PS initial concentration on RhB degradation
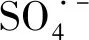
(7)
(8)
2.3 催化剂投加量影响
TiO2浓度为0.1,0.2,0.5,1.0 g/L 时,体系中RhB不同降解效率结果见图3.

图3 TiO2投加量对RhB降解的影响Fig.3 Effect of TiO2 dosage on RhB degradation
由图3可知:随着TiO2投量的增加,RhB的降解逐渐增加;在TiO2浓度为0.1~0.5 g/L,RhB的降解效率变化较快;由0.5 g/L增至1.0 g/L时,RhB去除率仅由96.4%增至97.6%,变化不明显.当TiO2浓度增加到一定量时,光降解速率受到严重影响[9],因为体系过量的TiO2使溶液浑浊度增加,光透性受阻,光电子转移效率降低,目标物的降解速率受限[10].此外,如2.1中表1中显示:当TiO2投加量增至1.0 g/L时,RhB的降解速率常数由0.053 min-1增至0.061 min-1,增加率仅为13.1%.故本实验体系中TiO2的最佳投量为0.5 g/L.
2.4 pH影响
当RhB的初始浓度为20 mg/L,PS投加量为1.0 mmol/L,TiO2投加量为0.5 g/L时,分别用0.1 mol/L的NaOH溶液和0.1 mol/L的HCl,调节pH至3.0,5.0,7.0,10.0,并与未做调节的体系作比较,结果如图4所示(不同pH条件下的一级动力学参数见表1).由图4可知:在PS协同TiO2光降解RhB体系中,加入酸碱调节后的反应体系与未做调节的体系基本无变化,说明pH对于RhB的降解影响较小.因此,在其他影响因素探讨中,反应体系保持初始pH不变.

图4 溶液初始pH对RhB降解的影响Fig.4 Effect of initial pH in the solution on RhB degradation
2.5 天然有机物影响
黄腐酸(FAs)作为一种天然有机质的复合体,其性质与腐殖酸相似,在自然环境条件下,天然有机质会淬灭高级氧化中生产的自由性活性基团[11]. 当RhB初始投加量为20 mg/L,PS浓度为1.0 mmol/L,TiO2投加量为0.5 g/L时,FAs初始投加量分别为10,20,30,40 mg/L,FAs对PS协同TiO2光降解RhB的影响结果见图5.

图5 FAs对RhB降解的影响Fig.5 Effect of the fulvic acids on RhB degradation
由图5可知:加入不同浓度的FAs后,RhB的降解效率均受到抑制,且FAs初始浓度越大,抑制效果越明显.在反应前5 min,加入FAs抑制效果不明显,由于体系中存在大量PS,生成了过量的活性基团,使RhB降解能够持续进行;而随着反应进行,PS浓度降低,生成的活性基团大量被体系中FAs捕获,使RhB降解速率减缓[12].
2.6 自由基验证实验
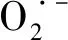

图6 3种自由基抑制剂对RhB降解的影响Fig.6 Effect of three kinds of free-radical inhibitors on RhB degradation
2.7 TOC变化
可见光/TiO2/PS体系中目标物矿化程度的考察结果见图7.

图7 可见光/TiO2/PS体系降解RhB体系TOC变化Fig.7 TOC changes with RhB degradation in the Vis-light/TiO2/PS system

2.8 材料稳定性
在相同条件下,将反应后TiO2回收进行材料稳定性实验,结果如图8所示.

图8 材料可重复及稳定性Fig.8 Stability and reusability of material
由图8可知:TiO2在经过5次回收利用后,RhB去除率仍保持在95%以上.说明在可见光照射TiO2,PS协同过程中,TiO2提供了光电子的转移通道,其具有强氧化性的空穴,而原表面结构未发生变化,材料性质稳定,可实现多次重复使用.
3 结语
PS能够有效强化可见光/TiO2光解RhB效率,降解RhB过程符合一级反应动力学;PS初始浓度与TiO2投加量对RhB降解具有重要影响,最优投加量为1.0 mmol/L和0.5 g/L;溶液初始pH对RhB降解影响较小,而天然有机物黄腐酸对于RhB降解具有显著抑制作用,随着浓度升高,抑制效果加强;自由基实验表明硫酸根自由基与超氧自由基是可见光/TiO2/PS体系中主要的活性自由基团;该复合工艺能够有效矿化RhB,反应120 min后,TOC去除率为58.2%;TiO2经过5次回收利用后,仍保持较高的催化活性.

