2019年1月美国、欧盟和日本新批准药物概述
孙友松
(上海递鸽医药科技有限公司,上海 201210)
1 2019年1月美国FDA新批准药物
2019年1月,美国FDA共批准6个新药,包括1个新剂型、1个新生物类似药和4个新增适应证药物(见表1)。
2 2019年1月欧盟新批准药物
2019年1月,欧盟委员会(European Commission,EC)共批准7个新药,包括1个欧盟首次批准的新分子实体(马昔瑞林)、1个欧盟首次批准的新生物制品(apalutamide)和5个新增适应证药物(见表2)。
3 2019年1月日本新批准药物
2019年1月,日本厚生劳动省(Ministry of Health,Labour and Welfare,MHLW)共批准15个新药,包括3个全球首次批准的新分子实体(美洛加巴林、艾沙利酮、瑞卢戈利),1个全球首次批准的新生物制品(romosozumab),5个日本首次批准的新分子实体,2个新复方和4个新增适应证药物(见表3)。
3.1 美洛加巴林
美洛加巴林是一种GABA受体激动剂,由日本第一三共公司研发,商品名为Tarlige®。2019年1月8日,日本PMDA批准美洛加巴林用于治疗周围神经性疼痛,包括糖尿病周围神经性疼痛和疱疹后遗神经痛[1]。
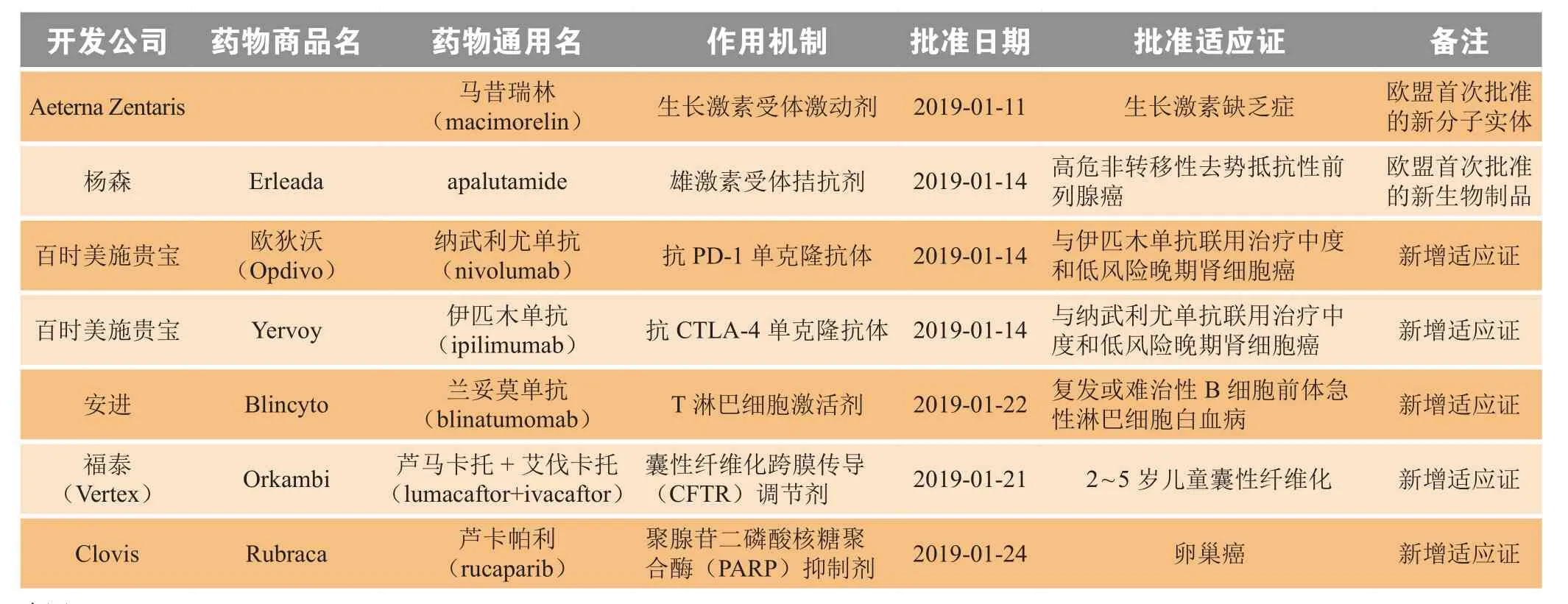
表2 2019年1月欧盟新批准药物Table 2 New drugs approved by European Commission in January 2019
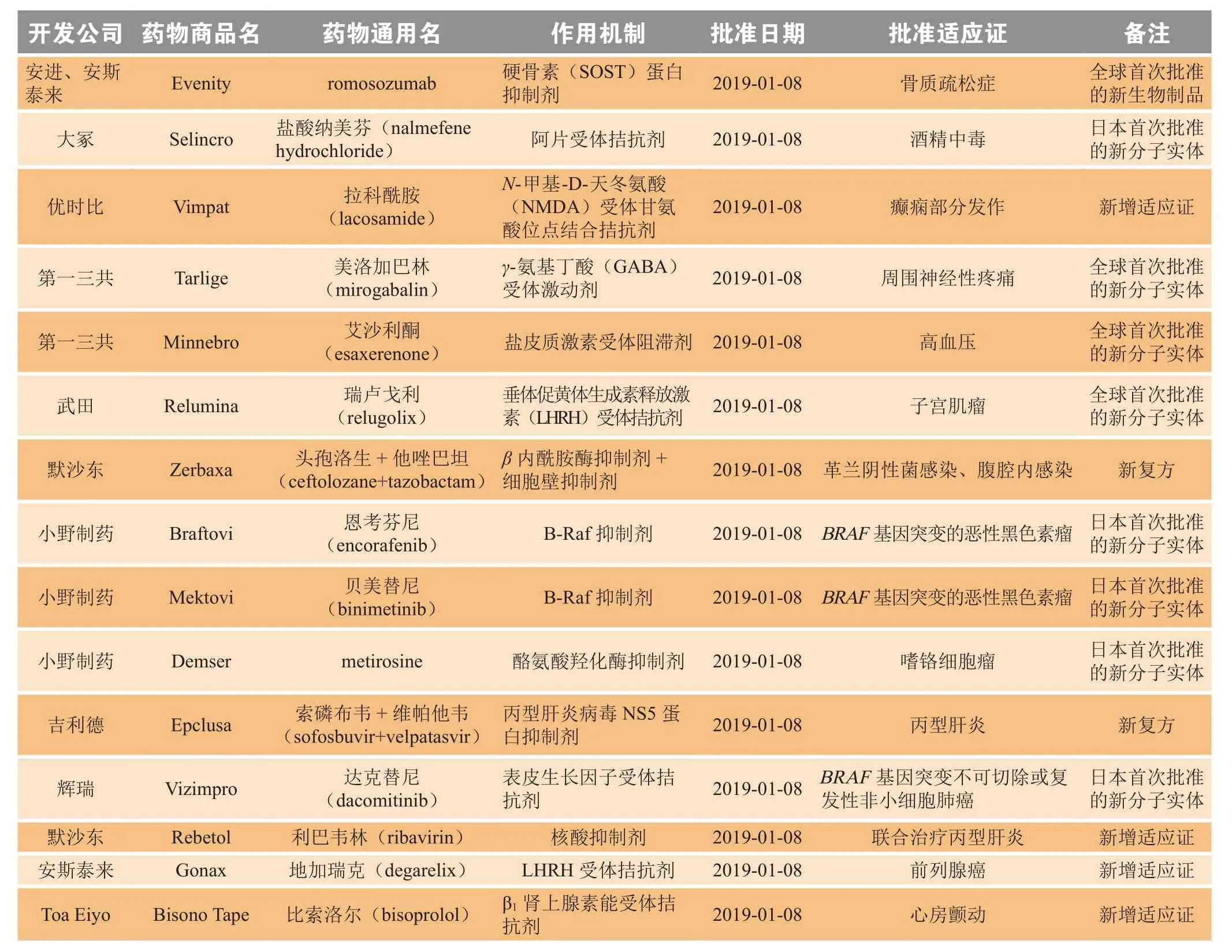
表3 2019年1月日本新批准药物Table 3 New drugs approved in Japan in January 2019
美洛加巴林此次获得日本PMDA批准基于2项随机、多中心、双盲、安慰剂对照Ⅲ期临床研究(REDUCER研究, NCT02318706和NEUCOURSE研究, NCT02318719)结果,这2项研究已在日本、韩国、菲律宾、马来西亚、新加坡等国开展。研究结果显示:与安慰剂组相比,美洛加巴林组从基线日期至第14周,每周平均每日疼痛评分(average daily pain score,ADPS)显著降低,且具有统计学意义[2]。
3.2 艾沙利酮
艾沙利酮是一种盐皮质激素受体阻断剂,由日本第一三共公司与美国Exelixis公司合作研发,商品名为Minnebro®。2019年1月8日,日本PMDA批准艾沙利酮用于治疗高血压[3]。艾沙利酮此次获得日本PMDA批准基于一项随机、多中心、双盲、安慰剂对照Ⅲ期临床研究(ESAX-HTN研究,NCT02890173)结果,该研究评价了艾沙利酮的有效性和安全性。
3.3 瑞卢戈利
瑞卢戈利是一种垂体LHRH受体拮抗剂,由日本武田公司和Myovant公司合作研发,商品名为Relumina®。2019年1月8日,日本PMDA批准瑞卢戈利用于治疗女性子宫肌瘤[4]。瑞卢戈利此次获得日本PMDA批准基于2项随机、双盲、安慰剂对照Ⅲ期临床研究(LIBERTY 1研究,NCT03049735和LIBERTY 2研究,NCT03103087)结果,研究发现过量的盐皮质激素受体激活与高血压有关,并且该药物通过阻断这些受体激活而发挥抗高血压作用。

