制冷剂水合物相变热的确定
汤小蒙,孙志高,王 茂,李 娟
(苏州科技大学 环境科学与工程学院,江苏 苏州 215009)
气体水合物是由一种或数种气体或易挥发性的液体与水在一定的温度和压力条件下形成的非化学计量型的笼型晶体化合物[1],外形类似于冰,由于其可在0℃以上生成,故又称“暖冰”。目前已发现的气体水合物晶体结构有3种,即Ⅰ型、Ⅱ型和H型,常见的气体水合物有甲烷水合物、二氧化碳水合物、HCFC141b水合物等[2]。大多数气体水合物形成压力较高,通常需要向体系中加入低压水合介质来降低形成压力[3]。水合物的相变热是指水合物在相变过程中吸收或放出的热量,水合物作为蓄冷介质,其相变热的大小直接反应蓄冷能力。水合物的相变热是选择蓄冷材料时的一个重要参数。相变热大,可减少蓄冷材料用量,减小蓄冷槽的容积,从而进一步降低系统初投资和占地面积,提高系统的经济性。因此,确定水合物的相变热对于蓄冷材料的选择以及系统的初投资都有重要的作用。水合物相变热主要有两种确定方法,一种是利用量热技术直接测量[4];另外一种是利用水合物相平衡数据,通过Clausius-Clapeyron方程式计算[5-8]。
1 试验装置与过程
1.1 试验装置和样品
图1是试验装置图,主要包括高压反应釜,低温恒温水浴,温度压力测量装置以及搅拌装置等。高压反应釜容积为500 cm3,耐压20 MPa,侧面配有用于观察水合物形成与分解过程的玻璃窗,釜内装有磁力搅拌器,用于搅拌试验流体和水合物晶体。低温恒温水浴的控温精度为±0.1℃,控温范围-19.99~99.99℃,温度的波动值为±0.05℃。反应釜中温度的测量用精度为±0.1℃的Pt100铂电阻测得,压力由绝对压力传感器(PTX7517)测定,精度为±0.2%。试验中所用电子天平的量程为220 g,精度为±0.1 mg。
试验所用材料为二氧化碳(苏州鸿运工业气体有限公司提供,纯度为99.99%);四氢呋喃(纯度≥99%);环戊烷(纯度≥95%);HCFC141b(纯度≥99.5%);蒸馏水为实验室自制。
1.2 试验过程
为探究四氢呋喃(THF)浓度对二氧化碳水合物的影响,试验测量THF浓度分别为7.26%wt、10.24%wt和19.05%wt体系水合物形成条件。环戊烷(Cyclopentane)和HCFC141b与水不互溶,根据Gibbs相律,在二氧化碳水合物体系中,环戊烷和HCFC141b的量对其相平衡没有影响,为保证环戊烷和HCFC141b在试验过程中任何情况下都存在,添加过量的环戊烷和HCFC141b,其浓度分别为24.75%wt和32.57%wt。

图1 试验装置
在试验之前,先用蒸馏水冲洗反应釜内部3次,待干燥后用试验气体吹扫管路3次,最后抽真空。将试验试剂吸进反应釜内,二氧化碳从转样釜引入到反应釜内至设定值。把反应釜浸入到由乙二醇和水组成的恒温水浴中,降低釜内的试验流体温度以形成水合物。当从玻璃窗观察到大量水合物形成时,加热试验流体使其分解。每次升温的幅度为0.1℃,并且保持温度稳定3~5 h。在水合物完全分解前,每一次升温都可观察到釜内压力上升,因为水合物分解释放出二氧化碳气体。一旦釜内水合物完全分解了,可观察到压力略有上升。根据水合物分解过程的压力和温度参数绘成P-T曲线,水合物相平衡点就是P-T曲线斜率急剧变化的点。
1.3 水合物相变热的计算
水合物相变热由两部分组成:水由水合物相转变为液相引起的焓差和气体水合物相转变为气相引起的焓差。水合物的相变热可由Clausius-Clapeyron方程计算求得:

式中,Peq和Teq为水合物相平衡压力和温度;ΔHd为水合物相变热;Z为压缩因子;R为通用气体常数。
压缩因子Z可用PT方程[9-10]计算求得,PT方程为

式中,a(T)为温度的函数。 其中

式中,下标c为临界参数;r为对比参数。Ωa、Ωb和Ωc的计算方法如下

而Ωb是下式中最小的正根

上述诸式中的ξc及F是两个经验参数,由纯物质的饱和性质求得,也可根据以下两式计算求得:

式中,ω为偏心因子。
PT方程压缩因子的三次展开式:

其中

2 结果与讨论
2.1 水合物形成条件
根据二氧化碳、二氧化碳-四氢呋喃、二氧化碳-HCFC141b和二氧化碳-环戊烷四个体系水合物相平衡条件可获得式(1)左边水合物相平衡压力的对数与相平衡温度的倒数曲线的斜率,见图2-图4。

图2 纯二氧化碳水合物lnP和1/T的拟合关系

图3 二氧化碳-四氢呋喃水合物lnP和1/T的拟合关系

图4 二氧化碳-HCFC141b和二氧化碳-环戊烷水合物lnP和1/T的拟合关系
表1列出了上述图中各拟合直线的斜率。相比于纯二氧化碳水合物,添加了低压水合介质后的直线斜率的绝对值明显增加,表明相平衡压力显著降低。这是因为二氧化碳-水体系形成结构Ⅰ型水合物,与之相比,添加低压水合介质使得水合物结构发生改变(从Ⅰ型向Ⅱ型转变)[11],导致相平衡压力下降。
2.2 水合物相变热
表2所列为纯二氧化碳水合物在各个相平衡条件下的相变热计算结果。其中Peq和Teq分别是水合物相平衡压力和温度,ΔHd为相变热。从表2可以看出,在1.805~3.830 MPa范围内,最小压力为1.805 MPa时,压缩因子为0.697 4,相变热为60.31 kJ/mol,而在最大压力为3.830 MPa时,压缩因子为0.867 6,相变热为75.02 kJ/mol,压缩因子变化了0.170 2,影响了相变热的计算值。这是因为二氧化碳气体可压缩性较强,因此,二氧化碳气体的压缩因子在高压范围内变化较大。为了减小压缩因子对相变热的影响,本文选取压力平均值对应的压缩因子,即最大压力和最小压力的算术平均值Pmid对应的压缩因子Zmid。利用计算得出的算术平均值2.818 MPa,求得Zmid=0.788 86,得到二氧化碳水合物相变热ΔHd=68.22 kJ/mol。Kang[12]测量出二氧化碳水合物相变热约为65.22 kJ/mol,两者相差4.6%,说明该方法是可行的。
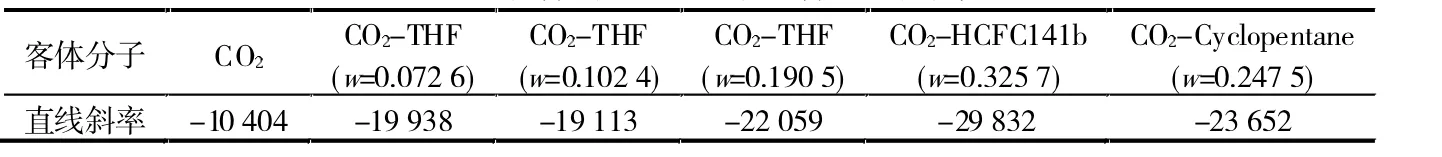
表1 水合物形成条件拟合直线斜率
表3所列为根据上述方法计算获得的水合物相变热。计算结果表明,随着THF质量浓度的增大,二氧化碳-四氢呋喃水合物相变热增加。Delahaye等[13]发现二氧化碳-四氢呋喃水合物的相变热约为纯二氧化碳水合物相变热的两倍,与计算结果类似;二氧化碳-HCFC141b水合物的相变热高达232.93 kJ/mol,二氧化碳-环戊烷水合物的相变热与二氧化碳-HCFC141b接近,为248.27 kJ/mol,目前这两种体系的水合物相变热数据缺乏,需要利用差示扫描量热仪等仪器设备进行试验测量。

表2 纯二氧化碳水合物相变热

表3 水合物相变热计算结果
3 结论
利用CO2、CO2-THF、CO2-HCFC141b和CO2-Cyclopentane体系水合物相平衡条件确定了对应水合物的相变热,得出以下结论:(1)使用PT方程以及压力平均值计算出对应的压缩因子,求得纯CO2水合物的相变热与文献中测量的数值相差4.6%;(2)相比于纯CO2水合物,低压水合介质的加入使得水合物结构发生改变,降低了相平衡压力;(3)随着THF质量浓度的增加,CO2-THF水合物的相变热也增加;CO2-HCFC141b和CO2-Cyclopentane体系的相变热均大于200 kJ/mol。

