温光诱导对甜菜抽薹和开花研究概述
梁乃国,程大友,崔 杰,代翠红,刘天骄,李俊良
(1.淮阴工学院; 2.哈尔滨工业大学,哈尔滨 150001)
0 前言
甜菜(BetavulgarisL)是一种重要的农作物,每年承担了世界上大约30%的糖产量。甜菜是一个高度多样性的物种,分为可食用甜菜、叶用甜菜、饲用甜菜和糖甜菜等等。叶用甜菜在罗马时代就已经栽培,而糖甜菜是最近培养的作物之一。糖甜菜是典型的二年生作物,与其他开花植物一样,由营养生长转化为生殖生长是由其发育阶段和外界刺激,如温度和光照时间长短相互作用决定的。春化是许多植物发育所必须的,春化(4-5℃)处理随后加以长日照(long-day,LD,16 h/8 h)诱导植物开花。多年来一直观察到环境对糖甜菜抽薹、开花的影响,但分子机制还有待充分阐明。
开花是植物生殖生长的一个典型形态特征。模式植物拟南芥全基因组测序已经完成。拟南芥开花的分子机制研究得比较透彻,研究发现拟南芥有四个开花途径:自主途径、赤霉素途径、春化途径和光周期途径,并且探明了与这4个途径相关的内源和外界信号。其它植物的抽薹和开花机制的研究主要是建立在拟南芥研究的基础之上。糖甜菜的抽薹和开花是由春化途径、光周期途径和激素途径协同介导的结果。根据基因的同源性,甜菜抽薹和开花相关基因的鉴定与克隆及2个甜菜开花模型的提出为研究甜菜抽薹和开花的分子机制奠定了前期基础。2013年甜菜基因组草图图谱绘制完成,为后续甜菜的功能基因研究提供了信息。
糖甜菜属于长日照(long-day,LD,16 h/8 h)二年生作物,第一年为营养生长,形成肥大的块根,第二年为生殖生长,抽薹、开花和结籽。但在糖甜菜生产实践中,常常出现当年抽薹开花的现象,即:早抽薹。早抽薹对甜菜块根的质量和产量均有不同程度的负面影响。研究发现早抽薹糖甜菜根的重量,含糖量,清汁纯度和可回收的糖含量均显著降低,阻碍蔗糖结晶的有害成分如K+、Na+和α-N则明显增加。并且早抽薹糖甜菜根部解剖结构分析显示维管束环数较正常植株显著减少、根的木质化程度严重、纤维化明显,所以早抽薹糖甜菜块根在制糖工业生产上加工价值降低或失去加工价值。
1 春化途径与光周期途径
1.1 春化基因
植物根据外部刺激和内源性信号调节发育的进程。春化作用在优化开花植物的生殖适应性和促进植物从营养生长向生殖生长转化过程中起到关键的作用。春化作用(vernalization)一般是指植物必须经历一段时间的持续低温处理才能由营养生长转化为生殖生长的现象,即:通过寒冷处理获得或加速开花的能力。被子植物中春化基因(VERNALIZATION)在发育过程中具有重要的作用,春化需求存在于大量的开花植物体中,含有春化基因且对低温响应的物种包括禾本科的大麦和小麦、十字花科的拟南芥和豆科的苜蓿(Medicagotruncatula)[3,4]。冬季长时间的低温是植物感知季节变化的关键刺激因素。春化途径在促进作物加速开花结实方面具有重要的农业实践意义,春化对植物的作用稳定持久,可持续到有丝分裂期即使其脱离春化环境。遗传学和生理学研究发现小麦,大麦和拟南芥的春化途径基因。遗传分析表明,在小麦和大麦中VERNALIZATION1(VRN1)是春化作用的主要决定基因, 控制春化作用并诱导开花[5]。在小麦中,春化由Vrn-1,Vrn-2,Vrn-3和Vrn-4四个主要基因控制,其中Vrn-4基因的鉴定对于加强我们对温带谷物中春化途径的理解具有非常重要的意义,春化途径的进化在温带谷物中似乎已经独立于双子叶植物。拟南芥中FT-like1(FT1)基因(也称为VIN3)在春化持续性检测和春化反应基因表达级联变化之间具有最直接的相关性[6]。在苜蓿中,春化后施加长日照诱导FTa1基因表达上调,与长日照条件下拟南芥中FT-like1(FT1)基因的调节不同[7]。洋葱(AlliumcepaL)也是一个二年生作物,春化期间AcFT2基因的表达上调,促进其开花[8]。
1.2 春化基因作用的分子机制
春化作用一般是指植物必须经历一段时间的持续低温才能由营养生长阶段转入生殖阶段生长的现象。植物春化后体内分子的稳定性变化贯穿于后续的有丝分裂期,这一过程源于表观遗传学沉默。VRN1基因编码一个与春化基因相关的MADS-box转录因子(以原型基因MCM1,AGAMOUS,DEFICIENS,SRF1命名的一类转录因子),春化激活叶片和茎尖中VRN1基因的表达,这些组织中VRN1基因表现出高水平的表达,促进谷物的开花[9]。VIN3基因是含有蛋白的植物同源结构域(PHD)模体,是附加成员:VIN3-LIKE1 /VERNALIZATION5(VIL1/VRN5)通过VIL4或VERNALIZATION5/VIN3-Like1-3(VEL1-3)组成的蛋白家族的一部分[10]。研究发现在春化过程中,SETDOMAINGROUP7(SDG7)对于VIN3的诱导作用非常重要,若SDG7缺失会诱导产生春化超敏感表现型,如同低温介导VIN3基因的表达快速上调[11]。研究还发现VERNALIZATION5(VRN5)基因含有一个PHD指蛋白,该基因是VIN3的同源物并且VRN5和VIN3形成的异源二聚体对于建立春化诱导的染色质修饰,组蛋白脱乙酰化和H3赖氨酸27三甲基化的FLC表观遗传沉默具有非常重要的作用[10]。VRN2是一个开花抑制因子,春化抑制VRN2基因的表达,在长日照条件下叶片中VRN2基因的表达下调,VRN1基因可能通过调节VRN2基因的表达促进FT1基因的转录,VRN2基因的编码产物含有与拟南芥FERTILIZATION-INDEPENDENTSEED2(FIS2)和EMBRYONICFLOWER2的两个发育抑制因子、果蝇Polycomb群体(PcG)蛋白抑制剂(SU[Z]12)2(EMF2)相似的核定位锌指结构蛋白。在古代南亚亚种小麦的大多数种质中发现了VRN-D4基因并证实了春化调节的VRN-D4基因与开花时间具有直接的相关性[12]。因为在VRN-D4第一内含子调节区域中的三个相邻的SNP破坏了GLYCINE-RICHRNA结合蛋白2(TaGRP2)的结合能力,该结合蛋白是VRN1基因表达的抑制因子,它们抑制了VRN1基因表达抑制因子的结合作用[13]。
1.3 春化作用的表观遗传学机制
1.3.1 春化的记忆性
前人已经开展了大量的春化的表观遗传学调控机制研究。早期研究发现春化与细胞记忆的形式有关并且这种记忆性可以维持数周,直到诱导植物发育的最优光照条件到来。植物保留春化记忆性与春化促进开花的机制一致:发芽的种子长期暴露于低温条件下,当转移到正常生长温度时便会迅速启动花芽发育,所以植物的春化记忆性,在后续的发育过程中表现出春化后的作用[14]。春化记忆的分子基础在拟南芥中已经证明:春化引起开花抑制基因FLOWERINGLOCUSC(FLC)染色质结构发生改变,该基因转化为稳定的有丝分裂抑制状态。春化作用对这些分子的影响贯穿于后续的有丝分裂过程,这一过程是由表观遗传学作用控制的,即使起初的环境胁迫去除后,春化作用对细胞的影响也是永久性的。植物开花后,春化的记忆性可能在种子中重置,使得春化反应在下一代中重现。
1.3.2 春化作用与蛋白质修饰
小麦和大麦中VRN1等位基因的启动子区域是转录起始位点附近的一个关键区域,该区域含有将VRN1基因维持在非活性状态所需的抑制因子重复元件,春化期间和春化后,VRN1的活性发生变化。染色质的状态(将DNA和相关组蛋白包装成更高级的结构)似乎是VRN1基因活性不可或缺的决定因素,春化后大麦中VRN1基因染色质上的H3K27Me3水平降低,组蛋白修饰通常与活性组蛋白3赖氨酸4三甲基化(H3K4Me3)相关,说明春化诱导VRN1基因位点的染色质状态发生改变,春化后继续保持着VRN1基因位点组蛋白的修饰状态[15]。染色质修饰可以通过细胞分裂进行遗传。因此,组蛋白的修饰和染色质状态的相关变化可能促使VRN1基因在春化后仍保持活性。充分的春化处理也会促使拟南芥开花抑制基因FLOWERINGLOCUSC(FLC)的染色质状态发生改变,拟南芥中的表观遗传学机制是由VRN2、VRN1、VIN3、VRN5/VIL1和PRMT5基因协同作用的结果。
春化抑制VERNALIZATION2(VRN2)基因的表达,VRN2基因编码一个核定位锌指结构蛋白类似于果蝇zeste12(SU[Z]12)的Polycomb(PcG)组蛋白抑制因子和拟南芥中的两个发育抑制因子,FERTILIZATION-INDEPENDENTSEED2(FIS2)和EMBRYONICFLOWER2(EMF2)。VERNALIZATION5(VRN5)基因是VIN3基因的同系物,编码一个PHD指蛋白,VIN3也编码一个PHD蛋白,在充分春化处理期间,VRN5和VIN3形成的异二聚体对于建立春化诱导FLC位点表观遗传沉默所需的染色质修饰,组蛋白脱乙酰化和H3赖氨酸27三甲基化是必要的。大多数植物,动物和真菌中普遍存在PRC2元件且该元件在各物种中具有高度的保守性,植物PRC2特异性相关蛋白VERNALIZATIONINSENSITIVE3(VIN3)是春化作用中必不可少的元件并且在低温条件下特异性表达[16]。最近的研究发现由VIN3,VRN2和CLF/SWN-E(z)蛋白组成的大分子量(w1000kDa)蛋白质复合物是春化诱导VRN5/VIN3与VRN2-PRC2-like复合物相互作用导致表观遗传学沉默的关键。VRN5和VIN3形成的异二聚体对于建立春化诱导的染色质修饰、组蛋白失活、FLC基因表观遗传学沉默所需的组蛋白H3Lys9(H3K9)和H3Lys27(H3K27)的甲基化非常重要。春化诱导拟南芥的表观遗传学沉默涉及蛋白质元件VIN3,春化可能诱导其富集增加,进而诱导FLC染色质上VIN3-PRC2复合物的富集,然而VIN3基因在春化期间是瞬时表达的,因此VIN3基因在春化处理期间以定量阈值的方式“稳定”抑制FLC基因的作用,若春化作用不充分会导致细胞中FLC基因不稳定性沉默进而导致春化反应的高度变异性[17]。研究表明春化诱导拟南芥中FLC基因的表观遗传学沉默状态仅在生殖生长期间重置,而在体外再生期间不重置,相比之下,经过体外再生后仅部分保持了FLC基因的表观遗传学活性状态,表明再生引起FLC基因沉默的随机性[18]。
1.3.3 春化过程DNA的甲基化
春化诱导DNA甲基化的两个主要作用:去甲基化处理可以模拟春化对植物开花的影响;植物全基因组中DNA甲基化的缺失会诱导早开花表现型。在模式植物拟南芥中,春化抑制其开花抑制基因FLOWERINGLOCUSC(FLC)的表达不直接受DNA甲基化修饰的影响。春化仅诱导拟南芥幼苗基因组DNA甲基化的降低。春化诱导拟南芥开花抑制基因FLC位点组蛋白赖氨酸9和27三甲基化的增加。研究证明DNA甲基化的动力学变化是植物和动物体中表观基因组活性重组的一种方式,同时,DNA甲基化/去甲基化的动力学变化使得植物以及时的方式应对环境变化,例如春化处理对表观基因组可塑性具有非常重要的作用。甜菜DNA超甲基化处理诱导细胞表型和细胞壁分化状态的修饰发生变化,且甲基化程度与细胞变化呈线性关系。然而,甜菜中BvCAC、Bv5S、BvFLC和BvVIN3基因的DNA甲基化变化不遵循全基因组的甲基化动力学规律[19]。DNA甲基转移酶可以进入线粒体DNA上的不同位点,并可能被转移到线粒体中,这取决于春化诱导蛋白质水平的变化。春化诱导甜菜茎顶端分生组织中DNA甲基化变化的幅度对于甜菜抽薹发育是至关重要的,通过比较研究春化后三种抽薹抗性基因型和三种抽薹敏感基因型的茎顶分生组织,发现了春化诱导甜菜DNA甲基化的几个功能靶标,与核DNA相比,R基因型甜菜线粒体基因组比S基因型具有更高的相对甲基化水平[20]。表明春化诱导DNA甲基化的表观遗传模式参与了基因表达的调控和有丝分裂的传递。
1.3.4 春化过程RNA元件的作用
RNA分子具有编码序列信息的功能并且具有很好的结构可塑性。RNA可以通过碱基配对-连续的或二级结构桥接形成强的结构域或在特殊情况下形成三重结构直接与DNA和其他RNAs相互作用,高度结构化的RNA也可以为结合蛋白提供对接站。全基因组研究显示,真核生物基因组广泛的转录成数千个长的和短的ncRNAs[21]。长链非编码RNAs(lncRNAs)已经参与了基因调控作用,如染色体剂量补偿,印记,表观遗传调控,细胞周期控制,核和细胞质运输,转录,翻译,剪接,细胞分化等等。现在越来越明确的是ncRNA是基因组的重要转录产物。LncRNAs最明确的功能是:第一,通过富集用于特定基因座染色体修饰的蛋白质进行表观遗传调控基因的表达。第二,已知lncRNA抑制微小RNA(miRNAs)与其靶向mRNA之间的物理性相互作用,从而控制靶向mRNA编码的蛋白质水平。最后,lncRNA通过选择性剪接结合和隔离所需的蛋白质控制可变剪接[22]。
非编码RNA(ncRNA)与研究得比较清楚的信使RNA(mRNA)不同,ncRNA不能编码蛋白质,通常根据任意长度的截断值分为两类,其中200个核苷酸以内的称为短/小ncRNA,如microRNAs(miRNAs),而大于200个核苷酸的称为lncRNAs[23]。lncRNAs在各种细胞和组织中表现出差异表达的特征和多元调节作用,新的研究表明lncRNA与增强子区域相关联,并且这种非编码RNAs的转录可以增加相邻基因的转录活性[24]。所有的这些研究增强了我们对复杂生物学作用的理解。lncRNA是潜在的顺式调节因子和基因活性的反式调节因子,它们作为染色质修饰复合物和核体的映射,作为增强子和大范围染色质相互作用的介质而发挥生物学功能。在动物体中,已经证明多个lncRNA通过与基因的特异性染色质结构域相互作用,靶向抑制组蛋白的活性修饰,以表观遗传学的方式沉默基因的转录。已经鉴定出与PRC2复合物相互作用的数千个lncRNAs,其中包括启动子转录物,蛋白质编码基因的正义和反义转录本以及基因印迹位点等等[25]。PRC2复合物通过EZH2直接与lncRNAs的茎环结构结合,表明lncRNAs能够使PRC2复合物富集。在拟南芥中鉴定出与春化处理相关的COLDAIR基因,该基因从FLC基因的第一内含子区转录,研究发现COLDAIR基因和PRC2复合物之间的物理性相互作用在春化处理期间瞬时增强并且春化作用富集PRC2复合物到FLC基因的染色质上是COLDAIR与PRC2相互作用的前提,因此春化诱导COLDAIR基因的表达与PRC2复合物协同维持FLC基因的稳定性沉默。最近的研究发现在春化期间COLDAIRlncRNA介导了PRC2复合物对FLC的抑制作用[26]。lncRNAs的“双茎环”结构是PRC2复合物与体外核糖核酸关联的重要结构域,并且“双茎环”结构可以形成少于100个核苷酸的结构域,便于体外结合PRC2复合物,有趣的是,PRC2不是唯一一个与lncRNAs上的组蛋白结合的修饰复合物,lncRNAs介导的沉默,也包括HOX基因抑制中的HOTAIR基因[27]。FLC基因位点的另一个lncRNA,命名为COOLAIR,它参与了FLC基因春化依赖性短暂的转录沉默,然后通过Polycomb多梳体增强并维持表观遗传学沉默作用;在缺乏COOLAIR序列的FLC-GUS转基因品系中可能存在一个Polycomb多梳体独立的沉默途径,该途径经春化诱导可能行使反义转录作用[28]。FLC开花抑制基因多个直系同源物的3′末端含有COOLAIR基因和核心启动子的第一个外显子结构域,这些结构域比FLC基因位点已经鉴定出的大多数启动子区域和第一个内含子调控序列结构域更加保守[29]。在拟南芥春化过程中I类COOLAIR行使主要的生物学功能且春化处理增加其表达丰度,然而,在FLC基因位点缺乏3′末端区域的品系或其插入品系中,春化处理没有促进COOLAIR基因的表达。COOLAIR基因以Polycomb多梳体非依赖性方式进行转录,也可以沉默连锁序列,只是这些非编码RNAs可能行使顺式或反式的作用[30]。此外,在没有VIN3基因和PRC2复合物与非编码RNAs转录复合物相互作用的情况下,COOLAIR基因在春化过程中表达的持续时间更长,表明在春化作用下COOLAIR基因具有独立于Polycomb依赖性的功能。
2 光周期途径
2.1 光周期概述
光周期(Photoperiods)是影响植物生长发育最重要的环境因素之一。植物对光周期刺激作出反应后,经历一系列生物过程进入花芽分化阶段。植物开花基因的调控网络引起越来越多研究者的兴趣,植物感知光周期和季节的变化,调整自身生殖生长周期与一年中最有利的季节相一致,使其获得最优的生长状态。植物感知光周期长度并启动生殖生长的转化。光周期的季节性变化为植物同步发育提供了信号。植物根据启动生殖生长最有效的光周期,可以分为长日照(long-day,LD,16 h/8 h)和短日照(short-day,SD,8 h/16 h)植物。当日照长度超过特定的临界阈值时,长日照(LDs)植物开花,而短日照(SDs)植物在低于关键临界阈值时开花。这些阈值是每个植物物种的特征,主要由物种起源和适应性生长的区域决定的,例如,生长在热带低纬度的植物在短日照条件下就会开花,而生长在较高纬度的植物需要夏季长日照诱导其开花,大多数植物的开花发生在春季和夏季温暖的季节。另外温带地区的植物在冬季来临前发芽通常还需要春化作用才能够对光周期诱导做出反应。短日照作物包括水稻、玉米和高粱,长日照作物包括小麦、大麦、甜菜、萝卜。在这些作物的驯化和育种期间可以人为地改善日照时间的长短,以便于作物适应新的环境。尽管植物的不同光周期反应可以通过自然或人为的改变,但控制植物光周期开花的一些基本分子元件是高度保守的。
2.2 光周期基因
春化基因和光周期基因的变化决定了植物生命周期和发育阶段的持续时间。春化反应主要影响营养生长阶段的时间,而光周期反应既影响营养生长的时间也影响生殖生长早期的时间,如影响植物茎伸长(SE)阶段的生长时间[31]。在植物开花过程中光周期基因具有重要的作用。图位克隆确定了大麦光周期反应的主要决定基因Ppd-H1,该基因作为光周期反应的调节因子具有昼夜时钟节律功能。小麦的光周期基因PPD1位于2号染色体上,其等位基因为PPD-A1、PPD-B1和PPD-D1,研究与光周期基因PPD1敏感性不同的近等基因系(NIL)发现光周期诱导植物开花时间的差异取决于每个等位基因的性质[32]。大麦中的Ppd-H1基因是PseudoresponseRegulator(PRR)基因家族的成员,同源性比对分析显示Ppd-D1基因与大麦的Ppd-H1基因共线性;长日照LD诱导温带谷物早开花,而在短日照SD条件下则延迟开花。PHOTOPERIOD1(PPD1)基因是控制小麦和大麦日照长度敏感性的主要因素,长日照LD下PPD1基因的突变会降低VRN3/FT基因的表达,导致开花延迟[33]。PRRPHOTOPERIOD1(PPD1)基因参与FT基因的光周期激活,其负责小麦和大麦开花的大部分自然变异,含有显性PPD1基因表达高的植株FT基因也具有高表达水平并且表现出早开花表型,而含有隐性ppd1基因的植株FT基因表达水平也较低并且表现出晚开花表型[34]。PPD1蛋白与水稻和高粱的PRR37蛋白质是同系物,长日照LD条件下它们的开花都受到抑制。已经在小麦和大麦中鉴定出CO和Hd1基因的同源物,大麦中基因的过表达为研究Hd1基因的同源物在开花调控网络中的作用提供了依据[35]。拟南芥FLOWERINGLOCUST(FT)基因编码成花诱导蛋白,确定开花时间,而CONSTANS(CO)转录因子在长日照(LD)条件下直接激活FT基因的转录促进拟南芥开花。光周期调节拟南芥CO基因的表达对于光周期长度依赖性诱导FT基因的转录至关重要。最近的研究发现PHYTOCHROMEC(PHYC)基因为光周期途径的光受体,在光周期诱导条件下phyC基因的突变体植株表现出开花延迟表现型[36,37]。
2.3 光周期作用的分子机制
长日照LD和短日照SD条件下,大麦中HvCO1和HvCO2基因的过表达促进开花,但由于PPD1基因对HvFT1基因的独立控制,植物保留了光周期的敏感性[38]。有趣的是,在长日照LD和短日照SD条件下HvCO2基因的过表达使得VRN2基因的表达上调,尽管VRN2抑制因子表达增加,但HvCO2基因的过表达可能通过独立于VRN2基因的途径促进开花,因此,大麦的开花是由两个平行途径控制FT基因的表达控制的[39]。春化作用使得小麦叶片中VRN1基因抑制VRN2基因的表达,VRN2基因与水稻Ghd7基因相似且具有开花抑制因子共同的序列,在开花转化期间VRN2基因的表达下调,而VRN3基因表达升高。VRN3蛋白(在小麦和大麦中分别命名为TaFT和HvFT)是拟南芥和水稻成花素的同系物,在温暖的环境和长日照LD条件下迁移到茎顶端分生组织促进开花[40]。大麦和小麦的VRN3基因感知光周期信号促进开花的转化,如图1所示。

图1 小麦三个春化基因之间的遗传相互作用Fig.1 The interactions of three vernalization genes in Triticeae
双子叶植物拟南芥的光周期开花过程中的核心遗传和分子机制已经研究得比较明确。拟南芥或许不能完全代表所有植物物种,但它可以为研究其它植物物种提供实验研究的概念框架,也可以用于探讨远距离相关植物不同分子机制的进化。拟南芥FT基因与苜蓿FTa1基因相比较发现,苜蓿中的FTa1基因在长日照条件下是昼/夜循环组成型表达的,而拟南芥中的FT基因仅在长日照结束时直接由CO蛋白协同作用上调表达的。光周期诱导开花模型的关键基因CO的最突出特征是光依赖稳定性。长日照(LD)促进拟南芥开花,昼夜节律时钟控制环境反应中几个基因的节奏性表达,其中,GIGANTEA(GI)蛋白和FLAVINBINDINGKELCHREPEATF-BOX蛋白1(FKF1)在光周期期间表达,并以光依赖性的方式相互作用[41]。拟南芥GI基因在光周期开花途径中具有多重作用,首先,GI蛋白与FKF1同源物ZEITLUPE(ZTL)和LOVKELCH蛋白2(LKP2)相互作用,然后与FKF1一起协同靶向CYCLINGDOFFACTOR2(CDF2)蛋白,降解CDF2蛋白同时激活CO基因的转录,促进开花。另外,GI蛋白具有稳定FKF1和ZTL蛋白的作用;第二,GI蛋白与植物相关的FT基因抑制因子(SVP),TEMPRANILLO1(TEM1)和TEM2在植物体内形成具有生物学功能的复合体;第三,GI蛋白通过microRNA172(miR172)途径间接诱导FT基因的转录。调控RNA代谢是指导植物启动开花分子机制的关键组成部分。一组RNA结合蛋白通过自主开花途径发挥其作用。由微小RNA(miRNA)调控的转录后机制在开花时间控制中也起关键作用。研究证明GIGANTEA(GI)调节的miR172定义了一个独特的遗传通路,通过诱导独立于CONSTANS(CO)的FT基因调节光周期开花。值得注意的是,GI介导的miRNA加工通过光周期调节miR172的丰度,即使在没有功能性CO的情况下,植物体内miR172的过量产生在长日照和短日照下也表现出早开花,表明miR172通过一个CO非依赖性遗传通路促进光周期开花。因此,GI介导的光周期开花受两种不同的遗传途径协调相互作用控制:一种通过CO介导,另一种通过miR172及其靶介导[42]。长日照LD促进拟南芥光周期开花途径的中枢调节因子CONSTANS(CO)转录增加,而基因编码抑制因子CYCLINGDOFFACTOR(CDF)抑制CONSTANS(CO)的表达。研究发现GIGANTEA(GI)和F-box蛋白FKF1可以不同程度的增加CO的转录,证明FKF1相互作用蛋白GIGANTEA(GI)和ZEITLUPE(ZTL)参与CO稳定性调节[43]。FLAVIN-BINDING,KELCHREPEAT,F-BOX1(FKF1)蛋白在保持COmRNA和CO蛋白的适当光周期表达模式中起到关键性的作用[44]。拟南芥中除了主要的GI-FKF1-CDF模块外,还有一些机制有助于转录和转录后CO的表达,包括转录因子调控,COP1和CO在体内和体外通过CO的C末端区域相互作用,COP1主要在黑暗中促进CO的降解,然而,在光照下植物通过色素B依赖性机制,CO降解独立于COP1的作用,因此,COP1通过减少夜间CO的丰度从而延迟了短日照SD条件下的开花,有助于植物感知光周期的变化[45]。通过COP1泛素连接酶的活性促进CO的磷酸化增强了CO转化率,从而有助于光周期开花反应[46]。最近的研究发现拟南芥中的E3泛素连接酶高表达的OSMOTICALLYRESPONSIVEGENES1(HOS1)与CO物理性相互作用,使得CO富集,进而促进FT的表达,CO蛋白的丰度不仅受E3酶的调控,而且还通过两种CO变体之间的动态相互转换进行自主调节,包括CO的选择性剪接产生两种蛋白质变体,全长COα和缺乏DNA结合亲和力截短的COβ,这些研究结果表明,CO在拟南芥光周期开花期间维持其昼夜富集的动力学平衡[47]。同时发现植物色素B(phyB)能够调节开花时间,作用于韧皮部伴侣细胞,phyB与HOS1和CO物理性相互作用,表明这三种蛋白质可能存在于拟南芥光周期反应复合物中[48]。所以在长日照期间,CO表达形式是最高的,在昼夜循环时期,作用于韧皮部的伴侣细胞的CO蛋白质可以直接促进系统性开花信号元件FT的表达。CO蛋白对FT转录水平和节律性的影响由几类蛋白质包括转录因子和转录共调节子,光受体,组蛋白-like蛋白和泛素连接酶相互作用介导的[49]。因此,光周期开花途径尽管与其他调控途径大部分相互关联,但可以简化成线性分子级联,其主要输出是FT蛋白。充分春化的芸薹属植物中BrCKA2和BrCKB4基因的表达使得CK2活性增加,导致时钟基因BrCAA1光周期缩短,BrCAA1基因在植物感知光周期方面具有重要的作用[50]。在春化植物的叶片中VRN1下调VRN2的表达,长日照光周期诱导FT1基因转录促进开花。光周期是大麦VRN2基因位点的两个ZCCT基因HvZCCTa和HvZCCTb表达水平的主要决定因素。长日照光周期条件下,在冬季大麦中检测到HvZCCTa和HvZCCTb基因的高水平表达,春化长日照诱导HvVRN1基因表达,而HvZCCTb基因的表达受到抑制,因此,HvVRN1基因介导了春化反应,而HvZCCTa和HvZCCTb基因响应长日照光周期,长日照光周期抑制非春化植物的开花。
2.4 光周期途径的进化
长日照植物拟南芥及其开花时间的光周期控制一直是光照时间长短研究的模型。在拟南芥中,CO蛋白是光周期控制开花的中心元件,通过GI-FKF1,CDF和FLOWERINGBHLH(FBH)进行昼夜节律时钟和光周期调节CO的表达。光受体、E3泛素连接酶控制CO蛋白和与其相互作用的蛋白质的稳定性,这些复杂的调节使得开花基因FT正确表达[51,52]。然而,有多种不同的和特定的光周期开花调节机制,在短日照植物水稻中,CO蛋白质的同系物在长日照光周期条件下作为抑制因子,短日照光周期条件下作为激活因子,而另一个同系物COL无论在长日照还是短日照光周期条件下都抑制开花[53]。在苜蓿和豌豆中,CO似乎对开花时间没有影响,尤其是在后续的发育中,FT基因的表达仅由CDF基因控制[54,55]。进化的证据表明,CO启动子顺式调节元件的自然变化改变物种的开花时间。此外,植物会根据其地理位置进行不同开花机制的生态型局部适应性调整,水稻、马铃薯和大豆的光周期开花机制研究证明了植物可以优化其生殖生长的时间[56-58]。虽然CO是否是被子植物光周期开花途径中广泛存在的中心元件一直存在争议,但是GI-CDFs-CO-FT核心在远距离相关开花植物中是高度保守的。研究证明COLs和DOF调节因子已经从单一的普通藻类祖先,通过复制、扩增和发散模式进行了基因进化[59]。C.reinhardtii植物的单拷贝DOF(CrDOF)表达的CO(CrCO)蛋白质光周期诱导开花机制与拟南芥的不同,在短日照光周期条件下CrDOF通过与其启动子的直接结合诱导CrCO的表达,然而,在长日照光周期条件下,以不依赖CrCO的方式抑制细胞周期的进程[60]。CrCO是参与碳代谢和细胞周期等关键生理过程的中心枢纽,其表达受光周期控制,该基因突变严重影响藻类合成淀粉和细胞分裂与生殖生长的能力,当异位表达时,两个基因在拟南芥中都表现出同源性功能,CrCO诱导开花,而CrDOF延迟开花。有趣的是,COL1与CO具有80%的氨基酸相似性,但COL1基因的过表达不会诱导开花时间的变化,可能存在另一个进化机制:它必须含有藻类蛋白质保守的三级结构,通过植物调节机制和模拟同系物的功能进行识别,该进化机制可能不是独立性的,因为在拟南芥中观察到表达番茄CDF基因的表型[61]。
在维管植物中,DOFs和COLs基因的大多数功能已经从它们的共同祖先遗传下来,例如,CO启动淀粉生物合成、DOF的转录因子OBP1控制细胞周期[62]。DOF-CO模块不仅共同进化,而且还有一组基因和与这些基因相关的调控网络,此外,COLs和DOF在整个进化过程中获得了植物特异性的光依赖性功能[63]。
2.5 激素途径
植物激素赤霉素(GAs)几乎是所有植物器官正常生长所必需的,它的功能包括促进细胞分裂、细胞伸长、种子萌发、茎伸长、叶、种子、果实等发育并且赤霉素通常是响应环境变化的[64]。最近的研究证明赤霉素(GAs)和光周期途径在长日照光周期条件下协同诱导开花。在兼性长日照和春化需求的拟南芥中,赤霉素(GAs)是诱导开花四种相互作用的途径之一。2007年宋贤勇等用酶联免疫吸附法测定春萝卜抽薹期间顶端生长点处嫩叶中内源性激素赤霉素(GAs)和脱落酸(ABA)的含量变化,发现赤霉素在抽薹期含量显著性增加,说明赤霉素对春萝卜的抽薹具有主导作用,ABA含量的变化趋势与赤霉素基本一致,ABA在抽薹早期可能具有与赤霉素相似的作用[65]。2009年黄兆峰等用不同浓度的GA3处理甜菜幼苗期茎的生长点,然后测定抽薹率,发现甜菜的抽薹率随着处理浓度的增加而增加,推测GA3 在甜菜抽薹过程中具有信号传递的作用[66]。赤霉素(GAs)和长日照光周期可以诱导二年生植物的抽薹和开花,春化作用诱导抽薹是长日照植物开花的先决条件,GAs可以代替二年生植物的春化作用,如在L.perenne非水化的茎伸长生长起始过程中,GAs也可以替代长日照光周期的作用。拟南芥中SUMO依赖性DELLA积累的研究表明在没有GAs的情况下,DELLA的SUMO化通过与位于GID1区域中的SIM基序相互作用来螯合GAs受体GID1,使得DELLA蛋白质富集而抑制生长;在GAs存在的条件下,GID1-GA复合物协同SLEEPY1(SLY)靶向DELLA,泛素(Ub)化介导蛋白酶体的降解,进而促进植物生长,如图1-2所示[67]。研究发现内源性植物激素和MeJA的含量变化与大蒜抽薹和球茎形成高度相关,表明植物内源性激素是普遍存在的发育刺激因素[68]。拟南芥fk-J3158品系春化处理三周后可以缓解其延迟开花表现型,春化处理诱导Fk-J3158品系中FLC基因的表达下调,表明FK可能通过赤霉素(GAs)途径和春化途径影响拟南芥的开花[69]。遗传分析表明,GA诱导FT基因的表达依赖于光周期信号传导关键转录因子CONSTANS(CO)的作用,而DELLA蛋白质是GA信号中一组关键的抑制因子,可以与CO转录因子物理性相互作用,CO作用于DELLA蛋白质的下游,DELLA-CO的级联抑制CO/FT介导的开花反应,长日照光周期条件下CO蛋白质的富集使得REPRESSOROFGA1-3蛋白质显著性降低而促进开花[70]。在短日照光周期条件下,研究发现一个关键的螺旋-环-螺旋转录因子NFL能够特异性诱导拟南芥开花,NFL是通过GA信号通路在短日照光周期非诱导条件下促进开花的关键转录因子[71]。
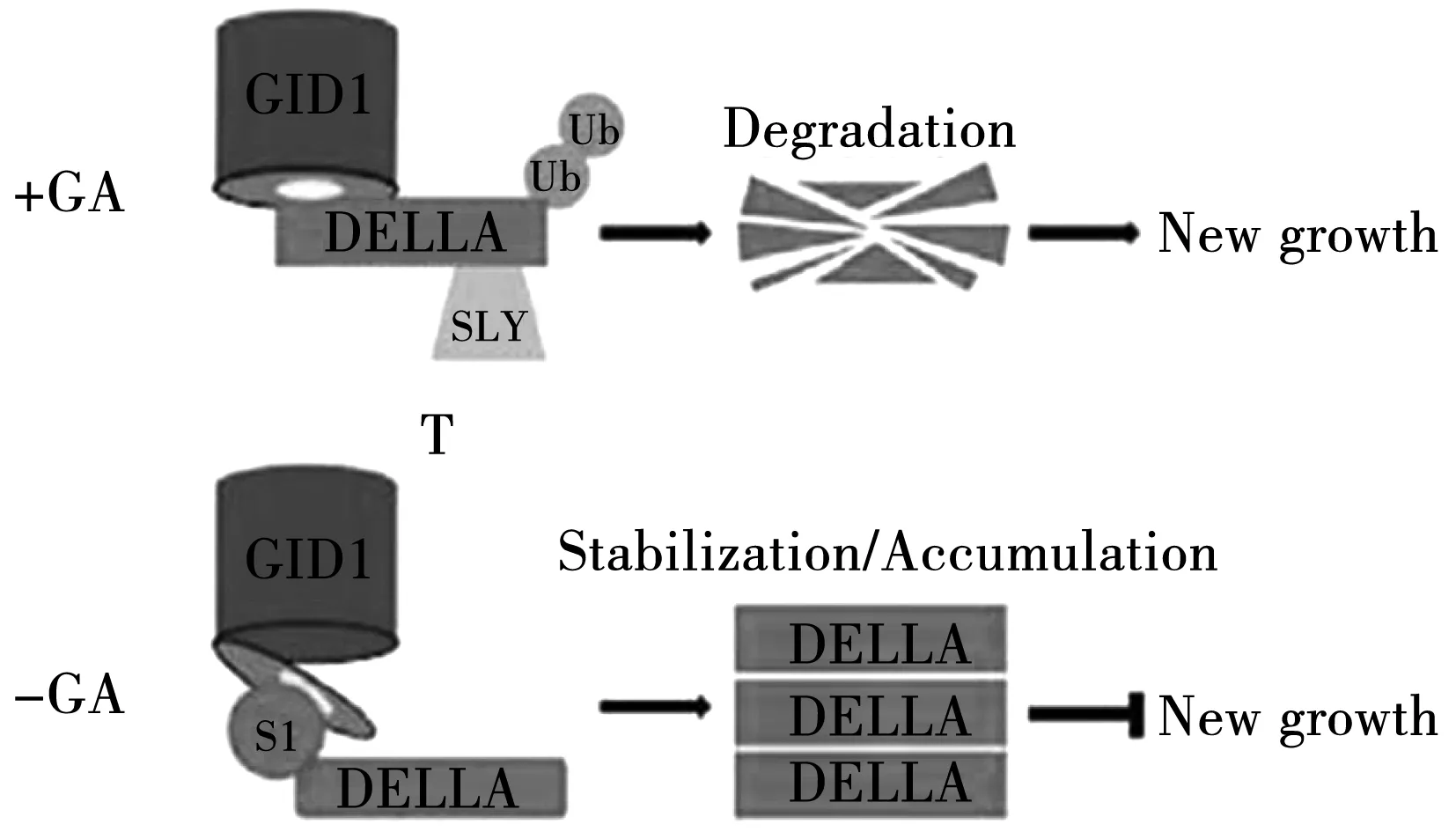
注:GA不存在的情况下DELLA积累,GA存在的情况下DELLA泛素化降解图2 拟南芥中DELLA积累的模型Fig.2 Model of DELLA accumulation in Arabidopsis
3 甜菜春化、抽薹和开花分子机制研究现状
3.1 甜菜春化基因
甜菜是一个高度多样性的物种,自然条件下具有一年开花和二年开花的特点,与拟南芥类似。在野生型甜菜群体中也发现了甜菜生命形式与纬度的重要关系。二年生甜菜在法国的大西洋和地中海沿岸北部生长而一年生甜菜主要在南部生长。二年生糖甜菜第一年为营养生长,第二年为生殖生长,甜菜的开花需要春化和光周期协同作用。使用RNASeq方法生成甜菜第一个参考转录组学数据,对施加和不施加GA的两个甜菜品种以及施加和不施加GA的两个甜菜春化品种的茎顶端mRNA进行基因表达谱分析和生物信息学分析发现了与基因型和处理条件相关的转录组学差异,对春化和赤霉素(GAs)处理的表达谱分析发现春化处理诱导BvRAV1-like基因表达上调。
3.2 甜菜抽薹基因
2014年许园园等采用电子克隆和基因组步移方法分离萝卜RsFPF1基因gDNA和cDNA及启动子序列,时空表达和转基因验证分析证明RsFPF1基因的表达受光周期调控,在萝卜抽薹开花方面具有调控作用[72]。2008年原玉香研究白菜BrFLCs基因序列,发现有2个变异位点(Pi5+104和Pi6+1)与抽薹相关,BrFLC1基因剪接位点的G-A突变与抽薹直接相关,并进一步定位了抽薹相关的分子标记[73]。国内在温度和光周期诱导甜菜抽薹、开花方面的研究起步较晚,2001年常缨对温光诱导甜菜当年抽薹机理的形态、生理变化和基因表达差异进行了研究,发现可能与抽薹相关的形态、生理指标的变化规律及11条可能与抽薹相关的差异带[75]。2003年戴建军等对甜菜当年抽薹差异表达基因进行克隆,得到一个693bp的片段,同时对cDNA和基因组DNA进行PCR扩增及克隆得到609bp和855bp两个基因片段[76]。2012年谷维等发现甜菜抽薹期饱和脂肪酸的含量增加,不饱和脂肪酸的含量减少,氨基酸的总量增加[77]。甜菜抽薹是开花的前提,B位点基因称之为“抽薹基因”,决定了一年生和二年生甜菜开花的不同表现型。二年生甜菜含有纯合的隐性(bb)基因,自然条件下,二年生甜菜的抽薹需要充分的春化处理,即长期低温(4-5℃)处理。长日照光周期条件下一年生甜菜(BB或Bb)无需春化就可以抽薹开花。2012年Pin等应用图位克隆方法鉴定了抽薹基因B,系统遗传分析表明BvBTC1属于PRR3/PRR7的分支,春化和长日照光周期处理二年生甜菜可以诱导BvBTC1基因表达,而BvBTC1基因是BvFT2基因上游的一个调节因子,在环境诱导条件下,BvBTC1基因对于甜菜的抽薹、开花具有关键性的作用[78]。Sebastian等证明在甜菜中含有春化反应的FLC同源基因BvFL1,BvFL1的过量表达导致甜菜晚抽薹,即:春化后延迟抽薹,该研究第一次证实BvFL1基因在春化诱导甜菜抽薹和光周期反应中的调节作用[79]。Dally等鉴定了一个新的抽薹基因B2,B2基因含有一个类似于BvFT1和BvFT2上游BTC1基因的转录因子,该基因的昼夜波动变化与B基因上位互作,根据它与拟南芥基因的紧密同源性命名为BvBBX19,它是一个主要的开花时间调节因子,编码的蛋白质含有2个与锌脂B-boxes结构同源的保守结构域[80]。
3.3 甜菜开花基因
甜菜中与拟南芥开花抑制基因FLC高度同源的BvFL1基因定位在Ⅵ号染色体上,在转基因拟南芥中BvFL1是一个开花抑制因子,类似于拟南芥的MAF2基因,二年生甜菜的抽薹和开花需要春化处理,春化抑制BvFL1基因的表达而脱春化又恢复了BvFL1基因的表达,从而抑制开花[79]。甜菜的光周期途径存在一个COL基因家族,COL基因群体分为Ⅰ、Ⅱ、Ⅲ型,具有锌指和CCT(CO,CO-like,TOC)结构域特征,BvCOL1是拟南芥1aCOL基因群体的一个紧密同系物,定位在Ⅱ号染色体上远离B基因位点,与开花相关[81]。2010年Pin等鉴定出甜菜开花时间基因BvFT1和BvFT2,它们是拟南芥FT基因的2个旁系同源基因,在转基因拟南芥中BvFT2基因促进开花,而BvFT1基因抑制开花,BvFT2基因的表达水平与一年生和二年生甜菜的开花起始相关,说明BvFT2基因是甜菜开花发育的关键基因,BvFT1和BvFT2基因的表达是相互抑制而不是重叠的,首次提出甜菜开花模型,如图1-3所示[82]。BvFT1和BvFT2基因在一年生甜菜中的表达方式相反且与光周期相关;在春化处理的二年生甜菜中BvFT1基因表达下调,说明春化抑制BvFT1基因的表达,因此春化和光周期途径是通过BvFT1和BvFT2基因协同作用促进甜菜开花的。
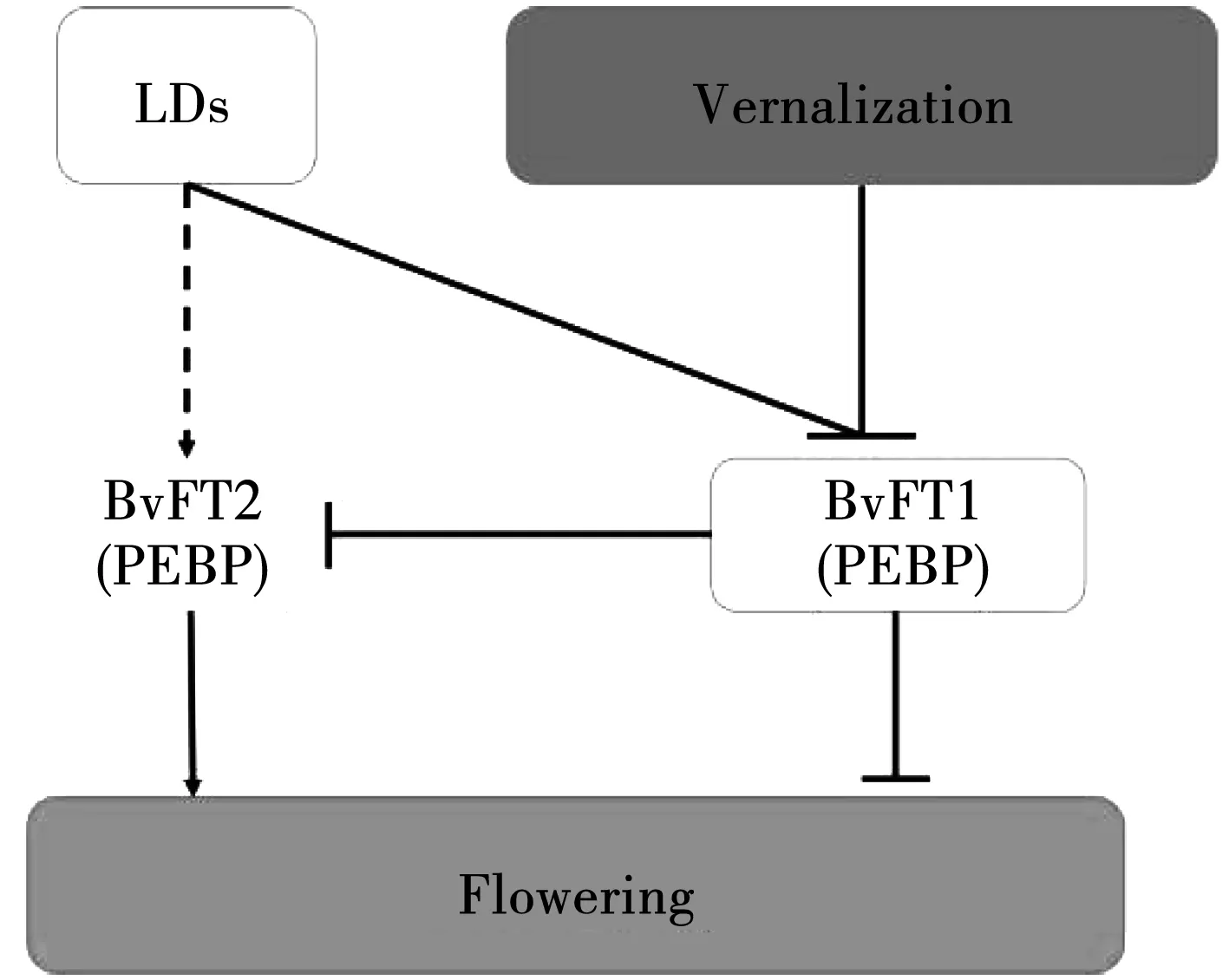
图3 甜菜开花模型Fig.3 The flowering model of sugar beet
模式植物拟南芥的全基因组图谱已经绘制完成。随着研究的不断深入,甜菜全基因组图谱草图在德国马普实验室完成。2012年Dohm等完成了甜菜所有9个染色体组综合基因组信息的遗传和物理图谱,图谱含有表达序列标签和细菌人工染色体末端序列制备的1127个单一多聚核苷酸标记,最后的物理图谱包含了535染色体固定重叠区,含有8361个探针和22815BAC克隆系,基于此项研究又鉴定出甜菜基因组中蔷薇类植物和菊类植物祖先的连锁群,综合基因测序和物理性图谱检测,发现甜菜和真双子叶植物拟南芥、白杨、葡萄树、可可树基因组序列的1400-2700个基因片段具有同线性[83]。甜菜基因组图谱草图的完成为后续分子研究提供了信息工具。2013年马普实验室对甜菜基因组草图信息进行了进一步的补充,Dohm等对基因组进行高级比较分析和系统发生重建,将组成基因组567Mb碱基中的 85%的序列分配到染色体上,组成一个含量为63%的大比例重复序列,然后通过转录组数据库和序列同源性预测得到27421个编码蛋白的基因。甜菜基因组测序使得影响农艺学相关性状的基因鉴定成为可能,为甜菜分子设计育种和潜在能源植物的生物技术最大化提供指导。
4 展望
今后有必要 对甜菜开展春化长日照(VLD)、春化短日照(VSD)、非春化长日照(NVLD)、非春化短日照(NVSD)的不同生长时期叶片中与甜菜生长发育相关的基因表达差异、蛋白质组学差异、和春化、光周期诱导甜菜抽薹和开花相关基因的数据挖掘研究。探讨春化与非春化、长日照与短日照甜菜不同生长阶段基因表达、蛋白质组学和生理指标的变化与甜菜抽薹和开花的关系,为进一步明确温光诱导甜菜抽薹和开花的分子机制奠定基础。

