营养相关指标预测肝硬化失代偿期患者预后的模型建立及研究
王婷,马臻,其其格
肝硬化是临床比较常见的一种慢性肝病,代偿期无典型症状,而失代偿期则会出现明显门静脉高压、肝功能减退等症状,随着病情进展,可能诱发一系列并发症,如肝肺综合症、肝性脑病、上消化道出血等,危及生命[1-2]。这类患者预后普遍欠佳,且预后涉及到的相关因素非常复杂。研究表明肝脏受损可引起机体脂质及蛋白质代谢、合成出现异常,从而导致营养不良[3-4]。另有研究指出肝硬化失代偿期营养不良发生率非常高,晚期甚至达60%~100%[5]。由此可见,营养不良与肝硬化病情进展可能存在关联。近年来,研究发现营养不良对肝硬化预后影响非常大,它会增加腹水、静脉曲张破裂出血等风险,导致生存期缩短[6-7]。为了进一步明确肝硬化失代偿期患者营养指标与预后的关系,本院纳入80例患者为研究对象,便于为患者疾病治疗提供依据,改善预后,现将研究情况报告如下。
1 资料与方法
1.1 一般资料
选取我院2015年5月至2017年5月收治的肝硬化失代偿期患者80例。诊断标准:参考中国中西医结合学会消化系统疾病专业委员会[8]制定的《肝硬化中西医结合诊疗共识》进行诊断:(1)经查体可见消化道症状(胃肠功能紊乱、腹胀等),有出血倾向,伴低蛋白血症、内分泌障碍、门脉高压;(2)血常规检查提示白细胞计数、血小板计数下降,血红蛋白降低,肝功能实验提示球蛋白上升,血清蛋白下降;(3)经X线摄片,提示食管-胃底静脉呈蚯蚓样、虫蚀样静脉曲张改变,CT检查提示肝脏密度下降,脾大,肝门变宽。在80例患者中,男42例,女38例,年龄30~82岁,平均(51.29±8.45)岁;病程5~24个月,平均(16.42±6.23)月;病因:原发性胆汁性肝硬化32例、乙肝后肝硬化28例、酒精性肝硬化20例;Child-Pugh分级:A级28例、B级41例、C级11例。研究方案经本院伦理委员会批准,充分尊重患者的知情权。
1.2 纳入与排除标准
(1)纳入标准:①成年患者;②临床经查体、实验室检查、影像学检查等证实为肝硬化失代偿期,诊断明确;③临床资料完整;④无颅脑、中毒性脑病、代谢性脑病病史;⑤知情同意。
(2)排除标准:①合并肝癌或其他恶性肿瘤;②合并其他传染性疾病,如艾滋病;③心肺功能严重损害;④处于昏迷状态;⑤精神状态、认知功能异常。
1.3 方法
(1)检查方法:所有患者均于入院当天进行营养指标检测,包括体质指数(Body mass index,BMI)、三角肌皮褶厚度、前白蛋白(Prealbumin,PA)、上臀肌围、视黄醇结合蛋白(Retinol-binding protein,RBP)、血清白蛋白(Albumin,Alb)水平。BMI=体重(kg)/身高(m)2,采用皮褶测量仪(ABJY-M124261,北京中西远大科技有限公司)测量三角肌皮褶厚度,根据上臂围与三角肌皮褶厚度计算上臂肌围,上臀肌围=上臂围(mm)-3.14×三角肌皮褶厚度(mm)。在入院当日取2 mL空腹静脉血,离心15 min,转速为3 000 r/min,分离血清,采用全自动生化分析仪(美国贝克曼全自动生化分析仪,AU5831型)测定血清PA、Alb、RBP水平。
(2)分组方法:通过电话或上门随访的方式,了解患者病情,随访时间为12个月,每3个月随访1次。根据患者12个月内的预后情况,将其分成预后良好组、预后不良组,将出现腹水、消化道出血、肝性脑病等并发症的患者纳入预后不良组,将未出现上述不良事件的患者作为预后良好组。
1.4 观察指标
比较预后良好组、预后不良组的营养指标(BMI、三角肌皮褶厚度、上臀肌围以及血清PA、Alb、RBP水平),采用受试者工作特征曲线(Receiver operating characteristic,ROC)分析各营养指标对患者预后不良的预测价值,利用Logistic回归模型分析各营养指标是否为肝硬化失代偿期患者预后不良的危险因素。
1.5 统计学方法
2 结果
2.1 80例患者12个月内的预后情况分析
在80例肝硬化失代偿期患者中,预后不良率为30.00%,预后良好率为70.00%,见图1。在24例预后不良患者中,腹水占83.33%(20/24),消化道出血占70.83%(17/24),肝性脑病占29.17%(7/24),见图2。
图1 80例患者12个月内的预后情况
图2 预后不良患者的并发症情况
2.2 预后良好组、预后不良组的营养指标比较
根据预后情况,分成预后良好组56例,预后不良组24例。预后良好组的BMI、三角肌皮褶厚度、上臀肌围以及血清PA、Alb、RBP水平均高于预后不良组,差异有统计学意义(P<0.05),见表1。
表1 预后良好组、预后不良组的营养指标比较±s)
2.3 营养指标对预后不良的预测价值分析
BMI、三角肌皮褶厚度、上臀肌围以及血清PA、Alb、RBP水平预测患者预后不良的曲线下面积分别为0.652、0.650、0.670、0.615、0.694、0.683,见表2,ROC曲线图见图3~图8。
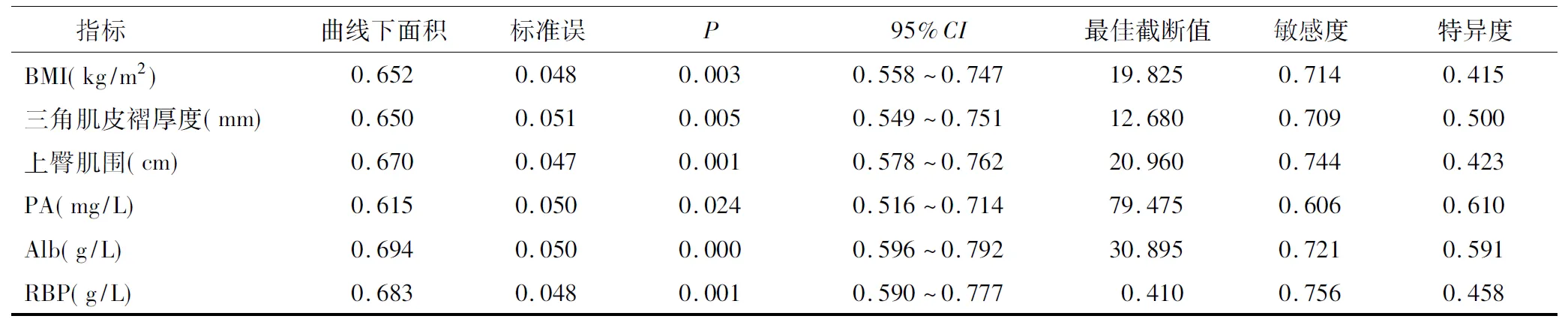
表2 营养指标对预后不良的预测价值分析
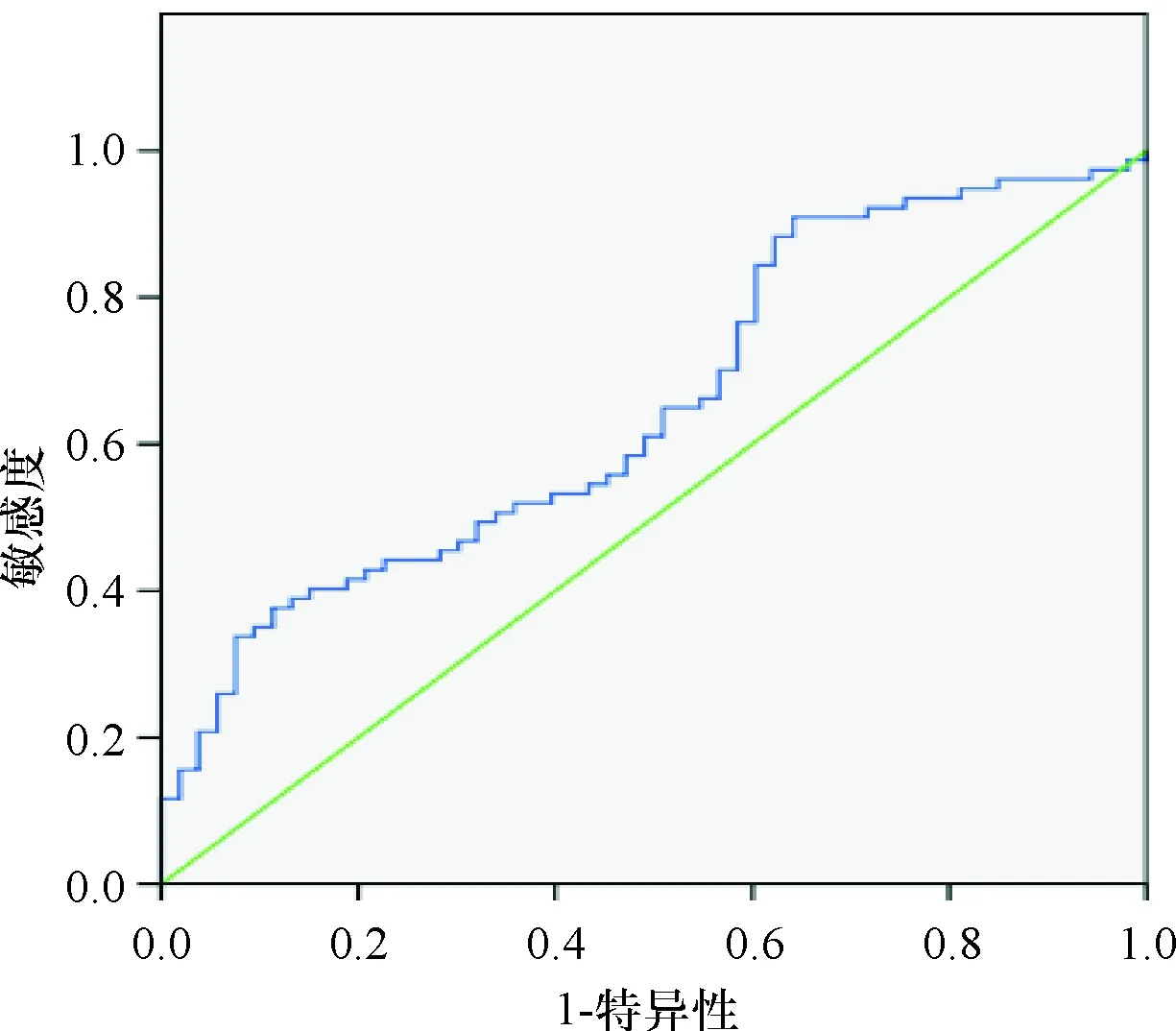
图3 BMI预测预后不良的ROC曲线

图4 三角肌皮褶厚度预测预后不良的ROC曲线
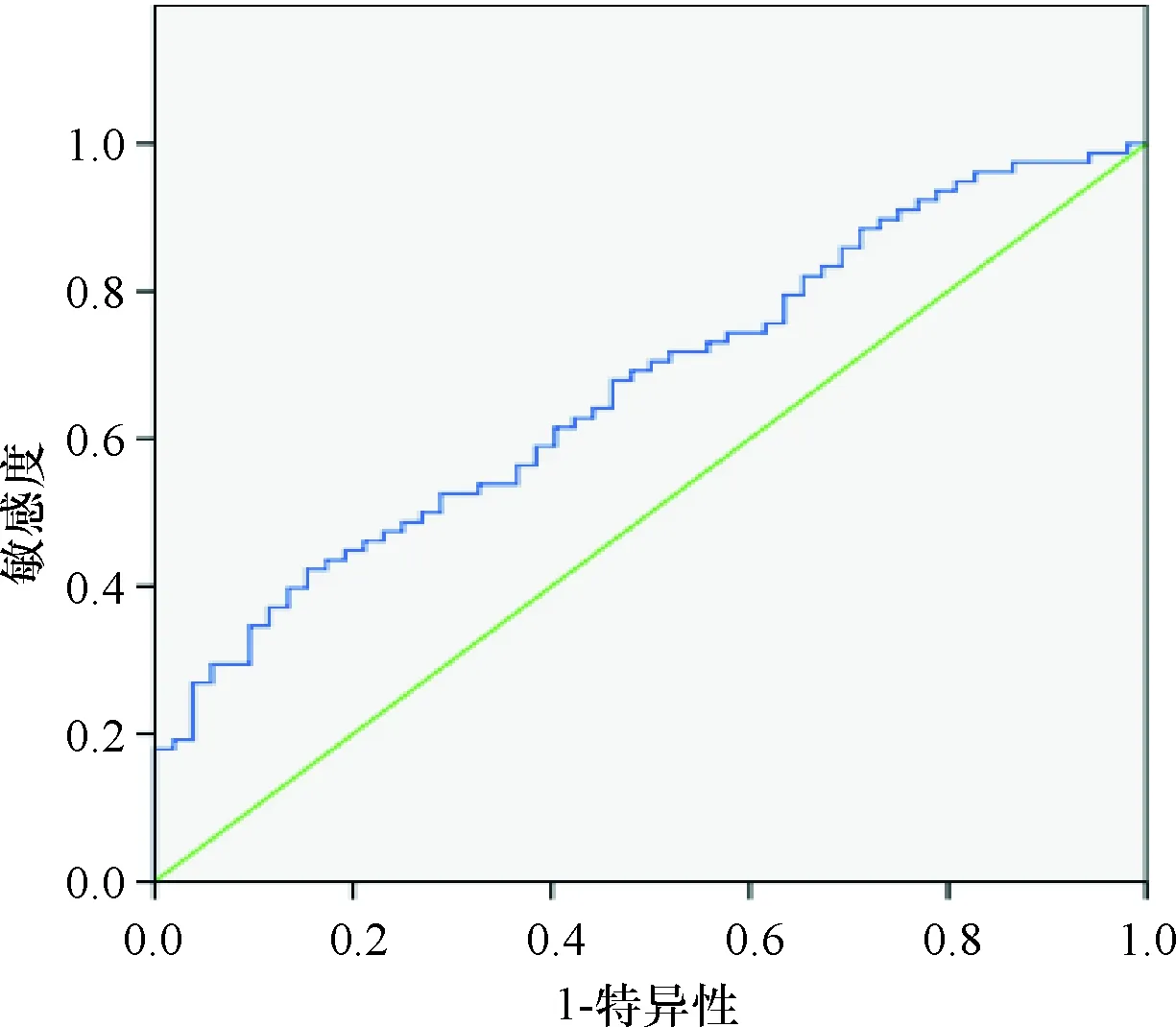
图5 上臀肌围预测预后不良的ROC曲线
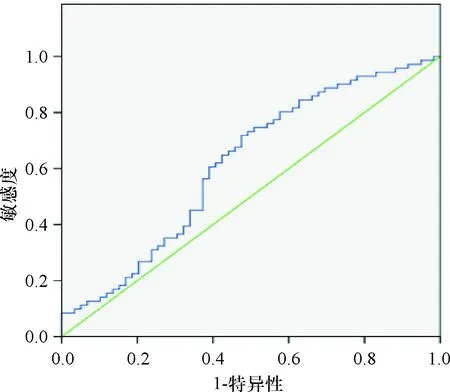
图6 PA预测预后不良的ROC曲线

图7 Alb预测预后不良的ROC曲线
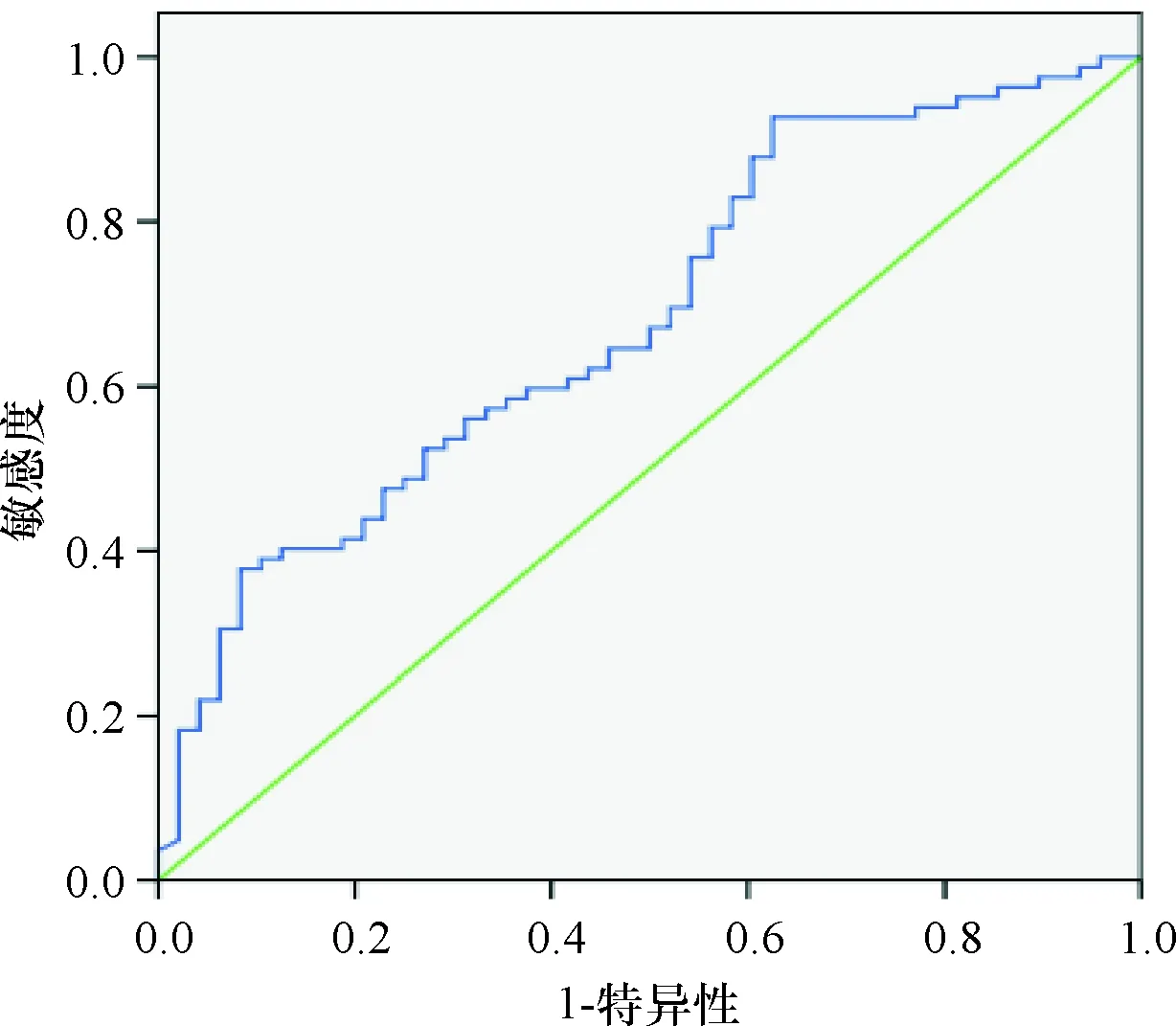
图8 RBP预测预后不良的ROC曲线
2.4 肝硬化失代偿期患者预后不良的Logistic回归性分析
将各变量纳入Logistic回归分析模型,并进行量化赋值,见表3,结果提示BMI≤19.825 kg/m2、三角肌皮褶厚度≤12.680 mm、上臀肌围≤20.960 cm、PA≤79.475 mg/L、Alb≤30.895 g/L、RBP≤0.410 g/L是肝硬化失代偿期患者预后不良的危险因素(P<0.05),见表4。

表3 量化赋值表
3 讨论
肝脏是人体重要器官,它为脂质的消化、合成、吸收、分解、运输提供了场所[9]。肝硬化对肝脏损害非常大,尤其失代偿期患者肝细胞损害较重,在这种情况下,载脂蛋白以及血脂的分解、合成均会受不良影响[10-11]。研究表明在慢性肝病患者中,约为10%~100%的病例出现营养不良,导致患者住院时间延长,并发症风险增高[12]。目前,虽然并无研究提示营养不良是降低肝硬化患者生存率的直接原因,但不能否认它是影响患者预后的重要因素。临床定期评估肝硬化失代偿期患者的营养状况,有利于进一步了解其病情,为疾病治疗提供依据[13-14]。本次研究以肝硬化失代偿患者为研究对象,通过12个月的随访,发现有24例预后不良,主要并发症为消化道出血、腹水以及肝性脑病。研究表明肝硬化患者并发症的发生与营养不良存在关联,其机制在于肝硬化导致肝功能减退,引起食欲下降、蛋白合成能力削弱等表现,从而增加营养不良风险,而营养不良易导致肝损害加重,影响预后,加大并发症发生的危险性[15-16]。

表4 肝硬化失代偿期患者预后不良的Logistic回归性分析
根据患者12个月内的预后情况,分成预后良好组与预后不良组,结果提示与预后良好组相比,预后不良组的BMI、三角肌皮褶厚度、上臀肌围以及血清PA、Alb、RBP水平均下降,表明预后不良组中大部分出现营养不良。营养不良最直接的症状为BMI下降,这提示患者机体脂肪含量减低,因此,三角肌皮褶厚度、上臀肌围下降[17-18]。此外,血清PA、Alb、RBP也是评价机体营养状况的重要指标。其中PA通过肝细胞合成,半衰期短,在肝功能不全、营养不良评价中敏感度高[19-20]。Alb也是通过肝脏合成,它对血小板聚集有抑制作用,还能抗凝血,正常范围为40~55 g/L,当出现营养不良时血清Alb处于较低水平[21-22]。RBP在尿液、脑脊液及血液中均有分布,它通过肝脏合成,当出现低蛋白血症、营养不良时降低[23-24]。
笔者最终通过Logistic回归性分析,证实BMI≤19.825 kg/m2、三角肌皮褶厚度≤12.680 mm、上臀肌围≤20.960 cm、PA≤79.475 mg/L、Alb≤30.895 g/L、RBP≤0.410 g/L与患者预后不良密切相关。国外研究也发现营养不良会增加肝硬化失代偿期患者并发症风险,影响预后,主要机制在于:(1)脂肪、蛋白质摄入量过少,特别是缺乏优质蛋白摄入,导致机体营养水平下降;(2)门静脉系统呈充血状态,不利于分泌消化酶,引起肠道吸收障碍,机体难以吸收足够的营养物质;(3)肝硬化引起的一系列症状导致机体耗能量增加,从而致能量丢失[25]。上述均为导致肝硬化失代偿期患者出现营养不良的原因,从而增加并发症发生的危险性。本次研究创新之处在于通过绘制ROC曲线,发现BMI、三角肌皮褶厚度、上臀肌围以及血清PA、Alb、RBP水平对患者预后不良的预测价值均较高,曲线下面积均>0.60,并明确各营养指标的最佳截断值,能为评价肝硬化失代偿期患者的预后提供依据,临床需对此引起重视,便于尽早采取措施干预,降低不良事件发生率,改善预后。
综上,本研究证实肝硬化失代偿期患者预后与营养不良密切相关,临床可将BMI、三角肌皮褶厚度、上臀肌围以及血清PA、Alb、RBP水平作为评价患者营养状态的重要指标,便于及时预测预后,尽早避免危险因素。此外,本研究也存在局限性,如仅纳入80例患者为研究对象,样本量少,未来还需扩大样本量对此进行多中心、大样本量的研究。

