乙酯型鱼油对小鼠骨性关节炎的改善作用
王 凯,朱玉婕,李媛媛,戴宇峰,王玉明,王静凤*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
骨性关节炎(osteoarthritis,OA)是一种以关节软骨退变为主要病理特征的慢性退行性疾病[1]。迄今为止,世界范围内有超过15亿的OA患者,由此带来的经济损失每年高达1 900亿 美元[2-3]。作为合成软骨基质的单一细胞类型,软骨细胞对于软骨稳态的维持起着重要的作用[4]。最近有研究表明OA患者的关节软骨中,软骨细胞开始发生肥大向分化,出现软骨内骨化进程进而引起细胞凋亡[5]。因此,维持软骨细胞的正常状态对于OA的治疗至关重要。
自噬是细胞应对外部异常环境的一个重要的自我保护调节机制[6]。Caramés等报道在OA进程中软骨细胞自噬进程发生紊乱,并且软骨基质流失加重[7]。OA小鼠中软骨细胞自噬机制的缺失也会导致软骨细胞异常凋亡增加[8]。本实验中的高纯度鱼油(fish oil,FO)富含乙酯型n-3系多不饱和脂肪酸(n-3 polyunsaturated fatty acid,n-3 PUFA)。近来有研究表明n-3 PUFA对于哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)(自噬负调节因子)有重要的调节作用[9]。Huang Minjun等报道Fat-1转基因小鼠关节组织中mTOR的表达量下降,自噬进程被激活[10]。现阶段关于鱼油对OA的报道仅局限在改善疼痛和抗炎方面[11-12],关于鱼油对关节软骨细胞自噬的调节还鲜有报道。本实验采用手术方式建立内侧半月板不稳(destabilization of the medial meniscus,DMM)小鼠OA模型,在动物体内探究了乙酯型鱼油对骨性关节炎软骨退变的影响,进一步研究了乙酯型鱼油对软骨细胞自噬的调节作用机制。本研究的主要意义在于为乙酯型鱼油改善骨性关节炎软骨退变进程提供新的理论依据,也为乙酯型鱼油的进一步高值化利用提供参考。
1 材料与方法
1.1 动物、材料与试剂
雄性C57BL/6J小鼠,体质量18~22 g,购于北京维通利华实验动物有限公司。动物合格证号:SCXK(京)2012-0001。饲养室进行12 h光/12 h暗节律交替,保持通风良好,控制饲养温度在(23±1)℃,饲养期间,小鼠自由饮食。
高纯度乙酯型鱼油购自威海博宇渔业有限公司。
UNIQ-10 RNA柱式提取试剂盒 上海生工生物工程股份有限公司;M-MLV逆转录酶 美国Promega公司;TRIzol试剂及Maxima SYBR荧光染料 霍夫曼罗氏生物科技有限公司;苏木精染料 蓝季(上海)科学发展有限公司;醇溶性伊红 上海试剂三厂;硫酸氨基葡萄糖 普爱生物工程(湖北)有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
iCycler iQ5系统Real-Time聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国Bio-Rad公司;GL-20M高速冷冻离心机 上海卢湘仪离心机仪器公司;RM2135型石蜡切片机 德国徕卡公司;DP72型显微镜成像系统、BH-2型显微镜 日本OLYMPUS公司;HD-200p型加热器及氮吹设备 瑞士Blue Marlin公司;6890A型气相色谱仪 美国Agilent科技仪器有限公司。
1.3 方法
1.3.1 鱼油脂肪酸组成的测定
参照Ding Ning等[13]的方法,通过气相色谱检测脂肪酸组成:色谱柱采用HP-INNOWax石英毛细管柱(30 m×320 μm,0.25 μm),分流比20∶1,压力62.47 kPa,流速1.19 mL/min;起始柱温为170 ℃,后续按照3 ℃/min的速率升温至210 ℃并保持15 min;检测器采用火焰离子化检测器,进样口和检测器温度均为240 ℃,载气为氮气(1.2 mL/min)。含总脂肪酸99.15%(质量分数,下同);其中,二十碳五烯酸49.29%、二十二碳六烯酸32.53%,二十碳五烯酸与二十二碳六烯酸质量比约为3∶2。
1.3.2 骨性关节炎模型建立及动物分组
9 周龄雄性C57BL/6J小鼠适应性喂养3 d后,手术方法构建小鼠DMM骨性关节炎模型[14]。手术8 周后,将假手术组(Sham)设为正常对照组,DMM手术组随机分为模型对照组(DMM)、阳性对照组(GLU,195 mg/kg mb),鱼油低剂量组(FO-L,100 mg/kg mb)和鱼油高剂量组(FO-H,200 mg/kg mb),每组10 只。Sham组和DMM组灌胃生理盐水,阳性对照组灌胃硫酸氨基葡萄糖(glucosamine sulfate,GLU)。每天灌胃1 次,灌胃周期为60 d。
末次灌胃后禁食不禁水12 h,摘眼球处死小鼠,迅速分离小鼠右后肢(每组3 只),剔除肌肉后截取关节部分(保留关节囊)用于组织学观察和测定;迅速分离右后肢(每组7 只),剔除软组织及关节囊后迅速剥离关节软骨入液氮速冻,并保存于-80 ℃用于实时荧光定量PCR(quantitative real-time PCR,qPCR)分析。
1.3.3 组织学观察与分析
截取右后肢关节部分立即置于体积分数10%中性甲醛固定液中,固定24 h,再将其放入10%乙二胺四乙酸二钠(pH 7.3)中脱钙3~4 周,每3 d更换脱钙液,脱钙后的关节组织于梯度乙醇溶液中脱水,常规石蜡包埋,行苏木精-伊红和甲苯胺蓝染色,于显微镜下观察软骨结构变化。使用imageJ软件对软骨负重区的透明软骨(hyaline cartilage,HC)、钙化软骨(calcified cartilage,CC)厚度及总软骨厚度进行定量分析。使用OsteoMetrics分析软件对软骨面积进行定量。小鼠关节软骨损伤组织学评估参考国际骨关节炎研究协会(Osteoarthritis Research Society International,OARSI)评分标准[15-16]。
1.3.4 qPCR分析
取出-80℃中保存的关节软骨样品,利用UNIQ-10柱式TRIzol总RNA抽提试剂盒提取其总RNA,取1 μg的总RNA,在M-MLV逆转录酶的催化作用下(反应条件及体系参照逆转录酶M-MLV的说明书)逆转录生成cDNA。qPCR体系(25 μL)为:cDNA 5 μL、上下游引物各0.75 μL、双蒸水6 μL、SYBR 12.5 μL。反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火10 s,72 ℃延伸45 s,共45 个循环。以β-actin作为内参基因。各目的基因的引物序列如表1所示。
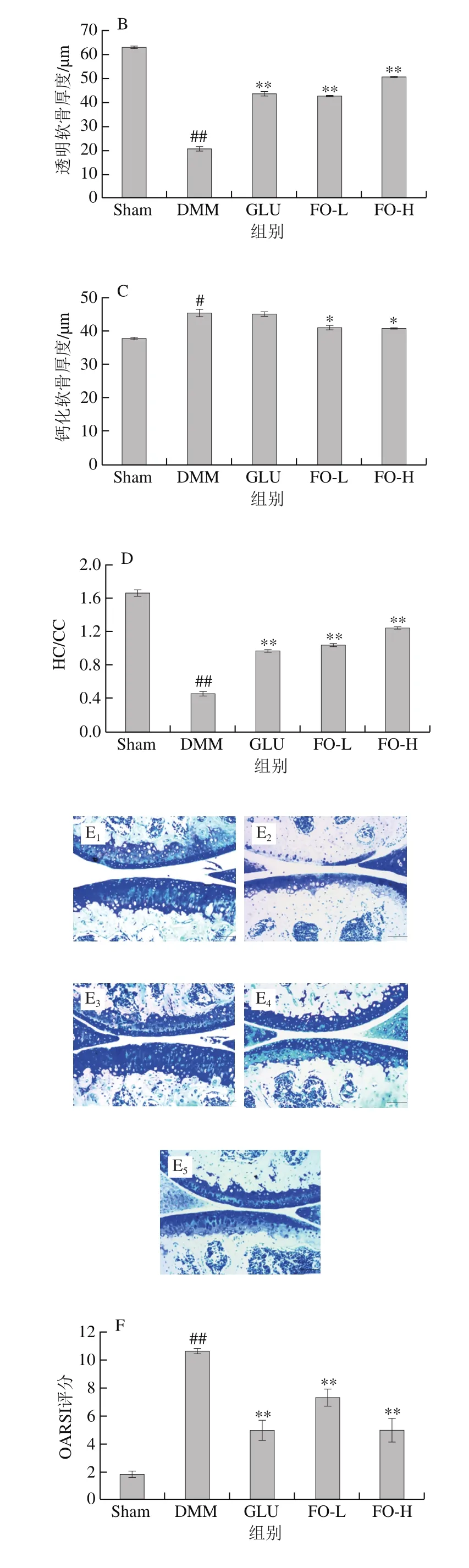

表 1 软骨代谢相关基因引物序列Table 1 Primer sequences used for PCR ampli fi cation of cartilage metabolism-related genes
1.4 数据统计分析
实验数据利用SPSS 19.0软件进行单因素方差分析,并采用最小显著性差异法进行两两比较,P<0.05时为显著差异,最终结果用 ±s表示。
2 结果与分析
2.1 乙酯型鱼油能显著改善骨性关节炎小鼠的软骨结构,抑制软骨退变进程


图 1 骨性关节炎小鼠的关节软骨结构组织形态学分析Fig. 1 Histomorphological analysis of articular cartilage in mice with osteoarthritis
由图1A、E可知,相对于Sham组,DMM组软骨结构破坏严重,蛋白多糖流失加重,提示关节炎小鼠出现明显的软骨退变现象。另外,OARSI评分显著升高也进一步说明这一结果(图1F)。FO干预后,透明软骨厚度、HC/CC比例相对DMM组平均上升了125.73%和152.03%(P<0.01)。钙化软骨厚度平均降低10.66%(P<0.05)。软骨面积和厚度分别增加了61.63%和31.88%,OARSI评分较DMM组平均降低42.19%(P<0.01)。以上结果综合说明FO能够明显改善OA小鼠的软骨结构,抑制软骨退变,维持软骨基质成分的稳定。
2.2 乙酯型鱼油能够促进软骨合成代谢关键基因的mRNA表达水平

图 2 乙酯型鱼油对软骨合成代谢相关基因mRNA表达的影响Fig. 2 Effect of FO on relative mRNA expression of key anabolism-related genes
聚集蛋白多糖(aggrecan,Acan)和II型胶原是构成关节软骨的主要成分[17]。如图2所示,DMM组Acan和Col2α1的mRNA表达水平较Sham组极显著降低(P<0.01),说明在OA病理进程中软骨基质的合成代谢受到抑制。给予FO干预后,Acan和Col2α1的表达水平明显上升,并且有一定的剂量效应关系,FO-H组Acan和Col2α1 mRNA的表达量较DMM组分别极显著升高197.24%和107.95%(P<0.01)。以上结果提示FO能够上调软骨基质的主要成分Acan和Col2α1的mRNA表达水平,改善软骨基质的合成代谢过程。
2.3 乙酯型鱼油能够抑制软骨细胞成熟肥大相关基因的mRNA表达水平
图1中DMM组钙化软骨区面积的增加,HC/CC比例降低,肥大软骨细胞聚集且增多,提示正常软骨细胞肥大态分化进程开始增加。Col10α1[18]、Runx2[19]是调控软骨细胞肥大成熟的关键因子。

图 3 乙酯型鱼油对软骨成熟肥大相关基因mRNA表达的影响Fig. 3 Effect of FO on relative mRNA expression of key cartilage hypertrophy-related genes
由图3可知,相对于Sham组,DMM组Col10α1、Runx2的mRNA的表达水平极显著升高(P<0.01),进一步说明了OA进程中关节软骨细胞出现明显的成熟肥大向分化。经不同剂量的FO干预后,软骨组织Col10α1和Runx2 mRNA的平均表达水平较DMM组分别降低27.52%和32.88%(P<0.01),以上结果提示FO能够显著抑制OA进程中关节软细胞的成熟肥大。
2.4 乙酯型鱼油能够调节软骨细胞凋亡关键基因的mRNA表达水平
软骨细胞成熟肥大分化会进一步引起细胞凋亡及软骨基质的降解[20]。图1的苏木精-伊红染色结果也显示软骨细胞凋亡后不能充满陷窝而导致无细胞区空洞增多。Bax、Bcl-2和Caspase3是软骨细胞重要的凋亡调节因子[21-22]。
如图4所示,与Sham组相比,DMM组Bax和Caspase-3的mRNA表达量极显著上升(P<0.01),而抗凋亡因子Bcl-2的mRNA表达水平显著下降,提示关节软骨细胞凋亡进程被激活。FO干预后能明显改善这一趋势,FO-H组的Bax和Caspase-3 mRNA表达量较DMM组分别下降了27.11%和38.45%(P<0.01),Bcl-2的表达量较DMM组升高了63.82%(P<0.01)。以上结果共同说明FO能够抑制软骨中促凋亡关键基因的表达,促进抑凋亡关键基因表达,从而抑制OA病理中关节软骨的异常凋亡进程。

图 4 乙酯型鱼油对软骨细胞凋亡相关基因mRNA表达的影响Fig. 4 Effect of FO on relative mRNA expression of key apoptosis-related genes
2.5 乙酯型鱼油能够促进软骨细胞自噬相关基因的mRNA表达水平
自噬是软骨细胞抵御外部异常环境变化时的正常自我保护调节机制[6]。mTOR是自噬进程的关键负调节因子[23],LC-3B和ATG-5是调节自噬进程的关键基因[24]。

图 5 乙酯型鱼油对软骨细胞自噬相关基因mRNA表达的影响Fig. 5 Effect of FO on relative mRNA expression of key autophagy-related genes
如图5所示,DMM组的mTOR表达量较Sham组极显著升高(P<0.01),而LC-3B和ATG-5的表达量极显著降低(P<0.01),提示OA中mTOR出现异常高表达并抑制了软骨细胞的自噬进程。不同剂量的FO均能改善这一情况,并有一定的剂量效应关系。FO-L组和FO-H组的mTOR mRNA表达量较DMM组平均下降了26.05%(P<0.05),LC-3B和ATG-5的mRNA表达量分别升高了57.71%和50.34%(P<0.01)。这表明FO能够显著下调OA进程中自噬抑制因子mTOR的表达水平从而激活软骨细胞自噬进程,维持软骨细胞的正常表型,从而抑制软骨退变。
3 讨 论
本实验采用手术方法构建DMM小鼠OA模型,在动物实验水平探究了FO对小鼠OA进程中软骨退变的影响。结果表明,FO能够显著改善软骨结构,维持软骨基质成分的稳定。同时,FO能够维持正常软骨细胞状态,抑制软骨细胞的肥大分化和异常凋亡,机制探究表明FO能够显著上调自噬因子的表达。以上结果提示FO能激活软骨细胞自噬来维持关节软骨的稳态,抑制OA中的软骨退变进程。
软骨退变是骨性关节炎中一个重要的病理特征,主要表现为软骨结构的损伤和基质成分的丢失[1]。作为合成软骨基质的单一细胞类型,软骨细胞对于软骨稳态的维持起着重要的作用[4]。正常状况下,软骨细胞通过分泌II型胶原和蛋白多糖等软骨基质成分来维持软骨的完整性[14]。近来,Sampson等发现在骨性关节炎病理进程中,软骨细胞发生成熟肥大向分化,合成X型胶原和Runx-2等因子,进而启动软骨内骨化进程[5]。本实验中,DMM组钙化软骨区面积明显增加,同时,关节软骨中肥大调节因子Col10α1、Runx-2的mRNA表达水平明显上升,提示OA病理进程中软骨肥大化加剧,启动了软骨内骨化进程。与此相关,软骨正常合成代谢调节因子Acan和Col2α1的表达也受到抑制。FO的干预能够明显抑制相关肥大因子的表达,抑制软骨细胞的成熟向分化,结合Acan和Col2α1的表达情况共同说明FO能够维持软骨细胞的正常表型,从而抑制软骨的退变。
软骨细胞成熟肥大分化会进一步引起细胞凋亡及软骨基质的降解[25]。Sakata等报道OA患者软骨中细胞凋亡信号明显增强,抑制软骨细胞的非正常凋亡能够减少软骨基质成分的流失[26]。Lee等报道EPA能够通过降低P53介导的凋亡关键基因Bax、Caspase-3的表达来抑制OA中的软骨细胞异常凋亡进程[27]。Bcl-2是Bcl家族的重要成员,能够结合Bax并抑制其活性表达,是重要的抗凋亡因子[28]。本实验的结果显示,FO的干预能够显著降低Bax、Caspase-3的mRNA表达,提高抗凋亡因子Bcl-2的表达,从而阻断软骨细胞的异常凋亡进程。
自噬是软骨细胞应对外部异常环境变化的一个重要的自我保护调节机制[4]。Caramés等报道自噬是正常软骨的重要保护机制,年龄引起的自噬机制缺失会引起软骨细胞异常凋亡并引发OA[29]。mTOR是一种Ser/Thr蛋白激酶,众多研究发现mTOR是重要的自噬负性调节子[22,30]。Huang Minjun等报道,Fat-1转基因小鼠(n-6 PUFA转化为n-3 PUFA)关节组织中mTOR的表达受到抑制[10]。本实验采用的FO中富含乙酯型n-3 PUFA,其中EPA和DHA的含量分别为49.29%和32.53%。研究结果显示FO干预后能显著降低关节软骨中mTOR的表达水平,同时能够显著提高自噬关键调节因子LC-3及ATG-5的表达水平。以上结果综合表明FO通过降低mTOR的表达来激活关节软骨中软骨细胞自噬进程、维持细胞正常状态,进而维持软骨稳态。
综上所述,FO能够显著改善DMM诱导的骨性关节炎小鼠中的软骨结构,抑制软骨退变,维持正常软骨细胞状态,其机制可能与激活软骨细胞自噬来抑制其异常肥大、凋亡进程有关。

