大蒜精油对熏马肠中德氏乳杆菌产腐胺的影响机制
黄笠原,毛 顺,李蕊婷,王勇勤,于红红,卢士玲*
(石河子大学食品学院,新疆 石河子 832000)
腐胺是一种生物胺,经常被发现于发酵肉制品中。它能够与亚硝酸盐反应生成亚硝胺[1],过量摄入对人体有害,Gardini等的研究发现其与肿瘤的发展相关[2]。多种微生物都能通过一系列途径形成腐胺。大量研究证实微生物主要通过胍基丁胺脱亚胺酶(agmatine deiminase,AGDI)途径合成腐胺:首先精氨酸脱羧基形成胍基丁胺,然后胍基丁胺去亚氨基化生成腐胺[3]。这个途径中的基因簇有调节基因aguR以及分解代谢基因aguB、aguD、aguA和aguC[4-5]共转录成的多基因mRNA(操纵子aguBDAC)[6]。
由AGDI基因簇第1个基因编码的AguR是一种跨膜蛋白,它作为信号转导系统的一部分可以感受到细胞外的胍基丁胺浓度,从而调节操纵子aguBDAC的转录[7],aguBDAC的转录水平与腐胺的生成息息相关。aguR的表达量通常很低,但可以确保细胞表面的AguR充当胍基丁胺感应器。国内外研究发现aguR的表达不受葡萄糖浓度[8]、胍基丁胺浓度[6]以及培养基pH值[9]的影响。胍基丁胺可以使AguR二聚化,结合羧基上的碳使分解代谢基因aguBDAC开始转录,腐胺由此产生[6]。
目前有研究表明,洋葱、大蒜、肉桂等一些植物精油对大多数细菌有抑制作用[10],也有研究发现大蒜素和水溶性大蒜粉等大蒜产品会抑制金黄色葡萄球菌、腐生葡萄球菌、大肠杆菌等病原菌的生长[11]。但对于大蒜精油是否对微生物产腐胺有抑制作用,以及是否影响产腐胺途径中相关的基因表达的研究罕见报道。本研究所采用的大蒜精油由超临界CO2法从大蒜中萃取,是一种天然无公害的添加剂;实验中使用的德氏乳杆菌是从熏马肠中分离出的杂菌,具有较强的产腐胺能力。因此,本研究在德氏乳杆菌纯菌体系与熏马肠体系中探究大蒜精油对其的作用效果,并从分子生物学角度研究不同浓度大蒜精油对供试菌参与AGDI途径产腐胺基因簇的影响,明确大蒜精油影响熏马肠中德氏乳杆菌产腐胺的机制,以期为大蒜精油应用于发酵食品中以提高其安全性提供理论依据。
1 材料与方法
1.1 材料与试剂
德氏乳杆菌(Lactobacillus delbrueckii),GenBank登录号为MF661779,由石河子大学食品学院实验室从熏马肠中分离保存,并送华大基因公司测序。
大蒜精油 仲景大厨房股份有限公司;吐温20(化学纯)、甲醇、乙腈(色谱纯) 天津福晨化学试剂厂;改良MRS培养基(半乳糖代替葡萄糖作为碳源)北京奥博星生物试剂公司;胍基丁胺(体积分数97%)、腐胺标准品(纯度97%) 美国Sigma公司;Trizol试剂 美国Invitrogen公司;cDNA合成试剂盒北京全式金生物技术有限公司;Bestar®SybrGreen qPCR mastermix、ROX Reference Dye 德国DBI公司。
1.2 仪器与设备
多功能酶标仪 美国伯腾仪器有限公司;ND2000C型微量核酸测定仪 香港基因有限公司;高速冷冻离心机 美国贝克曼公司;M×3000P型荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪 美国安捷伦科技公司;超高效液相色谱(ultra performance liquid chromatography,UPLC)仪 美国沃特世公司;T25 DS 25型匀浆机德国IKA公司;9020-0094 KBF 240型恒温恒湿培养箱德国Binder公司。
1.3 方法
1.3.1 供试菌菌悬液的制备
将在-18 ℃斜面保藏的从熏马肠中分离的德氏乳杆菌活化,用MRS液体培养基培养活化成功的菌株,并稀释菌悬液至104~105CFU/mL备用。
1.3.2 纯菌体系中大蒜精油对供试菌生长作用的测定
准备一批5.0 mL含体积分数0.4%胍基丁胺溶液与体积分数0.005%磷酸吡哆醛溶液的MRS液体培养基,分别加入由吐温20溶解的大蒜精油,使其终质量浓度分别为0 mg/mL(不添加大蒜精油)、1/2最小抑菌浓度(minimum inhibitory concentration,MIC)、MIC[12],混匀后接入供试菌液。37 ℃恒温培养48 h,每隔4 h取样,以含相应质量浓度大蒜精油的空白培养基作为对照,用多功能酶标仪测OD600nm,并用pH计测pH值,每组样品各做3 个平行。
1.3.3 AGDI相关基因表达量的测定
1.3.3.1 RNA的提取
取1.3.2节中生长至稳定期的各组菌液2.0 mL,离心得菌体后采用Trizol法提取细菌总RNA。提取完成后用微量核酸测定仪测RNA浓度及其OD260nm、OD280nm,采用质量分数1%琼脂糖凝胶电泳检测RNA的完整性。
1.3.3.2 cDNA的合成
将1.3.3.1节中提取所得的各组RNA用cDNA合成试剂盒反转录成cDNA,20 μL体系中加入500 ng总RNA,按试剂盒说明书操作。
1.3.3.3 反转录qPCR法测定基因相对表达量
向无酶的八连管中加入12.5 μL Bestar®SybrGreen qPCR mastermix、1 μL cDNA模板和上、下游引物(表1)各0.5 μL,加入ddH2O至25 μL,最后添加0.1×ROX Reference Dye,轻微离心混匀反应液,作为反转录qPCR(reverse transcription qPCR,RT-qPCR)反应体系用于上机检测。每组基因做3 组平行,所采用的扩增程序为:预变性95 ℃ 2 min;95 ℃ 10 s、55 ℃34 s、72 ℃ 30 s,40 个循环。以MIC大蒜精油组为对照,采用2-ΔΔCt法[14]计算另外两组的aguR和aguB相对表达量。

表 1 RT-qPCR所用引物Table 1 Primers used for RT-qPCR
1.3.4 UPLC对培养液腐胺积累量的测定
1.3.4.1 标准溶液的配制
用0.4 mol/L高氯酸溶解10 mg腐胺标准品,定容至10 mL,分别稀释成终质量浓度为5、10、20、25、50、100 μg/mL的标准溶液。
1.3.4.2 样品的制备
取1.3.2节中3 种大蒜精油质量浓度下生长的供试菌液,每隔4 h取样,12 000 r/min离心10 min后吸取1 mL上清液,并在移入相同体积的0.4 mol/L高氯酸后混匀,作为菌液样品处理液。
1.3.4.3 样品衍生化
取1.3.4.1节中的腐胺标准溶液与1.3.4.2节中的菌液样品处理液各1 mL,置于5 mL容量瓶中,按照Lu Shiling等[15]的方法进行衍生化。经0.22 μm的滤膜过滤后上机检测。
1.3.4.4 UPLC条件
ACQUITY UPLC®HSS T3柱(50 mm×2.1 mm ,1.8 μm),流动相A是水,流动相B是乙腈;流速0.4 mL/min;进样量5 μL;波长254 nm;柱温30 ℃。梯度洗脱程序为:0~5 min,55%流动相A;5~12 min,40%流动相A;12~15 min,5%流动相A;15~20 min,55%流动相A。
1.3.5 熏马肠的制作
处理原料肉(瘦肉占80%、肥肉占20%,将肉块表面涂抹乙醇,用火灼烧以杀灭表面细菌,并用紫外灯照射30 min)→修整、切丁→加入经灭菌处理的配料(2.0%(质量分数,下同)食盐、2.0%白糖、0.1%味精、0.2%姜粉、0.1%八角、0.1%胡椒粉、0.15%花椒粉、0.1%五香粉、0.01%亚硝酸钠、1%烟熏液)→腌制(4 ℃、1 d)→接种供试菌→灌肠→发酵→成品。
以上步骤均在无菌条件下进行,共制作3 组,A组不添加大蒜精油,B组添加质量浓度为1/2 MIC的大蒜精油,C组添加质量浓度为MIC的大蒜精油,3 组均接入约103CFU/mL德氏乳杆菌。
1.3.6 熏马肠的发酵条件
将制作完成的熏马肠置于恒温恒湿箱中发酵,发酵条件:0~2 d发酵温度(18.0±0.5)℃、相对湿度90%~95%;3~7 d发酵温度(12.0±0.5)℃、相对湿度80%~85%;8~28 d发酵温度(10.0±0.5)℃、相对湿度70%~75%。
1.3.7 大蒜精油对熏马肠发酵的影响
熏马肠制作完成后分别在第0、3、7、14、21、28天取样,每次取一根在无菌条件下分装。采用平板计数法测菌落总数,将20 g熏马肠剪碎置于无菌拍打袋中,加入180 mL无菌生理盐水,将拍打机强度调至4,拍打至样品完全散开,每组样品拍打时间相同,吸取上层菌液稀释到适当的浓度,于营养琼脂培养基中均匀涂布。用pH计测定上清液的pH值。按照Lu Shiling等[15]的方法制备样品,按1.3.4.3节条件衍生化,测定腐胺积累量[16]。每次取3 个样品,每个样品做3 个平行。
1.4 数据统计与分析
所有实验数据使用Excel 2010软件建立数据库,采用Origin 8.5软件绘图,并用SPSS 23软件作单因素方差分析,P<0.01为差异极显著。
2 结果与分析
2.1 大蒜精油对德氏乳杆菌生长的影响

图 1 添加不同质量浓度大蒜精油48 h内德氏乳杆菌OD600 nm的变化Fig. 1 OD600 nm of Lactobacillus delbrueckii during 48 h fermentation with different concentrations of garlic essential oil
如图1所示,1/2 MIC和MIC大蒜精油组的细菌OD600nm始终低于不添加大蒜精油组。由此可以看出,在48 h内,大蒜精油可有效抑制德氏乳杆菌的生长,减少菌体数量,且其质量浓度越大抑制作用越强,但并没有改变供试菌的生长趋势,只是延缓了其稳定期的到来。这是由于大蒜精油疏水性良好,渗透能力强,可均匀分散在细菌细胞中,使细胞内容物外泄,从而产生良好的抑菌效果[17]。这与目前报道的大蒜精油对其他菌的抑制效果[18-19]类似。
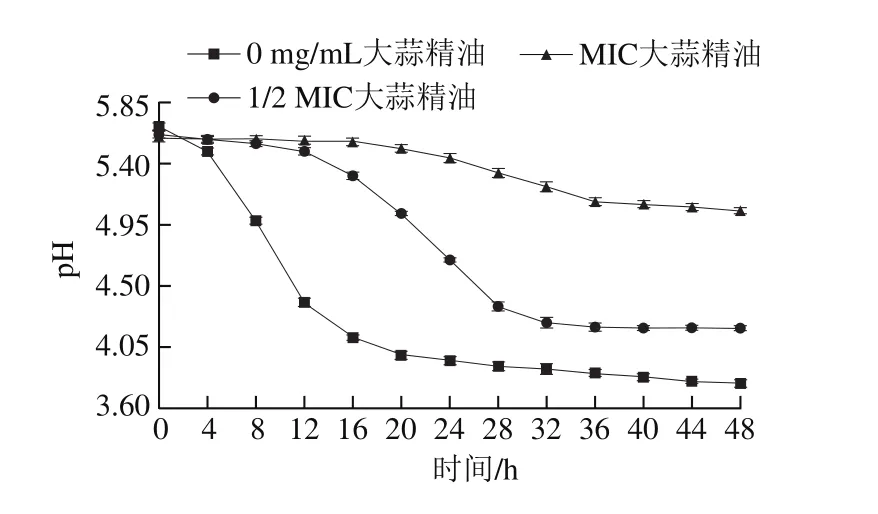
图 2 添加不同质量浓度大蒜精油48 h内德氏乳杆菌培养液中pH值的变化Fig. 2 Change in pH during 48 h fermentation of Lactobacillus delbrueckii with different concentrations of garlic essential oil
如图2所示,德氏乳杆菌在不添加大蒜精油组培养液中开始生长后,培养液的pH值快速下降,说明其产酸能力强。根据图1可知,不添加大蒜精油组中细菌在24 h后逐渐进入稳定期,此时细菌数量接近最大值,活菌数相对稳定,细胞代谢产物积累达到最高水平,培养液的pH值渐趋稳定;但20 h左右pH值下降渐趋缓慢,最终稳定在3.8左右,说明培养液中可能有碱性物质生成,与大量供试菌产生的酸性物质发生中和,导致pH值渐趋平稳。培养液中添加了足量的胍基丁胺与磷酸吡哆醛,随着供试菌数量的增加,腐胺也在不断累积,作为一类碱性物质可与供试菌产生的酸性物质中和,说明供试菌具有较强的通过AGDI途径产腐胺的能力。图2中不添加大蒜精油组的pH值趋于稳定后低于另外两组,这是由于大蒜精油抑制了供试菌的增殖。
2.2 基因表达分析
如图3、4所示,以MIC大蒜精油组为对照,不添加、1/2 MIC大蒜精油组的aguR基因相对表达量分别为1.32、1.28,都不到MIC组的2 倍,说明aguR基因的相对表达量受大蒜精油质量浓度的影响不明显,这类似于del Rio等[20]对NaCl对乳酸乳球菌影响的研究结果。而aguB基因的相对表达量随着大蒜精油质量浓度的增加极显著减小(P<0.01),其中不添加大蒜精油组的aguB基因相对表达量是MIC组的258.03 倍,1/2 MIC组的aguB基因相对表达量是MIC组的101.6 倍。说明大蒜精油极显著抑制了操纵子aguBDAC的转录(P<0.01),可能是由于大蒜精油影响了AguR感应胍基丁胺及其二聚化。

图 3 不同大蒜精油质量浓度下的aguR基因相对表达量Fig. 3 Effect of garlic essential oil concentration on aguR gene expression

图 4 不同大蒜精油质量浓度下的aguB基因相对表达量Fig. 4 Effect of garlic essential oil concentration on aguB gene expression
经研究发现,pH值影响AGDI基因簇的表达[21],酸性pH值有利于AguR的构造[22],使信号到DNA结合域的转导更加高效,从而激活aguB的信号后增加操纵子aguBDAC的转录。添加大蒜精油会使供试菌生长过程中产酸量减少,从而不利于AGDI反应的发生。图4中不添加大蒜精油组的aguB基因相对表达量是1/2 MIC组的2.54 倍,是MIC组的258.03 倍;而由图2可知,处于稳定期时不添加大蒜精油组与1/2 MIC组pH值相差0.4左右,与MIC组相差1.4左右,说明不添加大蒜精油组和MIC组aguB基因相对表达量的差异既有大蒜精油对其的直接影响,又有大蒜精油导致两组间pH值差异过大继而影响aguB基因表达的间接影响。
2.3 纯菌体系中腐胺产量分析

图 5 添加不同质量浓度大蒜精油48 h内培养液中腐胺积累量Fig. 5 Putresine accumulation in 48 h pure culture with different concentrations of garlic essential oil
如图5所示,不添加大蒜精油组在12 h内未检测到腐胺,1/2 MIC组在16 h内未检测到腐胺,MIC组在24 h内未检测到腐胺;12~40 h之间不添加大蒜精油组的腐胺积累速率明显大于1/2 MIC、MIC组;36 h左右时,3 组培养液中的腐胺积累速率开始减慢。本研究中的德氏乳杆菌具有较强的通过AGDI途径合成腐胺的能力,不添加大蒜精油和1/2 MIC组在24 h后才开始大量检测到腐胺,MIC组则是在28 h左右才检测到一定量的腐胺,这可能与del Rio等[23]发现的胍基丁胺脱亚胺酶的调节基因和操纵子aguBDAC中的启动基因只有在微生物生长到对数期和稳定期的过渡期时才会被激活有关。而36 h以后腐胺的产生速率减缓是因为培养液中的胍基丁胺被消耗,其浓度和AGDI活性降低,所以腐胺的产生变慢[24]。
大蒜精油可以减少细菌的生长,且会抑制AGDI活性,随着大蒜精油质量浓度的增加,操纵子aguBDAC的转录受到抑制,所以各组腐胺积累量趋于稳定后,不添加大蒜精油组比另外两组的腐胺积累量都高。也就是说适当地添加大蒜精油可有效抑制AGDI基因簇的表达,从而减少腐胺的积累。有研究发现乳酸菌在生长期间产酸造成的酸性环境会导致更多生物胺的产生[25],比如酸性环境有利于粪肠球菌合成酪胺[26],这是一种耐酸反应,供试菌可以通过此反应来改善其在酸性环境中的适应性。在最开始的一段时间内培养液中检测不到腐胺,这可能是因为供试菌不仅在增加数量,也在适应所处环境。
2.4 熏马肠发酵过程中pH值的变化

图 6 添加不同质量浓度大蒜精油后熏马肠发酵期间pH值的变化Fig. 6 Change in pH during fermentation of smoked horse meat sausages with different concentrations of garlic essential oil
如图6所示,新鲜马肠的初始pH值为5.60~5.64,随着发酵的进行,3 组熏马肠在发酵前3 d的pH值下降迅速,随后缓慢下降,到第21天左右开始缓慢回升。0~3 d时pH值迅速下降主要是由于接种的德氏乳杆菌会作用于熏马肠中存在的碳水化合物,使其分解为乳酸或其他有机酸。发酵第7~14天时pH值下降缓慢,是因为低温导致熏马肠中的微生物生长缓慢,从而使其产酸变慢。第21天时pH值慢慢上升主要是由于熏马肠发酵成熟过程中水分含量不断减少,且在添加的德氏乳杆菌和少量未灭活的外源菌作用下熏马肠中有生物胺产生。在第28天时,3 组样品的pH值均处于4.60~4.70之间,最终pH值比Lu Shiling等[15]的研究中终产品低,这可能与马肉品质的不同有关。0~3 d内不添加大蒜精油组pH值下降幅度明显大于添加大蒜精油的两组,且终产品pH值略低于其他组,但是添加大蒜精油对熏马肠发酵完成后的最终pH值影响并不明显,类似的研究结果也曾被Bozkurt[27]报道。
2.5 熏马肠发酵过程中微生物菌落总数变化

图 7 添加不同质量浓度大蒜精油后熏马肠发酵期间的菌落总数变化Fig. 7 Change in total bacterial count during fermentation of smoked horsemeat sausages with different concentrations of garlic essential oil
据报道,乳酸菌在香肠发酵过程中会成为优势菌[28]。如图7所示,各组菌落总数在发酵的前3 d增长较快,基本达到最大值,之后的25 d并未发生明显变化。各组菌落总数基本在同一数量级,这与原料肉品质间的差异有关,也与各组熏马肠中菌种活性不同有关,但是1/2 MIC组与MIC组菌落总数明显低于不添加大蒜精油组。到发酵7 d后,不添加大蒜精油组菌落总数依旧增加,但另外两组的菌落总数明显减少,且MIC组菌落总数始终比1/2 MIC组低,表明大蒜精油对熏马肠中细菌的生长具有一定的抑制作用。
2.6 熏马肠发酵过程中的腐胺积累量分析

图 8 添加不同质量浓度大蒜精油后熏马肠发酵期间的腐胺积累量Fig. 8 Putrescine accumulation in smoked horsemeat sausages with different concentrations of garlic essential oil during fermentation
发酵香肠中存在的腐胺对消费者的健康有潜在的危害,它是产品腐败的产物[29]。如图8所示,实验所使用马肉的新鲜程度、卫生质量以及加工和发酵成熟过程中的微生物种类和数量的变化等都会影响腐胺的产生。在熏马肠发酵成熟过程中,添加大蒜精油的两组腐胺含量明显低于不添加大蒜精油组,1/2 MIC组和MIC组的腐胺积累量分别比不添加大蒜精油组平均减少了30%、50%以上,这是因为大蒜精油对AGDI具有抑制作用,从细菌数量和基因表达上双重阻碍了腐胺的产生。
大量研究证明尸胺和腐胺是发酵肉制品中主要的生物胺[30],它们除了具有增强产品中组胺和酪胺的毒性作用,还会与一些胺氧化酶反应减弱其降解生物胺的活性。图8显示,本研究的3 组熏马肠在发酵的0~3 d内,腐胺积累量低于安全限量标准(50 mg/kg)[31],但不添加大蒜精油组在第7天时腐胺含量开始超出这个限量标准,而另外两组直到成熟结束也未超过此标准,说明在发酵香肠中适量地添加大蒜精油有利于其食用安全性。
3 结 论
研究表明,在培养液中添加大蒜精油能够明显抑制德氏乳杆菌的生长,也能够明显抑制pH值的下降,且大蒜精油质量浓度越高抑制作用越大。大蒜精油对AGDI基因簇中的调节基因aguR表达影响不大,但能抑制分解代谢基因aguBDAC中aguB基因的表达。随着大蒜精油质量浓度的增加,AGDI基因簇中的aguB基因表达量极显著减少(P<0.01),从而使整个操纵子的转录受到抑制,即添加大蒜精油能够通过抑制AGDI途径的基因表达来降低供试菌产腐胺的能力。所以在纯菌培养体系中,大蒜精油通过抑制德氏乳杆菌的数量、pH值的下降和aguB基因的表达来整体抑制腐胺的产生。
在新鲜熏马肠中添加大蒜精油可明显减少发酵过程中的菌落总数,但对发酵产品的最终pH值影响不明显。大蒜精油能够抑制产腐胺菌中AGDI基因簇的表达,从而使熏马肠发酵产生的腐胺随着大蒜精油质量浓度的增加明显减少。在熏马肠体系中,大蒜精油主要是通过抑制菌落总数和aguB基因的表达来减少腐胺的积累。MIC大蒜精油组相比于不添加大蒜精油组腐胺积累量减少了50%以上,因此,在熏马肠中添加一定量的大蒜精油能够很好地提升产品的安全性。

