1-脱氧野尻霉素对α-葡萄糖苷酶的抑制作用机制
郭时印,李 林,周 虹,唐忠海,苏小军,,李清明
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.湖南省农业科学院作物研究所,湖南 长沙 410125)
糖尿病是一种常见、多发且与遗传因素、环境因素相关的复杂疾病,在中国传统医学中属于“消渴病”的范畴,也是一组由于胰岛素分泌缺陷或胰岛素作用缺陷,或者两者兼有而引起的以高血糖代谢为特征的代谢疾病。目前还没有能够有效根治糖尿病的特效药物,其已经成为继心脑血管疾病和癌症之后的第三号杀手和世界三大公共卫生难题之一,严重危害人类健康[1]。全世界约有1.51亿糖尿病患者,且发病率呈逐年上升趋势,其中,2型糖尿病患者约占糖尿病患者总数的90%,发病年龄多在40 岁以上,且有年轻化的趋势。目前每年约有4 000万 人死于与糖尿病相关的疾病,占全球总死亡人数的9%。糖代谢紊乱是糖尿病的重要病理生理学基础[2],也是糖尿病患者血糖失衡的重要原因。调节糖代谢、维持血糖平衡是治疗糖尿病的一个重要途径。治疗糖尿病的药物很多,其虽能快速抑制血糖浓度,但毒副作用较大[3]。因此,寻找和开发具有降血糖功效的天然产物成为当今医学领域和食品领域研究的热点。
桑叶具有很好的降血糖功能,可以抑制血糖上升,预防和治疗糖尿病[4-10]。日本科学家曾报道1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)是桑叶中治疗糖尿病的功效物质[7]。α-葡萄糖苷酶是一类催化水解葡萄糖基酶的总称,在碳水化合物消化过程中发挥着关键作用,通过从底物的非还原性末端依次切开α-1,4糖苷键,然后再缓慢水解α-1,6糖苷键,将淀粉转化为葡萄糖而被人体吸收[11-13]。DNJ的分子结构类似葡萄糖,能够竞争性抑制α-葡萄糖苷酶的活性,从而降低血糖浓度。但DNJ与α-葡萄糖苷酶通过什么作用力作用、如何作用、作用的位点在哪里,这些问题还不十分清楚。
光谱法具有分析速度快、操作简便、灵敏度高等特点,是研究小分子与蛋白质之间相互作用的最为典型的方法之一[14-17]。紫外吸收光谱法中,如果蛋白质分子与底物结合之后吸收峰的位置和强度有明显的差异,则可以认为蛋白质分子构象与未结合时相比已经发生变化;荧光光谱法中,具有吸收光子能力的物质在特定波长光(如紫外光)的照射下,吸收荧光光谱后发生能级跃迁,可以在瞬间发射出波长比激发光长的荧光,因此可以利用物质的荧光光谱进行定性与定量分析,通过研究小分子和蛋白质相互作用前后发光体光谱信号(荧光强度、荧光峰的特征波长)的变化来研究二者的相互作用。圆二色光谱(circus dichotomy,CD)法能够在接近生理条件下进行低浓度、无损伤的分析,因此可以借助其进行定量分析,确定蛋白质主链含量及其无规卷曲含量等,获取蛋白质主链的二级构象信息。CD法在蛋白质与酶的立体结构分析中应用前景广泛,是目前解析其变化较好的方法之一。
本研究运用紫外光谱法初步分析蛋白质分子构象,再运用荧光光谱法深入探究两者的作用机制,最后利用CD法对蛋白质分子的变化进行定量分析。3 种光谱方法逐步递进,相互补充。联合运用3 种方法能够更全面、深入地研究蛋白与分子作用的过程。同时,本研究模拟生理条件(pH 6.8),考察DNJ对α-葡萄糖苷酶二级结构的影响以及二者结合点的部位,探索DNJ与α-葡萄糖苷酶相互作用的猝灭机理、结合模式和部位,以期阐明桑叶DNJ提取物体外降血糖的作用机制。
1 材料与方法
1.1 材料与试剂
川芎由北京同仁堂集团公司提供,由西安交通大学药学院生药教研室鉴定为伞形科植物川芎(Ligusticum chuanxiong Hort.)的干燥根茎。
正己烷(色谱纯) 德国Meker公司;GF254薄层色谱硅胶 青岛海洋化工厂;α-葡萄糖苷酶 上海伊卡生物科技有限公司;1-(4-硝基苯基)(1-(4-nitrophenyl),PNP)(纯度≥99%)、1-(4-硝基苯基)-1,2,3-丙三醇(1-(4-nitrophenyl)glycerol,PNPG)(纯度≥99%)、磷酸盐缓冲液(phosphate buffered saline,PBS)、超纯水、DNJ(纯度98%) 上海金穗生物科技有限公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
p-Quant酶测试仪 美国BioTek公司;天平 德国Sartorius公司;HZQ.C振荡器 哈尔滨东明医疗仪器厂;Delta 320 pH计 瑞士Mettler-Toledo公司;高速低温离心机 德国Eppendorf公司;F-4600荧光光度计日本日立公司;J-815 CD仪 日本Jasco公司。
1.3 方法
1.3.1 DNJ抑制α-葡萄糖苷酶的紫外光谱测定
α-葡萄糖苷酶与PNPG反应生成在碱性环境下显黄色的PNP,PNP的吸光度与α-葡萄糖苷酶活力呈正相关。将0.292 mg/mL DNJ溶液50 μL、0.5 U/μL α-葡萄糖苷酶提取液50 μL、PBS 50 μL以及5 mmol/L PNPG 50 μL混合成200 μL DNJ反应液,37 ℃下孵育40 min。取9 个离心管,第1管中加2 mL PBS作为对照,在后8 个离心管中各加1 mL PBS,用移液器吸取1 mL DNJ反应液于第2个离心管中,吹打均匀,然后在第2个离心管中吸取1 mL溶液于第3个离心管中,以此类推,最后1 个离心管弃去1 mL溶液,构成不同质量浓度溶液。每个离心管中吸取50 μL溶液,与50 μL α-葡萄糖苷酶溶液一同加于酶标板中,再向每个孔中分别加50 μL PBS,混合均匀,置于37 ℃水浴锅中孵育20 min。孵育结束后,向上述孔中加入50 μL 5 mmol/L PNPG反应液,置于水浴锅中反应15 min。向每个孔中加入200 μL 0.2 mol/L Na2CO3溶液终止反应。用酶标仪在400 nm波长处测定OD值[18]。实验设置3 个平行。用公式(1)计算α-葡萄糖苷酶对样品的抑制率。

式中:OD样品代表不同质量浓度的样品液在400 nm波长处的OD值;OD空白代表超纯水在400 nm波长处的OD值;OD对照代表对照在400 nm波长处的OD值。
以抑制率为纵坐标,样品质量浓度为横坐标,通过作图分析抑制活性曲线,计算半抑制浓度(half maximal inhibitory concentration,IC50)。
1.3.2 DNJ对α-葡萄糖苷酶抑制类型的判断
取18 个离心管分成3 组,第1组中分别加入50 μL PBS、50 μL 0.292 mg/mL DNJ溶液、50 μL PNPG溶液;第2组中分别加入50 μL PBS、50 μL 0.195 mg/mL DNJ溶液、50 μL PNPG溶液;第3组中分别加入100 μL PBS、50 μL PNPG溶液作为阳性对照,其中PNPG溶液浓度均分别为0.500、0.625、0.833、1.250、2.500、5.000 mmol/mL。充分振荡混合均匀后,将离心管置于37 ℃水浴锅中保温15 min。然后分别加入50 μL 5 mmol/L PNPG溶液,在37 ℃恒温水浴锅中孵育15 min,加入200 μL 0.2 mol/L Na2CO3终止反应。吸取200 μL混合液于96 孔板上,用酶标仪在400 nm波长处测定OD值[18]。实验设置3 个平行。根据Lineweave-Burk双倒数图判断抑制类型。
1.3.3 DNJ抑制α-葡萄糖苷酶的荧光光谱分析
分别取0.5 U/μL α-葡萄糖苷酶提取液50 μL和不同浓度(0、0.33×10-4、0.66×10-4、0.99×10-4、1.32×10-4、1.64×10-4、1.96×10-4、2.28×10-4、2.60×10-4、2.91×10-4、3.23×10-4、3.54×10-4mol/L)的DNJ溶液,配成α-葡萄糖苷酶-DNJ混合体系,取200 μL于1 mm荧光池中,设置激发波长为280 nm,激发和发射狭缝宽度均为2.5 nm,在273、298、310 K 3 个温度下扫描,得到300~500 nm波长范围内的荧光光谱[19]。参比溶液为PBS。
1.3.4 DNJ抑制α-葡萄糖苷酶的CD分析
在持续的氮气流和60 nm/min扫描速度下,分别测定180~250 nm波长范围内PBS和DNJ溶液(0、1×10-4、2×10-4、4×10-4mol/L)的CD图谱[20],以游离的α-葡萄糖苷酶作为对照;记录不同浓度的α-葡萄糖苷酶-DNJ混合体系分别反应20、40、60 min的CD图谱;通过在线Dichroweb软件(http://dichroweb.cryst.bbk.ac.uk/html/home.shtml)的SELCON3程序[21]计算与DNJ结合前后的α-葡萄糖苷酶二级结构(α-螺旋、β-折叠、β-转角和无规卷曲)的含量。
1.4 数据分析
数据采用Excel 2010软件分析,绘图采用Origin 8.0软件。
2 结果与分析
2.1 紫外光谱法分析DNJ与α-葡萄糖苷酶的相互作用
如图1所示,DNJ对α-葡萄糖苷酶的抑制活性随质量浓度增大而增加,且呈剂量依赖性。线性回归分析得到DNJ抑制α-葡萄糖苷酶的IC50为0.297 µg/mL。

图 1 DNJ抑制α-葡萄糖苷酶活性曲线Fig. 1 Inhibition curve of α-glucosidase by DNJ

图 2 DNJ与α-葡萄糖苷酶的Lineweave-Burk双倒数图Fig. 2 Lineweaver-Burk plots for α-glucosidase inhibition by DNJ
利用Lineweave-Burk双倒数法作图,如图2所示,分别对3 个不同质量浓度DNJ与α-葡萄糖苷酶反应相同时间时绘制3 条直线。可以看出该反应具有良好的线性关系。竞争性抑制动力学方程中Y轴的交点即为vmax的倒数。式中:v是反应速率/(mol/(L·s));Km是米氏常数/(mol/L);vmax为酶促反应的最大速率/(mol/(L·s));[S]为底物(PNP)浓度/(mol/L)。
由图2可以看出,在加酶量相同时,随着DNJ质量浓度的变化,反应速率的倒数与底物浓度的倒数呈线性关系,且3 条线焦点在Y轴,说明DNJ的质量浓度变化不影响反应的最大速率,所以抑制类型为竞争性抑制。
2.2 荧光光谱法分析DNJ与α-葡萄糖苷酶的相互作用
2.2.1 荧光猝灭光谱

图 3 不同浓度DNJ存在时α-葡萄糖苷酶的荧光光谱Fig. 3 Fluorescence spectra of α-glucosidase in the presence of DNJ at different concentrations
DNJ对α-葡萄糖苷酶有明显的抑制活性,这意味着DNJ可能结合到α-葡萄糖苷酶上,为了进一步探讨DNJ与α-葡萄糖苷酶的相互作用机制,利用荧光光谱进行进一步分析。从图3中可以发现,α-葡萄糖苷酶由于其蛋白质分子中的苯丙酮酸、酪氨酸和色氨酸含有苯环共轭双键,因此具有光吸收能力。所以α-葡萄糖苷酶在280 nm激发波长下,在344 nm波长处有峰值。随着DNJ浓度的增大,混合物的荧光强度下降,说明在DNJ与α-葡萄糖苷酶之间确实存在相互作用,且发生了能量转移,可见DNJ对α-葡萄糖苷酶有荧光猝灭作用。但混合体系的最大发射波长未发生位移,所以推测DNJ与α-葡萄糖苷酶所形成的复合物没有荧光特性。
2.2.2 荧光猝灭机理的确定
荧光猝灭的类型分为动态猝灭与静态猝灭。无论是就能量而言还是就电子而言,静态猝灭不会对蛋白质生理活性或者是结构方面产生明显影响;而动态猝灭对蛋白质二级结构产生影响应。荧光猝灭符合Stern-Volmer方程(式(2))。

式中:F0为不加猝灭剂的荧光强度;F为加猝灭剂后的荧光强度;Kq为表观猝灭常数/(L/(mol·s));Ksv为荧光猝灭常数/(L/mol),反映两种衰变途径之间的竞争,是双分子猝灭常数与单分子衰变速率常数的比值;τ0为没有猝灭剂存在下的荧光分子平均寿命/s,生物大分子荧光寿命一般约为10-8s[22];[Q]为猝灭剂(DNJ)浓度/(mol/L)。

图 4 不同温度下DNJ对α-葡萄糖苷酶的荧光猝灭Stern-Volmer曲线Fig. 4 Stern-Volmer plots for the fl uorescence quenching of α-glucosidase by DNJ at different temperatures
从图4可以看出,F0/F与[Q]呈线性关系,由斜率可以求得Ksv及Kq。已知各种猝灭剂对生物大分子的最大扩散猝灭常数为2.0×1010L/(mol·s)[14]。如果相互作用体系中Kq大于最大扩散猝灭常数,则其荧光猝灭机理是相互作用产生了新的化合物从而发生静态猝灭,而非动态猝灭。
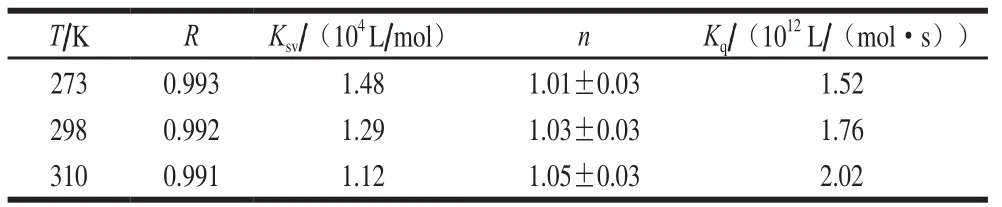
表 1 不同温度下DNJ与α-葡萄糖苷酶作用的相关参数Table 1 Reaction kinetic parameters between DNJ and α-glucosidase at different temperatures
从表1中可以看出,随着温度的增加,Ksv呈明显的下降趋势,说明DNJ对α-葡萄糖苷酶的荧光猝灭为静态猝灭。而从它相对应的Kq可以看出,上述两者间所产生的基态复合物使内源荧光猝灭。
2.2.3 结合常数及结合位点数的确定
结合常数(K)与结合位点数(n)是小分子与大分子蛋白相互作用的重要定量数据。在小分子对生物大分子的静态猝灭过程中,假设小分子在生物大分子上有多个相似且独立的结合位点,则DNJ和α-葡萄糖苷酶相互作用反应体系的K和n可以通过双对数方程(式(3))求得。
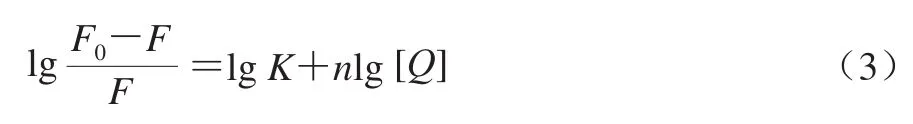
本实验中273、298、310 K 3 个温度下相关系数(R)均约为1(表1),代表3 条曲线线性良好,呈完全正相关关系;K随着温度的升高而增加,对于α-葡萄糖苷酶来说,表明DNJ和它的结合能力与温度呈正相关。在3 个温度下,n分别是1.05±0.03、1.03±0.03、1.01±0.03,说明DNJ与α-葡萄糖苷酶间仅有一个结合位点。
2.2.4 热力学性质及作用力的判断
小分子与酶等生物大分子之间通过疏水作用、氢键、范德华力和静电引力等结合。吉布斯自由能变(ΔG)能够决定小分子与酶的结合反应能否自发进行;ΔG<0表明反应能够自发进行。小分子与蛋白质的作用力类型可以通过熵变(ΔS)或者焓变(ΔH)的正负性来判断,通过公式(4)、(5)计算。

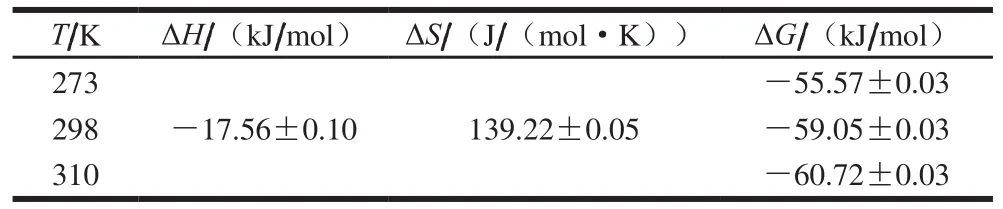
表 2 DNJ与α-葡萄糖苷酶相互作用过程中的焓变、熵变和自由能变Table 2 Changes in enthalpy, entropy and free energy for DNJ interaction with α-glycosidase
从表2可以看出,ΔG为负值,表明DNJ与α-葡萄糖苷酶的结合反应是一个自发的过程。298 K时ΔH和ΔS分别为-(17.56±0.10)kJ/mol和(139.22±0.05)J/(mol·K),这意味着DNJ与α-葡萄糖苷酶的相互作用形成复合物的过程是熵驱动的吸热反应,并且静电吸引力是两者结合反应的主要驱动力,与刘家琴等[23]的结果相似。
2.3 CD法分析DNJ与α-葡萄糖苷酶的相互作用

图 5 DNJ与α-葡萄糖苷酶反应的CD图谱Fig. 5 CD spectra of α-glucosidase with DNJ
CD法揭示了DNJ的加入对α-葡萄糖苷酶中α-螺旋含量的影响。从图5中可以发现,α-葡萄糖苷酶的CD光谱图有两个非常明显的负峰,一个是在222 nm波长处,另一个是在是209 nm波长处。其强度可以反映葡萄糖苷酶中α-螺旋的含量。α-螺旋的含量可以通过公式(6)、(7)计算。

式中:θobs是椭圆度/mdeg;n为氨基酸残基数(583);l是比色皿的宽度/mm;Cp是葡萄糖苷酶浓度/(mol/L);MRE表示氨基酸残基平均摩尔椭圆度(mean residue ellipticity)/mdeg,MRE209nm为在209 nm处的MRE。
在DNJ浓度不断增大的情况下,α-葡萄糖苷酶222、209 nm波长的CD光谱强度有所下降。但从峰形上来看仍保持原状。这说明α-葡萄糖苷酶的α-螺旋结构含量下降。
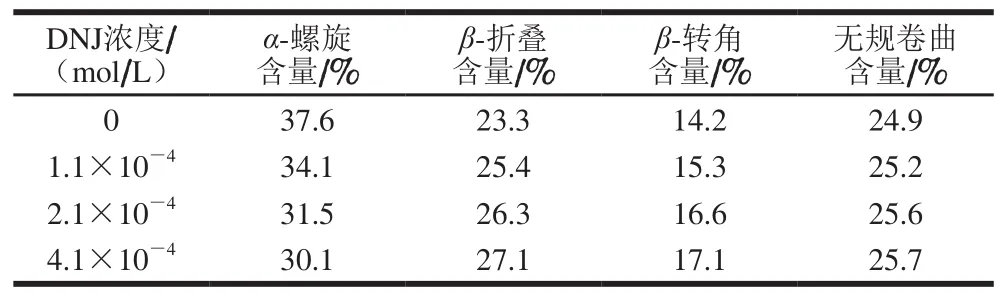
表 3 α-葡萄糖苷酶和α-葡萄糖苷酶-DNJ体系的蛋白质二级结构含量Table 3 Percentages of protein secondary structures in α-glucosidase and α-glucosidase-DNJ complex
在对相关数据深入研究的基础上,借助于Dechoiwrb网站对α-葡萄糖苷酶二级结构进行精确计算。如表3所示,在加入4.1×10-4mol/L DNJ后,其α-螺旋结构含量已经下降至30.1%。而此时β-折叠、β-转角、无规卷曲含量都有了不同程度的上升。说明在DNJ作用下,α-葡萄糖苷酶构象中的二级结构含量会发生变化。且上述构象变化可以诱导酶活性口袋的关闭,这不利于活性位点与底物的相互结合。
CD法研究发现,DNJ诱导改变了α-葡萄糖苷酶的构象,并使其二级结构含量发生变化,α-螺旋含量明显降低,活性中心口袋关闭,抑制了α-葡萄糖苷酶对底物的催化。Peng Xin等[24]通过CD法测定也发现,黄酮类化合物抑制α-葡萄糖苷酶活性的原因是其令α-葡萄糖苷酶的多肽结构部分展开,使其构象发生改变。
3 结 论
本实验采用紫外光谱法、荧光光谱法和CD法研究蛋白质与分子作用的过程,逐步递进、相互补充;研究了DNJ与α-葡萄糖苷酶的相互作用机制,得到DNJ与α-葡萄糖苷酶反应的IC50为0.297 µg/mL。利用Lineweave-Burk双倒数法作图,分析得到DNJ对α-葡萄糖苷酶的抑制类型为竞争型抑制,这与Yang Zhenzhong等[25]的研究结果一致。DNJ与α-葡萄糖苷酶反应为生成配合物的静态猝灭,两者形成基态复合物,使α-葡萄糖苷酶的内源荧光猝灭。DNJ与α-葡萄糖苷酶相互作用形成复合物的过程是熵驱动的吸热反应,静电吸引力是两者结合反应的主要驱动力[26-28]。不同温度(273、298、310 K)下Ksv分别为1.48×104、1.29×104、1.12×104L/mol。DNJ使α-葡萄糖苷酶的α-螺旋含量降低,二级结构含量发生变化。表明DNJ降低α-葡萄糖苷酶活性的机理是使α-葡萄糖苷酶的构象发生变化,且使二级结构重新排列;而这种酶构象的变化能够诱导酶活性口袋关闭,不利于底物结合到活性位点。

