海参皂苷对去卵巢小鼠骨密度的改善作用及机制
王晓红,李媛媛,戴宇峰,王静凤*,李兆杰,薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
骨质疏松是常见的系统性骨代谢障碍疾病的一种,其主要表现为骨矿减少、骨强度降低和骨组织结构损坏,在绝经后妇女和老年人中较为常见[1]。骨质疏松导致骨骼支撑功能下降,极易引发骨折,这也是骨质疏松症致残、致死的重要原因[2]。在患骨质疏松症人口数最多的中国,人口老龄化的趋势将进一步加剧骨质疏松的发生。高发病率和日益加重的经济负担使得骨质疏松症成为亟待解决的骨骼疾病[3]。
各骨质疏松症类型中,原发性骨质疏松占比最高,其中绝经后骨质疏松呈高骨转换特征,即骨生成由于骨吸收的增强也代偿性升高。药物治疗是目前缓解骨质疏松的主要方式,其大多通过抑制骨吸收或促进骨生成发挥作用。虽然这些药物具有一定的疗效,但长期服用不仅价格昂贵,还会产生诸多不良反应[4-5]。因此,从生物活性物质中寻求安全有效的改善骨质疏松症方法是目前的研究热点。
棘皮动物海参是我国传统珍贵食材,其营养丰富,富含胶原蛋白、多糖、脂质、皂苷及微量元素等多种活性物质,具有抗癌、抗衰老、降糖降脂、增强免疫力等功效[6-9]。海参皂苷与人参皂苷结构相似,同属三萜皂苷,其结构多为羊毛甾烷型[10],是海参体壁的主要营养成分之一。植物皂苷特别是人参皂苷已有大量研究发现其具有促进成骨细胞增殖分化,降低骨吸收,改善骨质疏松的功效[11-12]。而与其结构类似同属三萜皂苷的海参皂苷,虽已探明其具有抗菌、抗肿瘤、改善脂质代谢紊乱等多种生理活性作用[13-14],但在其是否能够改善骨质疏松方面仍鲜有研究报道。
本实验采用双侧去卵巢手术建立绝经后骨质疏松症模型,通过检测尿钙、尿磷浓度、骨密度、骨矿化沉积和关键基因的表达,以探究海参皂苷对去卵巢小鼠骨质疏松症骨密度的改善作用及机制,为海参皂苷的开发应用和防治骨质疏松症提供研究参考。
1 材料与方法
1.1 动物、材料与试剂
SPF级雌性C57BL/6J小鼠,体质量(20±1)g,购买自北京维通利华公司。动物合格证号:SCXK(京)2012-0001。动物饲养室进行12 h光照12 h黑暗交替,保持良好通风,控制室温为(23±1)℃,饲养期间小鼠自由饮水并摄食标准饲料。
海参皂苷来自于中国海洋大学食品科学与人类健康实验室,以菲律宾刺参为原料,按照董平[10]的方法制备。海参干燥后研成粉末,在室温下以体积分数60%乙醇溶液浸提,减压浓缩后以水饱和正丁醇萃取,正丁醇部分减压浓缩蒸干后,进一步通过大孔树脂纯化得海参皂苷,其纯度经高效液相色谱法测定达80%。
RNA柱式提取试剂盒 生工生物工程公司;M-MLV逆转录酶 美国Promega公司;尿钙、尿磷试剂盒南京建成科技公司;上、下游引物 苏州金唯智生物科技公司;其他试剂为国产分析纯。
1.2 仪器与设备
IQ5型实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪、Model680型酶标仪 美国Bio-Rad公司;Neofuge 13R型离心机上海力申科学仪器公司;GK99-UNIGAMMA X-RAY PLUS双能X射线骨密度仪 意大利I’acn公司;DM2500荧光显微镜 德国Leica公司;HM 315型石蜡切片机德国MICROM GmbH公司。
1.3 方法
1.3.1 骨质疏松症模型建立及动物分组
42 只雌性C57BL/6J小鼠经适应性饲养1 周后随机分成2 组:假手术组和去卵巢组。小鼠禁食不禁水12 h后,腹腔注射体积分数10%水合氯醛溶液进行麻醉。小鼠腹部剃毛并消毒后打开腹腔,去卵巢组小鼠摘除两侧卵巢,假手术组小鼠仅切除腹腔内一小块脂肪,分层缝合切口。术后去卵巢组2 只小鼠死亡,其余小鼠连续3 d腹腔注射200 000 U/kg mb青霉素抗感染。
术后4 周按体质量随机将存活小鼠分成4 组:假手术组、模型组和低、高剂量海参皂苷组,每组10 只。低、高剂量海参皂苷组分别灌胃7.5 mg/kg mb和15 mg/kg mb生理盐水溶解的海参皂苷,假手术组与模型组灌胃10 mL/kg mb生理盐水。小鼠每天灌胃1 次,灌胃周期90 d,期间未出现死亡情况。实验期间小鼠自由进食饮水,每3 d记录体质量。
实验结束前第14天持续2 d按照20 mg/kg mb腹腔注射盐酸四环素,实验结束前第4天持续2 d腹腔注射5 mg/kg mb钙黄绿素;实验结束前5 d小鼠入代谢笼,收集24 h尿液,取离心后的上清液检验尿液指标;末次给药后所有小鼠12 h禁食不禁水,摘眼球取血,迅速分离股骨,未做荧光标记的小鼠的股骨于体积分数10%中性甲醛溶液固定,用于骨密度的检测;荧光标记的小鼠的股骨于体积分数95%乙醇溶液中固定,用于矿化沉积率测定;迅速分离胫骨,包裹于锡箔纸中暂存于液氮,转移至-80 ℃保存,用于基因检测。
1.3.2 尿液生化指标的测定
尿液中钙、磷浓度的检测参照试剂盒说明书进行。
1.3.3 股骨骨密度的检测
将固定24 h的股骨流水冲洗24 h,包裹于生理盐水浸泡过的纱布,-20 ℃储存。检测前将小鼠股骨取出平衡至室温,将右侧股骨置于小动物模式的双能X射线骨密度扫描仪,并用相关软件分析骨密度结果。
1.3.4 股骨骨矿化沉积率的测定
将24 h固定的股骨流水冲洗24 h,脱钙过程3 h,使用质量分数10%乙二胺四乙酸脱钙液,后再次流水冲洗24 h。脱水包埋后,制作10 μm骨切片并观察,拍照与合成使用荧光显微镜。使用Image J软件测量黄绿两条线之间的平均宽度,与两次注射的间隔时间相除得骨矿化沉积率。
1.3.5 qPCR分析
按照RNA柱式抽提试剂盒的方法提取胫骨总RNA。在M-MLV逆转录酶催化下,使1 μg的RNA逆转录为cDNA,具体反应条件及体系参照逆转录酶M-MLV说明书。以逆转录获得的cDNA为模板,进行qPCR分析。反应体系:cDNA 5 μL、上下游引物各0.75 μL、SYBR 12.5 μL、双蒸水6 μL。95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火10 s,72 ℃延伸45 s,共45 个循环。以内参基因β-actin校正各基因mRNA的表达量,实验所用引物序列如表1所示。

表 1 Wnt/β-catenin通路qPCR相关基因引物序列Table 1 Primer sequences used for qPCR ampli fi cation of genes involved in the Wnt/β-catenin signaling pathway
1.4 数据统计与分析
通过SPSS 11.0软件进行数据分析:采用单因素方差分析,并采用最小显著性差异法进行两两比较;P<0.05时认为具有显著性差异,实验数据用 ±s表示。
2 结果与分析
2.1 海参皂苷去卵巢小鼠尿钙、尿磷浓度的影响
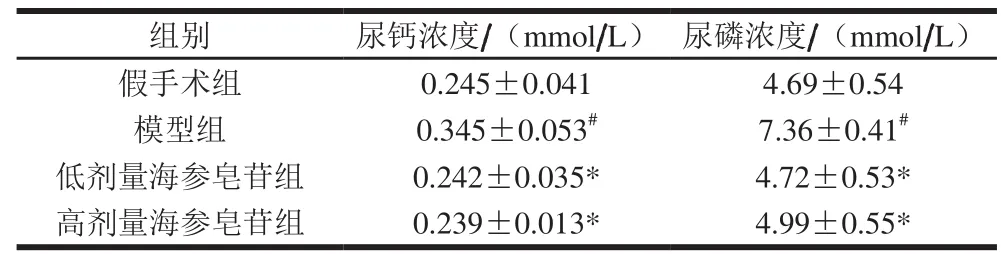
表 2 海参皂苷对去卵巢小鼠尿钙、尿磷浓度的影响(n=10)Table 2 Effect of SCS on the urinary levels of calcium and phosphorus in osteoporotic mice (n= 10)
钙、磷是骨中无机质的重要组分,当体内溶解骨矿活动增加时,其流经血液由尿液排出体外。如表2所示,模型组小鼠尿钙、尿磷水平较假手术组分别增加了40.82%和56.93%,表明去卵巢小鼠体内溶骨活性增强,骨矿物质降解、流失严重。海参皂苷的干预使去卵巢小鼠尿钙、尿磷的排泄量较模型组小鼠显著降低,提示海参皂苷有显著的抑制去卵巢小鼠骨矿物质流失的功效。
2.2 海参皂苷提高去卵巢小鼠股骨骨密度
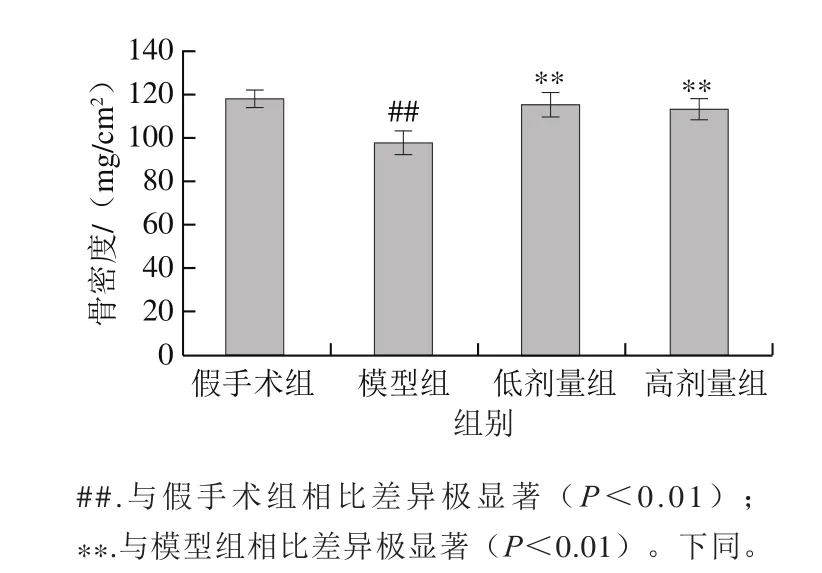
图 1 海参皂苷对股骨骨密度的影响(n= 7)Fig. 1 Effect of SCS on BMD of the femur (n = 7)
骨矿物质流失使得骨矿含量逐渐减少,最终导致骨密度降低,这也是骨质疏松发病的重要表现。如图1所示,模型组小鼠较假手术组小鼠的股骨骨密度下降了16.95%,差异极显著(P<0.01),表明骨质疏松在模型组小鼠中已经发生。小鼠经海参皂苷干预后,股骨骨密度得到明显提升,与模型组相比,低、高剂量海参皂苷组股骨骨密度分别升高了18.03%(P<0.01)和15.99%(P<0.01)。结果表明,海参皂苷能够抑制小鼠因去卵巢引起的骨矿物质流失,提高去卵巢小鼠骨密度。
2.3 海参皂苷提高去卵巢小鼠骨矿化沉积
骨矿化是指在形成骨质过程中,羟基磷灰石经由钙、磷等无机盐形成,一定条件下沉积到类骨质中。骨矿化沉积率反映了骨重建阶段成骨细胞矿化类骨质的能力[15]。盐酸四环素和钙黄绿素能够与钙螯合并沉积在骨矿化前沿,因此两种荧光标记之间的距离直观反映了两次注射期间的骨矿化情况。
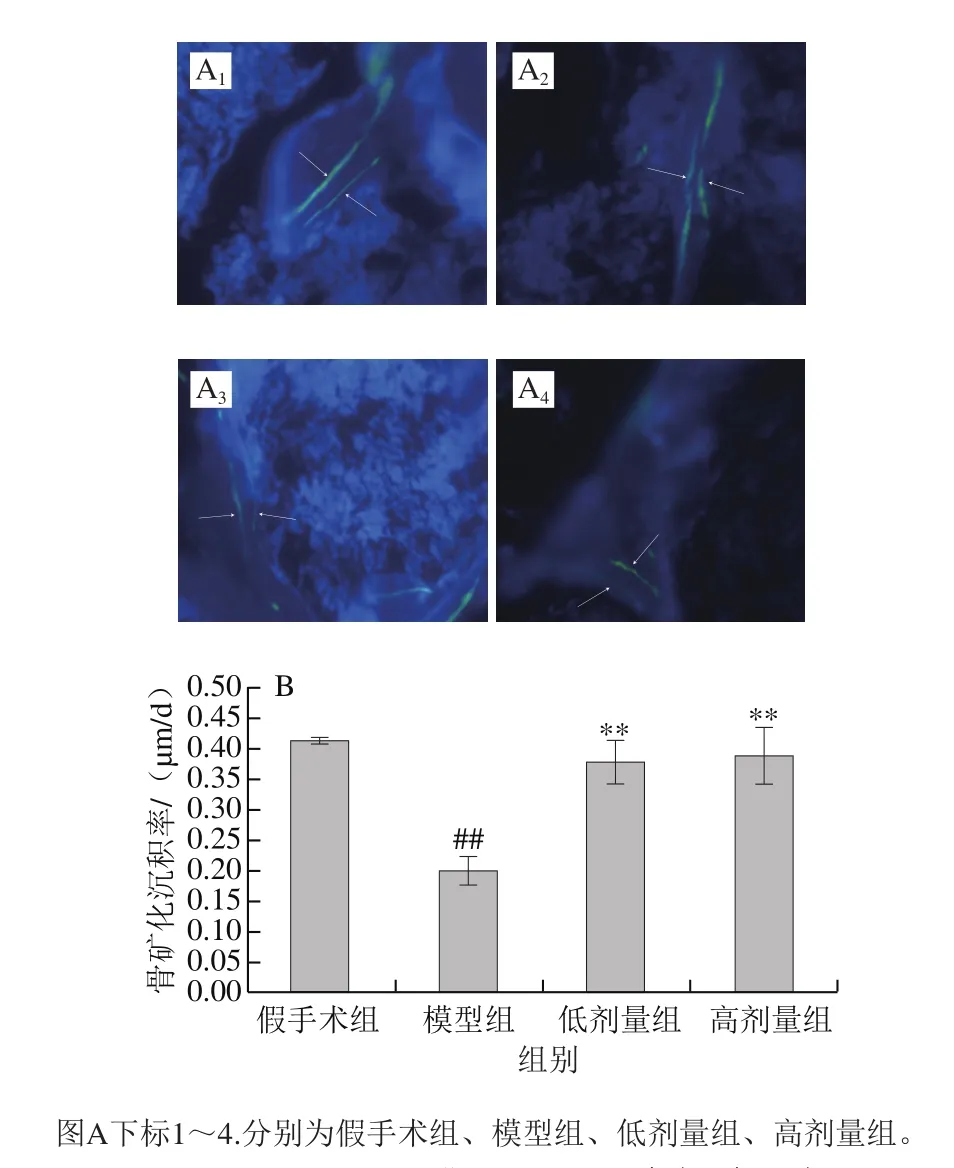
图 2 海参皂苷对去卵巢小鼠骨矿化(A)(20×)和骨矿化沉积率(B)的影响(n= 3)Fig. 2 Effect of SCS on the bone mineralization (A) (20 ×) and MAR (B) in ovariectomized mice (n = 3)
如图2所示,模型组小鼠由于骨质疏松的发生骨矿化沉积水平降低,海参皂苷干预后,去卵巢小鼠骨矿化能力得到了一定的恢复。骨矿化沉积率结果也表明,去卵巢小鼠矿化沉积率较假手术组明显降低,低、高剂量海参皂苷组小鼠骨矿化沉积率较模型组小鼠显著升高,分别升高了91.41%和94.59%。
2.4 海参皂苷调节去卵巢小鼠ALP、OCN、COL1a、BMP2基因表达水平
骨生成代偿性增加引起的骨生成紊乱,是绝经后骨质疏松症区别于其他类型的主要特点。骨生成的功能细胞——成骨细胞能够分泌多种细胞因子和酶类促进骨基质的合成,其中ALP、OCN、COL1a和BMP2是敏感的骨生成标志指标基因。前期实验中发现,低、高剂量海参皂苷对骨质疏松的改善作用差别不明显,故后续实验中提取了低剂量海参皂苷组小鼠胫骨的RNA,从mRNA水平探究海参皂苷对骨生成的作用。
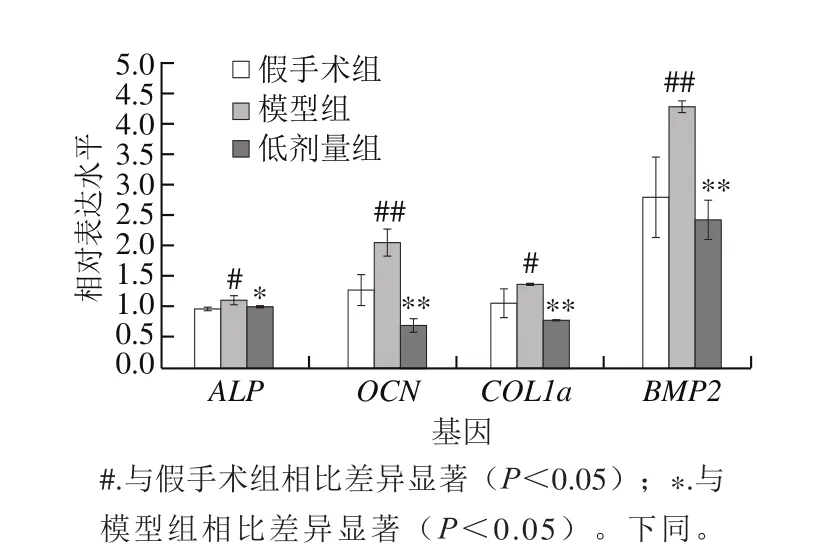
图 3 海参皂苷对成骨表观指标相关基因mRNA表达的影响(n= 10)Fig. 3 Effect of SCS on the relative mRNA expression of bone formation markers (n = 10)
由图3可知,与假手术组相比,模型组小鼠ALP、OCN、COL1a、BMP2的mRNA相对表达水平显著增加,分别上升了15.63%、60.94%、28.30%和52.69%,表现为高骨生成。海参皂苷的干预可以显著抑制代偿性增加的骨生成水平,与模型组相比,4 种指标的mRNA相对表达水平分别下降了10.81%、66.99%、43.38%和42.96%。结果提示,海参皂苷可以有效降低去卵巢小鼠骨生成特异性指标的mRNA相对表达水平,调控去卵巢小鼠高骨生成状态进而改善骨质疏松。
2.5 海参皂苷通过调节Wnt/β-catenin抑制高骨生成
Wnt信号不仅与骨骼发育有关,还与成骨细胞的增殖分化、生长凋亡、骨代谢等多个方面紧密相关,其中Wnt/β-catenin通路对骨生成有重要调节作用。
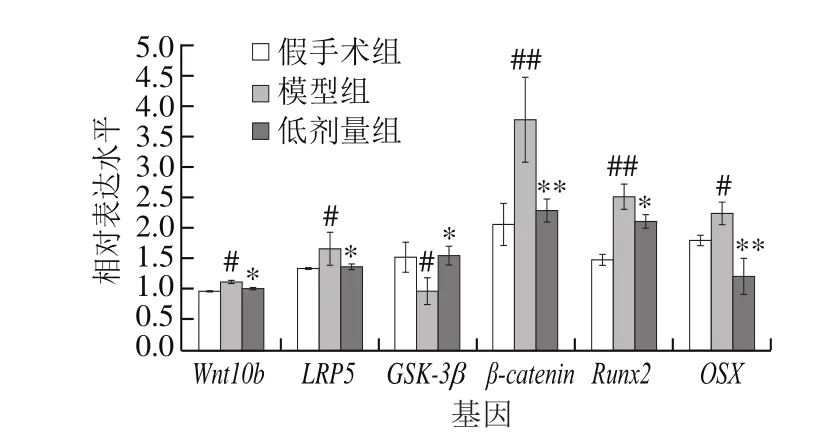
图 4 海参皂苷对Wnt/β-catenin通路关键基因mRNA表达的影响(n=10)Fig. 4 Effect of SCS on the relative mRNA expression of key genes involved in the Wnt/β-catenin signaling pathway (n=10)
Wnt信号的激活依赖于Wnt与其膜受体LRP5的结合。由图4可知,模型组小鼠Wnt10b和LRP5的mRNA表达水平较假手术组均明显增加(P<0.05),表现出高骨生成的特征。与模型组相比,海参皂苷组Wnt10b和LRP5的mRNA水平分别降低了9.82%(P<0.05)和18.45%(P<0.05),提示海参皂苷可以通过减少去卵巢小鼠骨组织中Wnt10b和LRP5的结合,抑制小鼠Wnt/β-catenin通路的激活。
细胞中糖原合成酶激酶3β(glycogen synthase kinase 3 beta,GSK-3β)能够与Axin、腺瘤性结肠息肉病蛋白(adenomatous polyposis coli,APC)形成复合体,能使β-catenin磷酸化后被进一步降解,抑制β-catenin入核。如图4所示,与假手术组比较,模型组小鼠GSK-3β的mRNA表达水平降低了36.84%(P<0.05),而β-catenin mRNA表达水平则升高了82.21%(P<0.01),表明模型组小鼠稳定的β-catenin增多,骨生成作用提高。海参皂苷干预后,GSK-3β的mRNA表达水平上调了60.42%(P<0.05),同时β-catenin的mRNA表达水平降低了39.58%(P<0.01),提示海参皂苷能够上调GSK-3β来抑制β-catenin积累从而抑制β-catenin入核启动核转录因子,抑制高骨生成,改善去卵巢小鼠骨质疏松。
Runt相关转录因子2(Runt-related transcription factor 2,Runx2)和成骨细胞特异性转录因子(osterix,OSX)是调控成骨细胞成熟的重要因素,受核β-catenin调控。由图4可知,模型组小鼠胫骨中的Runx2和OSX的mRNA表达水平较假手术组分别增加了68%(P<0.01)和24.31%(P<0.05),而海参皂苷能够显著下调Runx2和OSX的mRNA表达水平,表明海参皂苷能够通过下调骨生成的核转录因子来抑制去卵巢小鼠成骨细胞分化成熟,进而抑制高骨生成。
3 讨 论
本实验采用双侧去卵巢术建立小鼠绝经后骨质疏松症模型,研究海参皂苷对去卵巢小鼠骨密度的影响与作用机制。结果表明:海参皂苷能够降低尿钙、尿磷浓度,减少骨矿流失,增强骨密度和骨矿化沉积,表现出改善骨质疏松症的作用;海参皂苷能够下调Wnt/β-catenin通路,降低ALP、OCN、COL1a、BMP2的mRNA表达水平,抑制高骨生成,可能是通过抑制骨吸收,从而缓解了骨生成的代偿性升高改善骨质疏松。
人体成熟骨组织一直处于骨吸收与骨生成维持动态平衡的新陈代谢过程[16-17]。当骨吸收作用大于骨生成作用时,骨重构动态平衡被打破,导致骨量丢失,进而引起骨密度减小,骨强度降低,最终造成骨质疏松的发生[18]。卵巢衰退、雌激素减少的绝经后妇女骨吸收加快,尽管骨生成代偿性升高,但不能弥补更快的骨吸收过程,最终导致了高转换型的绝经后骨质疏松。
骨基质的解离包括两个方面:矿化羟磷灰石的溶解和骨有机成分的降解[19]。其中正常矿化的羟磷灰石被溶解为钙磷进入血液,流经肾脏后以尿液的形式排出体外[20]。王姗姗等[20]研究发现,雌性大鼠摘除双侧卵巢后,尿钙、尿磷浓度显著升高。本实验中,去卵巢小鼠尿液中钙、磷浓度显著增加,表明模型组小鼠体内溶骨活性增强,羟磷灰石分解加快,海参皂苷的干预显著抑制了骨矿物质的溶解,有效调节了体内的骨矿流失情况。
骨矿物质流失使得骨矿含量逐渐降低,最终导致骨密度降低,这也是骨质疏松发病的重要表现。骨密度是诊断骨质疏松症、评价骨强度的重要依据[21-22]。Huang Qiang等[23]研究发现,人参皂苷Rb2能够增加去卵巢大鼠的骨密度;He Long等[24]的研究证明,人参皂苷Rh2能改善RANKL诱导的骨丢失,提高骨密度。实验中对骨密度检测发现,海参皂苷的干预有效提高了去卵巢小鼠股骨骨密度,提示海参皂苷能够改善去卵巢小鼠骨质疏松。
骨密度的改善不仅有赖于抑制过度的骨矿流失,也需要增强骨矿化沉积。骨矿化沉积率属骨计量学的动态参数,是基于荧光物质能够与钙结合进而参与骨矿化过程的特点,通过活体荧光双标的方法反映骨矿化沉积能力等[25-26]。在本实验中,通过荧光标记切片和骨矿化沉积率发现,骨质疏松发生时骨矿化能力随之降低,海参皂苷能够显著提高骨矿化沉积能力,改善去卵巢小鼠骨质疏松。
骨基质的合成、分泌与矿化均依赖于成骨细胞分泌的大量骨胶原、骨基质及多种重要的细胞因子和酶类[27]。成骨细胞合成的ALP是骨组织特有的碱性磷酸酶,能够提高无机盐含量增加骨矿化沉积,进而增加成骨[28]。骨组织中最多的非胶原类型蛋白质是骨钙蛋白(osteocalcin,OCN),能够反映骨转换活跃程度[28]。Col1a是骨的特征性胶原,是骨无机质矿化的基础[29]。BMP2是强骨生成刺激因子,能够促进间充质干细胞分化为成骨细胞[30]。通过基因表达水平的检测,发现海参皂苷能够显著降低去卵巢骨质疏松引起的成骨标志物mRNA表达的升高,有效抑制去卵巢小鼠代偿性增加的骨生成。
成骨细胞分泌碱性磷酸酶(alkaline phosphatase,ALP)、OCN等细胞因子和酶调节骨生成作用,而这些细胞因子和酶的合成则受到调控成骨细胞的各类信号通路的调节。前面的实验结果发现海参皂苷能够降低ALP、OCN等成骨指标mRNA表达水平,因此,接下来可以对调控ALP、OCN等表达的成骨信号通路关键基因进行检测,探究海参皂苷提高骨密度的机制。Wnt/β-catenin通路对成骨细胞增殖分化有重要影响[31],成为治疗骨骼疾病的一个有效靶点,该途径中任何一个因子均影响成骨细胞活性与功能[32]。Wnt信号的激活能使β-catenin稳定积累并转移至细胞核,使下游RUNX2和OSX等靶基因激活,提高成骨细胞增殖分化诱导骨生成[32-33]。Wang Fei等[34]研究发现,去卵巢模型大鼠Wnt/β-catenin通路关键基因表达上调,成骨细胞骨形成活性增强。在本实验中,海参皂苷的干预显著下调了Wnt10b与LRP5的mRNA表达,进而抑制Wnt信号激活,通过促进GSK-3β的表达下调β-catenin,进而抑制下游RUNX2和OSX基因的表达,降低去卵巢小鼠过度活跃的骨生成。

