梅毒螺旋体膜蛋白Tp0971激活MAPKs和NF-κB诱导巨噬细胞分泌TNF-α和IL-1β①
张跃军 蒋传好 肖鹏程 刘佳强 彭俊 吴移谋
(株洲市中心医院临床检验中心,株洲 412007)
梅毒螺旋体(Treponema pallidum,Tp)是导致人类梅毒的病原微生物,其危害极大,不仅可以引起梅毒,而且是增加艾滋病风险的重要病原体,因此研究Tp的致病机制,有利于提高对该病的防控水平。Tp难以体外培养,因此目前对其致病机制的了解有限。随着Tp全基因组测序的发展,Tp的主要致病物质如外膜蛋白、鞭毛蛋白、透明质酸酶的作用逐步受到重视。研究表明,Tp感染后的炎症反应是导致固有免疫系统异常的主要因素[1]。Tp0917是本课题组前期克隆表达出的一种膜蛋白,前期研究表明,Tp0971具有较好的免疫原性[2],同时也能激活TLR信号转导通路而诱导促炎细胞因子的分泌[3],但其是否还具有其他的致炎机制目前仍不明确。因此本研究旨在进一步探讨Tp0971所激活的信号通路,并探讨其在TNF-α和IL-1β分泌中的作用。
1 材料与方法
1.1材料 Tp0971重组蛋白由本课题组构建并纯化[3];Detoxi-GelTM内毒素去除胶为Thermo产品;RPMI1640培养基购自Invitrogen; TNF-α和IL-1β ELISA检测试剂盒购自深圳欣博盛生物科技有限公司; 磷酸化ERK1/2、JNK1/2和p38抗体购自Cell Signaling;NF-κB p65多克隆抗体购自Santa Cruz;U0126、SP600125和SB203580购自Merk。
1.2方法
1.2.1细胞培养与刺激 人单核细胞系THP-1首先用含10%胎牛血清的RPMI1640培养基培养,实验前24 h更换为无血清培养基,随后加入终浓度为160 nmol/L的PMA使其诱导分化为巨噬细胞。根据不同的实验目的,细胞加入已去除内毒素的Tp0971重组蛋白刺激不同时间后用于下一步研究。
1.2.2ELISA检测TNF-α和IL-1β分泌 获取Tp0971刺激结束后的巨噬细胞上清,4℃低速离心5 min 后,取100 μl待测样品至预包被有TNF-α或IL-1β的酶标孔中,37℃孵育2 h。结束后加入一抗工作液,37℃下继续避光孵育90 min。随后充分洗涤以去除残留一抗,并加入生物素标记二抗工作液继续孵育30 min,最后依次加入显色剂和终止液。置于酶标仪下获取其吸光值,并根据试剂盒提供的方法绘制标准曲线,计算出上清液中TNF-α或IL-1β的浓度。
1.2.3实时定量PCR检测TNF-α和IL-1β mRNA的表达 采用Qiagen公司提供的RNA提取试剂盒提取细胞总RNA。随后将其逆转录为cDNA后,采用实时定量PCR分析TNF-α和IL-1β mRNA的表达。本文所用的引物如下:TNF-α:forward 5′-TGG TGG TCT TGT TGC TTA AAG TTC-3′,reverse 5′-CGA ACA TCC AAC CTT CCC AAA C-3′;IL-1β:forward 5′-CGG CCA CAT TTG GTT CTA AGA-3′,reverse 5′-AGG GAA GCG GTT GCT CAT C-3′;GAPDH:forward 5′-CCACTCCTCCACCTTTGAC-3′,reverse 5′-ACCCTGTTGCTGTAGCCA-3′。反应于LightCycle 96上进行扩增,结果用2-ΔΔCt表示。
1.2.4Western blot检测 巨噬细胞处理结束后,弃培养上清并用无菌PBS漂洗1次。加入胰酶消化使细胞从培养板中脱落,无菌PBS漂洗2次后,加入100 μl 含蛋白酶和磷酸酶的SDS上样缓冲液裂解细胞,并采用Bradford法测定细胞总蛋白的浓度。随后取20 μl总蛋白用于SDS-PAGE,电泳结束后采用半干转印法将其转印至PVDF膜上,经过封闭、孵育抗体后,采用ECL法发光、显影。

2 结果
2.1不同浓度Tp0971蛋白诱导巨噬细胞分泌TNF-α和IL-1β 阴性对照组TNF-α和IL-1β分泌水平很低。采用0.1、1.0和10.0 μg/ml Tp0971刺激24 h后,细胞上清中TNF-α和IL-1β水平显著增高(图1A)。为排除Tp0971蛋白在表达与纯化过程中潜在的内毒素污染,Tp0971使用100 μg/ml多黏菌素B预处理4 h,随后ELISA检测TNF-α和IL-1β的分泌水平,结果显示多黏菌素B处理对细胞因子的分泌无影响(图1B)。
2.2Tp0971诱导巨噬细胞分泌TNF-α和IL-1β依赖持续的转录与翻译 实时定量PCR结果显示,巨噬细胞未刺激时,TNF-α和IL-1β mRNA表达水平极低。而不同浓度Tp0971刺激后,随着浓度的递增,mRNA水平逐渐增高。当给予10 μg/ml转录抑制剂放线菌素D(ActD)预处理细胞后,TNF-α和IL-1β mRNA表达水平明显受到抑制(图2A)。同时,给予翻译抑制剂放线菌酮(CHX)处理后,TNF-α和IL-1β的分泌明显降低(图2B)。

图1 Tp0971蛋白诱导巨噬细胞分泌TNF-α和IL-1βFig.1 Tp0971 induces macrophages to secrete TNF-α and IL-1β

图2 转录与翻译抑制剂对Tp0971诱导巨噬细胞分泌TNF-α和IL-1β的影响Fig.2 Effects of transcription and translation inhibitors on Tp0971 induced TNF-α and IL-1β secretion in macrophages

图3 Tp0971经ERK1/2、JNK1/2和p38诱导TNF-α和IL-1β分泌Fig.3 Tp0971 induces secretion of TNF-α and IL-1β by ERK1/2,JNK1/2 and p38
2.3Tp0971经ERK1/2、JNK1/2和p38诱导TNF-α和IL-1β分泌 10 μg/ml Tp0971刺激巨噬细胞30 min后即可诱导ERK1/2、JNK1/2和p38磷酸化,60 min后达到峰值。而细胞内总ERK1/2、JNK1/2和p38无明显变化(图3A)。为了证实ERK1/2、JNK1/2和p38在介导TNF-α和IL-1β分泌中的作用,本研究采用30 μmol/L ERK1/2、JNK1/2和p38抑制剂U0126、SP600125和SB203580预处理细胞30 min,结果显示TNF-α和IL-1β分泌明显减少(图3B)。
2.4Tp0971激活NF-κB诱导TNF-α和IL-1β分泌 Tp0971处理后提取细胞核蛋白用于Western blot分析。结果显示,10 μg/ml Tp0971处理60 min后,细胞核中p65亚基的表达水平显著增多。而细胞首先采用30 μmol/L ERK1/2、JNK1/2和p38抑制剂U0126、SP600125和SB203580预处理后,p65的含量明显减少(图4A)。采用10~25 μmol/L NF-κB抑制剂PDTC预处理细胞后,TNF-α和IL-1β的分泌显著减少(图4B)。
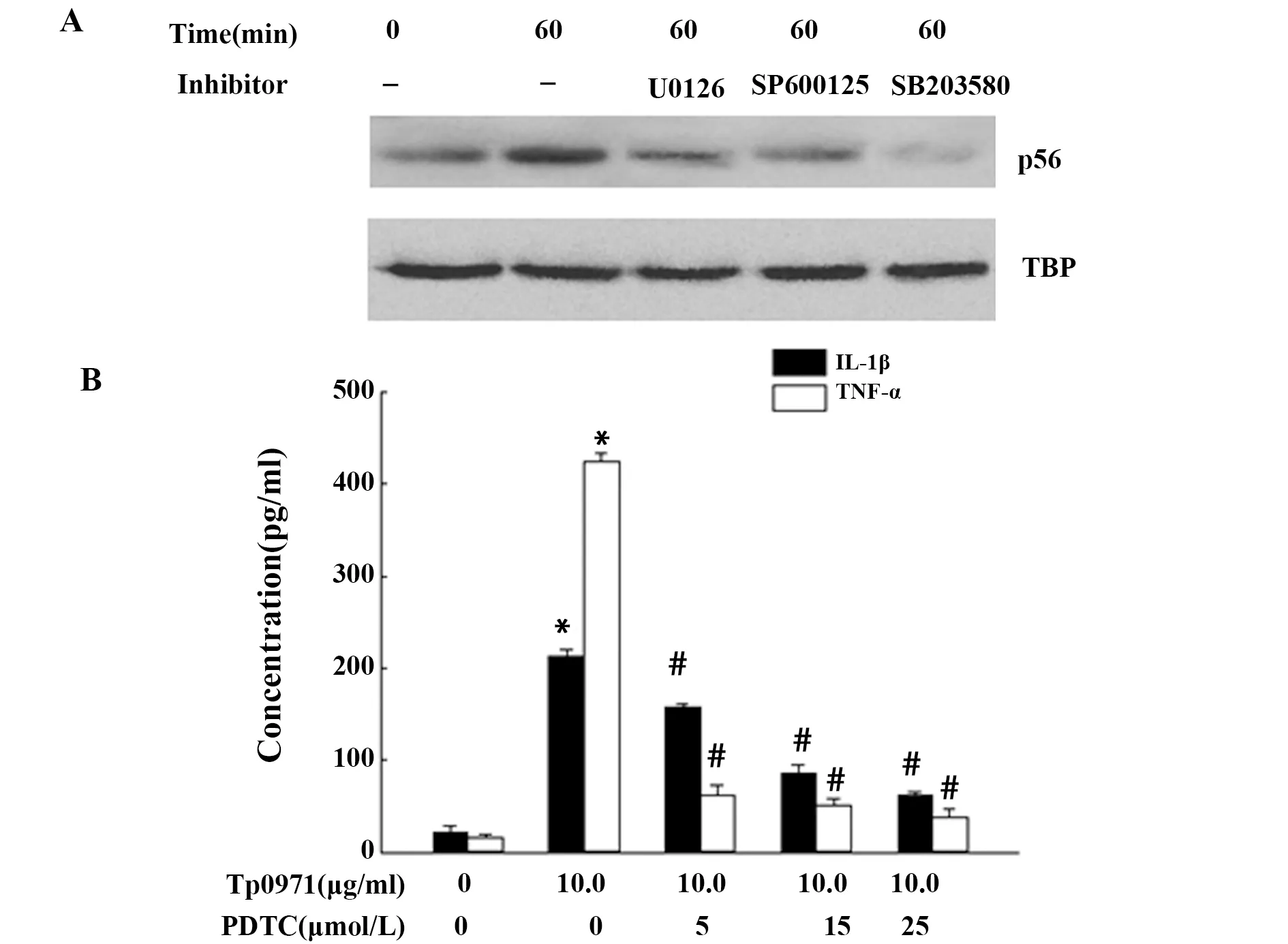
图4 Tp0971经NF-κB诱导TNF-α和IL-1β分泌Fig.4 Tp0971 induces TNF-α and IL-1β secretion by activation of NF-κB
3 讨论
Tp是迄今为止无法在体外培养的病原微生物,感染后其表面的膜蛋白对宿主的固有免疫系统具有很强的调控作用,因此被认为是Tp重要的毒力因子[4,5]。Tp0971是本课题组前期克隆表达的一种膜蛋白,主要位于细胞外膜[6,7],在前期研究中,我们发现对于Tp感染后,可在TLR2受体的介导下诱导促炎细胞因子IL-8、IL-6和IL-1β的分泌[3]。在本研究中,我们对其机制进行了进一步探讨。本研究发现,和课题组鉴定的其他脂蛋白一样,Tp0971也能诱导巨噬细胞分泌TNF-α和IL-1β,其分泌水平与Tp0971呈明显的剂量依赖性关系。为了在转录水平检测其表达,我们分别采用转录抑制剂放线菌素D(ActD)或翻译抑制剂放线菌酮(CHX)处理细胞,结果显示ActD和CHX处理后,均可显著下调细胞因子的分泌,这表明Tp0971诱导TNF-α和IL-1β的分泌依赖于持续的转录和翻译。TNF-α和IL-1β等促炎细胞因子的生物学功能具有多效性:一方面能在早期激活固有免疫系统从而发挥对Tp的清除作用,但另一方面TNF-α和IL-1β也可反馈性影响其他细胞因子的分泌。对于Tp感染后,产生的细胞因子众多,机体的炎症反应结局无疑最终取决于所有细胞因子和免疫细胞之间最终效应。
研究表明,MAPKs是TLR2信号通路中最重要的激酶,与炎症反应密切相关。本研究也发现,Tp0971刺激后,可明显促进JNK1/2、ERK1/2 和p38的磷酸化,其峰值位于60 min附近,这与LPS有所不同。其原因可能与其识别机制不同有关,因为机体TLR4受体在识别LPS时,往往伴有其他辅助受体如CD14、LBP等分子的参与[8]。而Tp0971是否也具有其他辅助受体的参与目前仍不明了。为了进一步明确MAPKs是否参与TNF-α和IL-1β的分泌,我们随后采用了3种MAPKs抑制剂处理细胞,结果显示这3 种抑制剂均可显著下调TNF-α和IL-1β的分泌,表明其受JNK1/2、ERK1/2 和p38的调控。MAPKs激活后,可以激活下游多种核转录因子如NF-κB、AP-1和Sp1,其中以NF-κB最重要。细胞在静息状态下,NF-κB主要位于细胞浆内。各种外源性因素如感染、氧化应激或凋亡刺激因素作用细胞后,可诱导NF-κB的p65亚基从细胞发生核转位,从而导致其激活而诱导靶基因转录[9]。本研究证实,Tp0971处理巨噬细胞60 min后,细胞核内p65表达水平明显增多,而采用JNK1/2、ERK1/2 和p38抑制剂处理后,p65核转位水平明显受到抑制,这表明NF-κB位于MAPKs的下游。我们随后用NF-κB特异抑制剂PDTC预处理巨噬细胞后,结果也发现TNF-α和IL-1β的分泌显著减少。以上结果表明Tp0971诱导TNF-α和IL-1β的分泌与MAPKs/NF-κB通路的激活有关。
综上所述,本研究证实了Tp0971膜蛋白能诱导巨噬细胞分泌TNF-α和IL-1β,这可能是Tp感染后炎症反应的机制之一。同时,Tp0971膜蛋白也能激活MAPKs和NF-κB,这些蛋白激酶与核转录因子可能参与了TNF-α和IL-1β的分泌。尽管如此,TLR2和MAPKs之间的其他信号通路或其他核转录因子在Tp0971蛋白诱导细胞因子产生中的作用还有待进一步明确。有研究显示,免疫系统的TLR4和TLR5也参与了识别Tp[10,11]。因此,对Tp致病相关分子的功能研究有利于进一步阐述Tp的致病机制并为疫苗开发奠定基础。

