VGX-1027抑制PM2.5介导的小鼠肺部炎症和气道高反应
徐蒙蒙,韩晓燕,李 锋,王沐昀,张 海,陈宇清,张妍蓓
(1. 安徽医科大学第一附属医院干部呼吸与危重症医学科,安徽 合肥 230022;2. 上海交通大学附属第一人民医院呼吸科,上海 200080;3. 上海交通大学附属胸科医院呼吸科,上海 200030)
随着工业化和城市化的迅速发展,空气污染日益加剧,细颗粒物(fine particulate matters, PM2.5)作为最主要的空气污染物,严重威胁着人类健康。流行病学调查表明,空气中PM2.5浓度的升高与咳嗽、哮喘、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等呼吸系统疾病的发病及症状加重密切相关[1]。PM2.5(空气动力学粒径<2.5 μm)极易随呼吸进入肺部,并沉积于远端小气道和肺泡,刺激肺泡上皮和肺部微循环,可诱导气道平滑肌收缩和肺部炎症。最近的研究证实,PM2.5的鼻腔滴入能够引起小鼠肺部炎症和气道高反应[2]。
VGX-1027[(S,R)-3-phenyl-4,5-dihydro-5-isoxasole acetic acid],分子量为205.21,化学式为C11H11NO3,其结构式见Fig 1[3]。VGX-1027是一种异恶唑化合物,不溶于水,易溶于乙醇和二甲基亚砜(dimethylsulfoxide,DMSO)。作为一种免疫调节剂,VGX-1027主要通过调控Toll样受体4(Toll-like receptor 4,TLR4)通路,发挥抗炎作用,同时也抑制TNF-α的产生[3]。最近的研究表明,VGX-1027通过抑制TLR4/NF-κB信号路径,抑制脂多糖引起的肾脏损伤[4]。而PM2.5在引起肺部炎症反应的同时,也伴随着TLR4/NF-κB路径的活化,同时释放大量的炎性因子(TNF-α、IL-1β、IL-6等)[5]。本研究旨在探究VGX-1027能否在PM2.5介导的肺部炎症和气道高反应性模型中发挥保护作用。
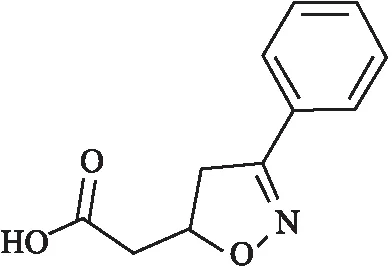
Fig 1 Structure of (S,R)-3-phenyl-4,5-dihydro-5-isoxasole acetic acid (VGX-1027)
1 材料与方法
1.1实验动物8~10周龄SPF级C57BL/6小鼠,体质量(22~25) g,购自上海西普尔-必凯实验动物有限公司,生产许可证号:SCXK(沪)2013-0016。饲养于上海交通大学附属第一人民医院动物中心的屏障系统,本研究得到上海交通大学附属第一人民医院伦理委员会的批准。实验前适应性喂养1周,正常饮食,循环光照。
1.2仪器与试剂小动物气体麻醉机(上海玉研仪器公司);气道高反应仪(Forced Maneuvers系统)(英国EMMS公司);Shandon Cytospin细胞离心机、酶标仪(美国Thermo Fisher公司);蛋白印迹自动成像仪(美国Bio-Rad公司)。异氟烷由上海玉研仪器公司提供;刘氏染液,购自珠海贝索生物技术有限公司;VGX-1027(批号:S7515),购自美国Selleck公司;TNF-α、小鼠CXCL1/KC、IL-1β ELISA试剂盒,均购自杭州联科生物技术有限公司;NLRP3(批号:15101S)、NF-κB(批号:3033S)、phospho-NF-κB(批号:8242S)、GAPDH(批号:5174S)抗体,均购自美国Cell Signaling公司;caspase-1抗体(批号:ab178515),购自英国Abcam公司。
1.3大气PM2.5采样及处理2017年10月~2018年4月,于上海市非工业区,使用崂应2030型中流量PM2.5采样器(青岛崂山应用技术研究所),采用玻璃纤维滤膜(青岛崂山应用技术研究所)采集大气PM2.5,将采集到颗粒物的滤膜置于去离子水中,使用超声波清洗器洗脱下来,然后冷冻真空干燥,收集PM2.5,-20 ℃干燥保存。使用前,称取一定量的PM2.5,用PBS缓冲液配制成PM2.5混悬液,超声震荡混匀,4 ℃保存。PM2.5具体成分见Tab 1。
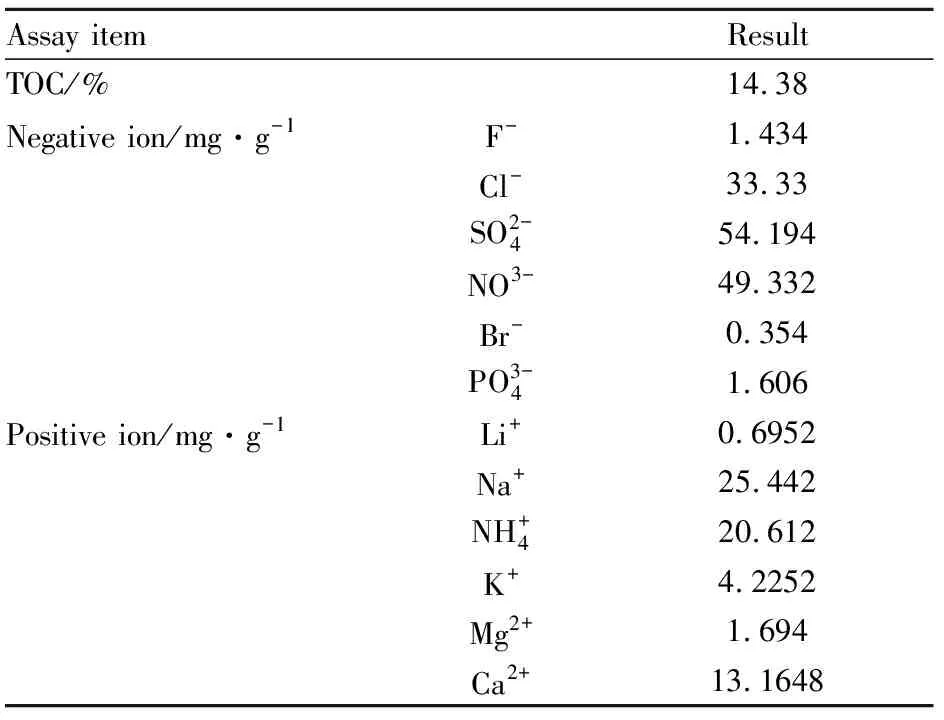
Tab 1 PM2.5 composition analysis
TOC: Total organic carbon.
1.4动物分组与处理48只C57BL/6小鼠随机分为对照(PBS)组、VGX-1027+PBS组、PM2.5组、低剂量VGX-1027(12.5 mg·kg-1)+PM2.5组、中剂量VGX-1027(25 mg·kg-1)+PM2.5组和高剂量VGX-1027(50 mg·kg-1)+PM2.5组,每组8只。PBS组、PM2.5组的小鼠置于气体麻醉机密封箱中,以异氟烷麻醉后,经鼻腔注入50 μL的PBS或者PM2.5混悬液,剂量为7.8 mg·kg-1[6]。VGX-1027+PBS组于鼻腔滴入PBS前1 h腹腔注射VGX-1027(50 mg·kg-1),VGX-1027+PM2.5组于鼻腔滴入PM2.5混悬液前1 h腹腔注射VGX-1027(12.5、25、50 mg·kg-1),每天1次,连续2 d。
1.5气道反应检测d 3腹腔注射0.15~0.2 mL的1%戊巴比妥钠后,小鼠气管切开,插入气管导管,置入体积描记箱(Forced Maneuvers系统),并连接电脑控制的呼吸机,给予一定浓度梯度(0、4、8、16、32、64、128、256 mg·L-1)的乙酰胆碱(acetylcholine,Ach)雾化吸入,检测小鼠的气道反应性。
1.6支气管肺泡灌洗液(bronchoalveolarlavagefluid,BALF) 腹腔注射0.4 mL的1%戊巴比妥钠处死小鼠。应用2 mL的PBS进行支气管肺泡灌洗,回收BALF,并离心,重悬细胞颗粒,计数后,在细胞离心机制片,采用刘氏染液染色。显微镜下计数至少500个细胞,并区分各类炎症细胞的比例。
1.7组织病理学分析左肺用4%福尔马林灌注、固定,石蜡包埋,厚4 μm切片,进行HE染色,评估支气管周围的肺部炎症积分。0=无炎症反应;1=轻度炎症反应,支气管壁、血管壁或肺泡间隔有少量炎症细胞;2=中度炎症反应,支气管壁、血管壁、肺泡间隔有成片炎症;3=重度炎症反应,支气管壁、血管壁、肺泡间隔有广泛的炎症。
1.8细胞因子检测使用ELISA试剂盒,按照说明书操作,检测BALF中炎性细胞因子TNF-α、KC、IL-1β水平。
1.9免疫印迹分析取一定量的小鼠肺组织,以蛋白裂解液研磨,制备10%的组织匀浆液,离心、取上清,蛋白定量、变性。总蛋白上样量为30 μg,经SDS-PAGE电泳后,转移到PVDF膜,5%脱脂牛奶封闭1 h后,分别用NLRP3、caspase-1、NF-κB、phospho-NF-κB一抗孵育过夜。用对应的 IgG二抗室温孵育1 h,洗膜后,以ECL发光液孵育,并置于自动成像仪进行化学发光检测。运用 Image J图像分析软件测定蛋白灰度值。
2 结果
2.1VGX-1027抑制PM2.5介导的气道高反应如Fig 2所示,与PBS组相比,PM2.5鼻腔滴入介导明显的气道高反应;与PBS组相比,VGX-1027预处理不影响PBS组的气道反应性。与PM2.5组相比,12.5 mg·kg-1的VGX-1027预处理组对PM2.5引起的气道高反应无影响;25、50 mg·kg-1的VGX-1027预处理组明显抑制PM2.5介导的气道高反应。
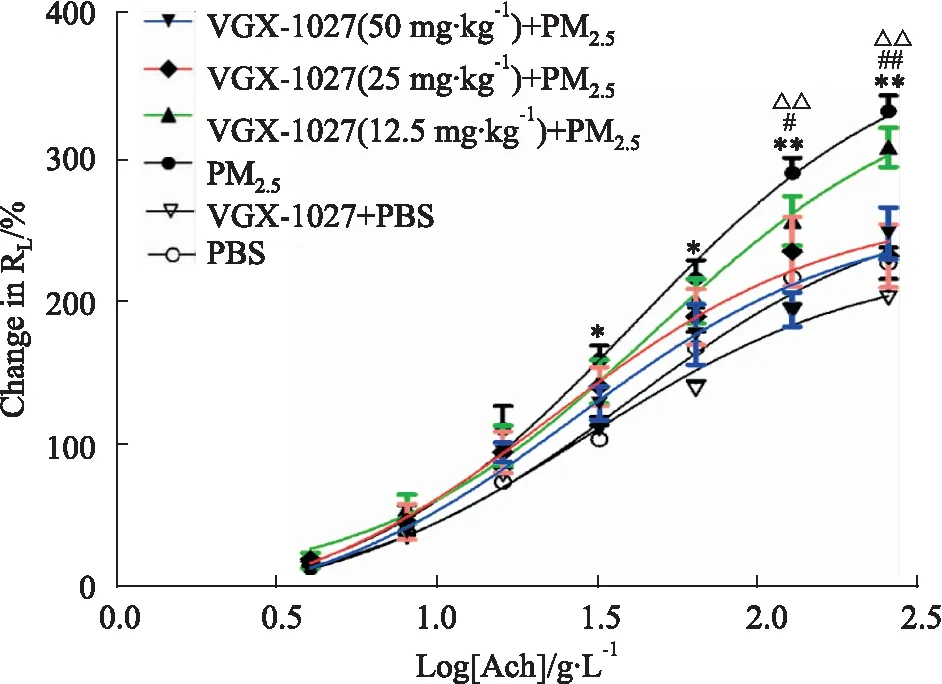
Fig 2 VGX-1027 prevented PM2.5-induced airway hyperresponsiveness n=8)
Mean percentage increase in lung resistance (RL) to increasing concentrations of acetylcholine (Ach).*P<0.05,**P<0.01vsPBS group;#P<0.05,##P<0.01vsVGX-1027(25 mg·kg-1)+PM2.5group;△P<0.05,△△P<0.01vsVGX-1027(50 mg·kg-1)+PM2.5group.
2.2VGX-1027减少PM2.5介导的BALF炎症细胞增加Tab 2结果显示,与PBS组相比,PM2.5组小鼠BALF中的细胞总数、巨噬细胞数、中性粒细胞数、嗜酸性粒细胞数及淋巴细胞数均增高。与PBS组相比,VGX-1027预处理不影响PBS组的BALF中细胞总数与炎症细胞分类。与PM2.5组相比,12.5 mg·kg-1VGX-1027处理后,BALF中炎症细胞数无明显变化;25、50 mg·kg-1的VGX-1027处理后,BALF中性粒细胞数、嗜酸性粒细胞数及淋巴细胞数均降低,差异有统计学意义。
2.3VGX-1027减轻PM2.5介导的肺部炎症肺组织HE染色结果表明,PM2.5组小鼠肺部炎症细胞浸润明显,肺部炎症积分高于PBS组小鼠。与PBS组相比,VGX-1027预处理不影响PBS组的肺部病理。与PM2.5组小鼠相比,12.5 mg·kg-1的VGX-1027预处理组肺部炎症浸润影响较弱;25、50 mg·kg-1的VGX-1027预处理组明显减弱PM2.5介导的肺部炎症浸润(Fig 3A),且肺部炎症积分明显下降(Fig 3B)。
Tab 2 Differential inflammatory cell counting in BALF (×106 n=8)
**P<0.01vsPBS;#P<0.05,##P<0.01vsPM2.5.
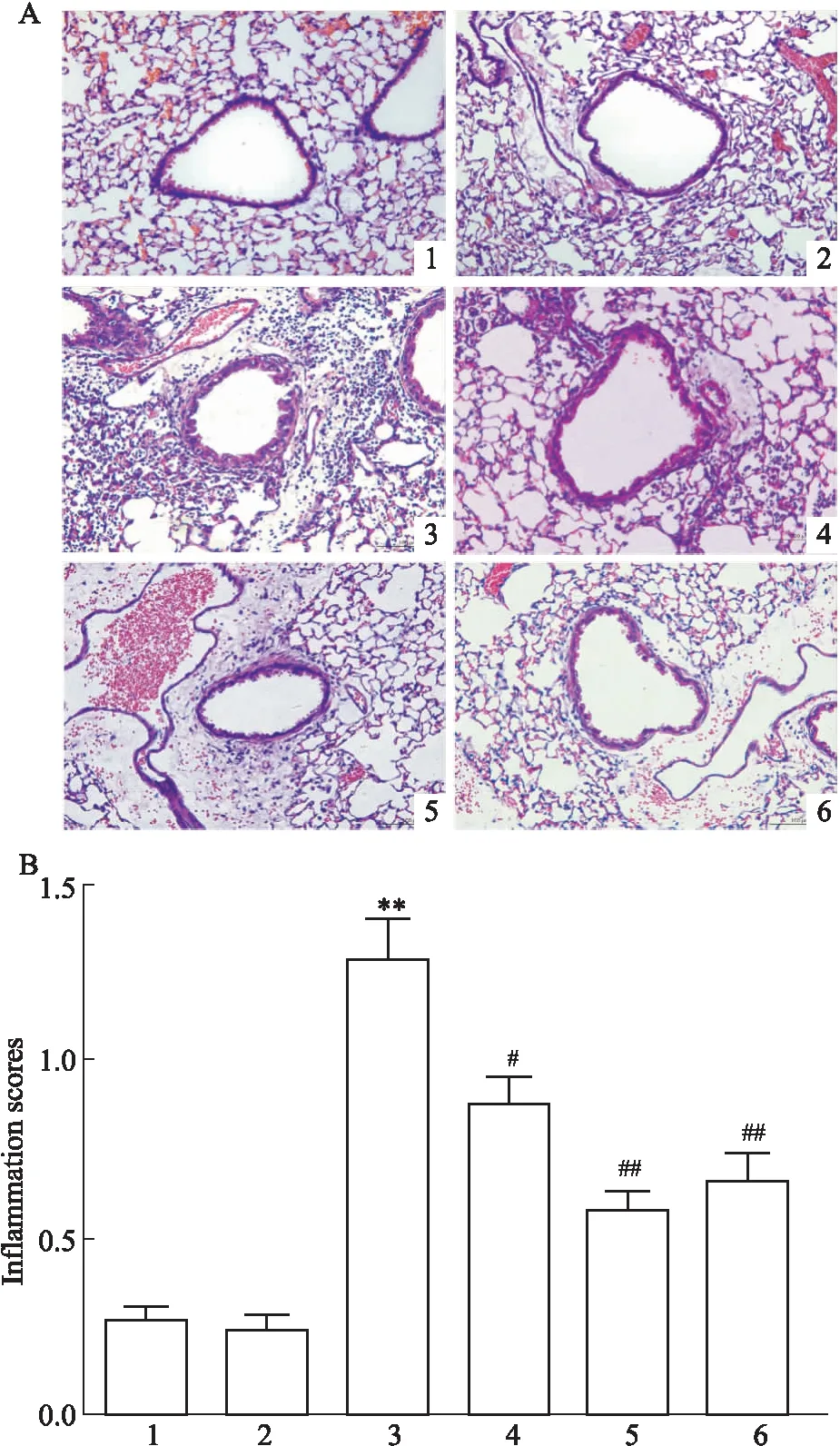
Fig 3 Lung pathological features of HE staining (A) and inflammation scores (B) n=8)
1: PBS; 2: VGX-1027+PBS; 3: PM2.5; 4: VGX-1027(12.5 mg·kg-1)+PM2.5; 5: VGX-1027(25 mg·kg-1)+PM2.5; 6: VGX-1027(50 mg·kg-1)+PM2.5.**P<0.01vsPBS group;#P<0.05,##P<0.01vsPM2.5group.
2.4VGX-1027降低PM2.5介导的炎性因子水平升高Tab 3的ELISA结果显示,PM2.5组小鼠BALF中的炎性因子TNF-α、KC、IL-1β水平明显升高。与PBS组相比,VGX-1027预处理不影响PBS组的BALF中的炎性因子水平。与PM2.5组相比,12.5 mg·kg-1的VGX-1027预处理组肺部炎症因子水平无明显影响;25、50 mg·kg-1的VGX-1027预处理组降低PM2.5介导的肺部炎性因子(TNF-α、KC、IL-1β)水平。
2.5VGX-1027抑制PM2.5介导的炎性转录因子NF-κB的磷酸化Fig 4的Western blot检测显示,与PBS组相比,PM2.5鼻腔滴入引起小鼠肺组织炎症转录因子NF-κB的磷酸化水平升高。与PBS组相比, VGX-1027预处理不影响PBS组的NF-κB的磷酸化水平。与PM2.5组相比,12.5 mg·kg-1的VGX-1027预处理对PM2.5介导的NF-κB的磷酸化水平增高无明显影响;25、50 mg·kg-1的VGX-1027预处理,抑制PM2.5介导的NF-κB的磷酸化水平增高。
2.6VGX-1027抑制PM2.5引起的NLRP3炎性小体的表达和caspase-1的活化Western blot检测显示(Fig 4),与PBS组相比,PM2.5组小鼠肺组织NLRP3炎性小体和凋亡蛋白酶caspase-1的表达增强;VGX-1027预处理不影响PBS组NLRP3和caspase-1的表达。与PM2.5组相比,12.5 mg·kg-1的VGX-1027预处理对PM2.5介导的NLRP3和caspase-1表达无明显影响;25、50 mg·kg-1的VGX-1027预处理,抑制PM2.5介导的NLRP3和caspase-1的表达。
3 讨论
TLR4通路在炎症过程中发挥重要的调控作用,主要被细菌内毒素脂多糖所活化,从而诱发严重的炎症反应。实验性研究表明,PM2.5暴露能够引起明显的气道高反应和肺部炎症,同时伴随着TLR4/NF-κB路径的活化[2, 5]。因此,通过对TLR4信号的干预,可能会缓解PM2.5引起的肺部炎症反应。本研究发现,在PM2.5介导的肺部炎症和气道高反应性模型中, VGX-1027(25、50 mg·kg-1)预处理抑制PM2.5介导的肺部炎症和气道高反应,同时抑制TLR4下游信号NF-κB的磷酸化,以及NLRP3炎性小体的表达与活化。
Tab 3 Levels of inflammatory factors in BALF (ng·L-1, n=8)
**P<0.01vsPBS;#P<0.05,##P<0.01vsPM2.5
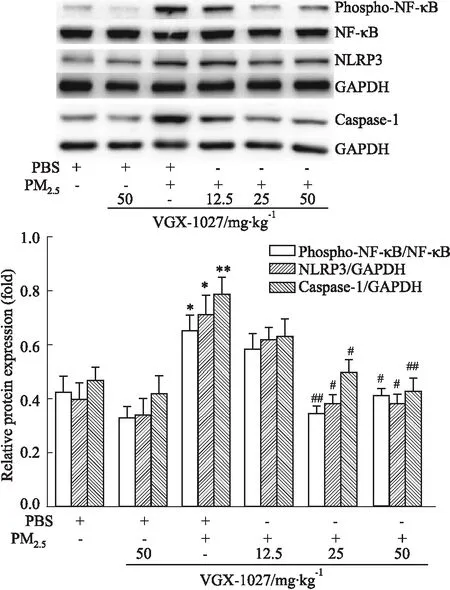
Fig 4 Effects of VGX-1027 on PM2.5-induced lung inflammation determined by Western blot n=8)
*P<0.05,**P<0.01vsPBS group;#P<0.05,##P<0.01vsPM2.5group
在本研究中,PM2.5的急性暴露引起了明显的气道高反应。气道高反应性是指气管或支气管对一系列药理的、化学的、生理的吸入刺激物,产生过分的收缩反应。气道高反应性是哮喘和COPD的重要特征。有研究表明,中性粒细胞在有机粉尘所引起的肺部炎症和气道高反应中具有重要的作用[6]。而TNF-α和KC在募集中性粒细胞的过程中发挥了重要作用[7],同时,TNF-α和IL-1β也可能增强气道平滑肌的收缩,促进气道高反应的发生[8]。TLR4信号的活化能够促进一系列炎性基因的表达,因此,VGX-1027抑制PM2.5引起的气道高反应的发生可能是通过阻断TLR4信号,抑制炎症基因的表达,从而减轻气道平滑肌的收缩反应。
吸入性PM2.5黏附于气道上皮后,可被识别为病原相关分子模式(pathogen-associated molecular patterns,PAMPs),进而活化TLRs等信号通路,如TLR4,引发一系列炎性细胞因子的释放,并募集众多的炎性白细胞入肺,引发急性肺部炎症和免疫紊乱[9-10]。本实验中,PM2.5的鼻腔滴入介导小鼠肺部炎细胞浸润,伴随巨噬细胞、中性粒细胞、嗜酸性粒细胞和淋巴细胞的计数增多。其中,巨噬细胞可以吞噬肺部侵入性颗粒物,并释放炎性因子TNF-α、IL-1β、IL-6 和粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF),招募单核细胞和中性粒细胞入肺[11]。同时,巨噬细胞膜表面TLR4信号活化,在髓样分化因子88(myeloid differentiation factor 88, MyD88)的辅助下,促进肿瘤坏死因子受体相关因子6(TNF receptor associated factor-6, TRAF6)的多聚泛素化,驱使炎性转录因子NF-κB的磷酸化,引起炎性基因的表达[12]。本研究发现, PM2.5可引起肺组织炎症转录因子NF-κB的磷酸化水平升高,同时伴有炎性因子(TNF-α、KC、IL-1β)水平明显升高。VGX-1027能够明显下调PM2.5诱导的NF-κB蛋白的磷酸化,降低TNF-α、KC和IL-1β的水平,减轻肺部炎症浸润。
此外,黏附于气道上皮的PM2.5被上皮细胞或巨噬细胞吞噬进入细胞后,导致溶酶体破裂、线粒体受损,进而活化NLRP3炎性小体,激活凋亡蛋白酶caspase-1,导致细胞出现炎症性死亡——细胞焦亡[13]。另一方面,活化的caspase-1能够切割IL-1β前体,促进其成熟体的释放,引起炎症反应[14-15]。本研究中,VGX-1027预处理抑制PM2.5介导的NLRP3炎性小体的表达增加及caspase-1的活化,同时下调IL-1β的表达。
总之,本研究发现,VGX-1027能够减轻PM2.5介导的肺部炎症和气道高反应。这种保护性作用可能是由于抑制TLR4/NF-κB信号路径和NLRP3炎性小体的活化,为VGX-1027作为新型肺部抗炎药物的开发与应用提供了实验证据。
(致谢:本实验在上海交通大学附属第一人民医院临床转化研究院呼吸科实验室完成。对所有参与本实验的研究人员致以诚挚的感谢!)

