低压均质处理对大豆分离蛋白溶解性及结构的影响
李 杨 李明达 张毅方 江连洲 王中江 滕 飞
(东北农业大学食品学院, 哈尔滨 150030)
0 引言
大豆分离蛋白(Soybean protein isolate, SPI)是指以低温大豆粕为原料、采用碱溶酸沉方法制取的一种蛋白质质量分数高达90%的大豆蛋白制品。为了改善大豆分离蛋白的功能特性,提高其生物利用率,同时除去某些有害物质,常通过物理改性、化学改性、酶改性等方式对大豆分离蛋白进行修饰。其中,高压均质处理是食品加工中应用最为普遍的一种物理改性方式,且其对大豆蛋白功能性质的影响已被广泛研究。高压均质处理过程中的空化、剪切、湍流和温度上升等同时作用,使蛋白分子之间的非共价键断裂,产生分子间或分子内的重聚集,破坏分子间的疏水作用和静电吸引作用,改变了蛋白质的结构和功能性质[1]。翟爱华等[2]研究了40 MPa下高压均质处理对大豆蛋白7S和11S乳化性和溶解性的影响,结果表明,处理后溶解性和乳化性均增大。杨盛楠等[3]研究发现,大豆分离蛋白经过0~55 MPa的均质处理,溶解性和乳化性也表现出增大的趋势,但对其相关性未做进一步研究。YANG等[4]研究发现,经过207 MPa压力处理的蚕豆蛋白,其溶解性明显改善,但乳化性却有所降低。YU等[5]研究发现,贻贝肌原纤维蛋白经过0~100 MPa均质压力处理后,乳化性和溶解性显著提高,二级结构和三级结构发生了明显变化。目前有很多学者对高压均质处理大豆分离蛋白的溶解性和乳化性进行研究,并发现其存在一定相关性,但没有关于低压均质处理(0~40 MPa)对大豆分离蛋白的溶解性和乳化性的相关性及其结构影响的报道。
实际生产中,由于受设备的限制,均质处理的压力一般不超过40 MPa。本文研究低压均质(0~40 MPa)对大豆分离蛋白溶解性及其结构的影响,并从蛋白质结构变化出发,探讨其作用机理。
1 材料与方法
1.1 材料与试剂
脱脂豆粕,哈高科大豆食品有限责任公司;一级大豆色拉油,九三集团哈尔滨惠康食品有限公司;氢氧化钠、盐酸等为国产分析纯试剂。
1.2 仪器与设备
FD-1C型冷冻干燥机, 北京德天佑科技发展有限公司;FJ-200型高速分散均质机, 上海标本模型厂;实验型高压均质机,英国Stansted Fluid Power公司; LGR20-W型台式高速冷冻离心机, 北京京立离心机有限公司;PALS型激光粒度分析仪, 美国布鲁克海文仪器公司;F-4500型荧光分光光度计, 日本HITACHI公司;Netzsch-DSC 204-F型差示扫描量热仪(Differential scanning calorimetry,DSC), 德国Netzsch公司。
1.3 方法
1.3.1SPI制备
称取1 600 g脱脂豆粕,分散在12 L去离子水中,用2 mol/L的NaOH调pH值至7.5,在55℃下搅拌1 h,离心(4 500 r/min,20 min)取上清液;在沉淀中加入9.6 L去离子水搅拌并重复上述离心操作,取上清液。将两次上清液合并,在水浴50℃下,调pH值至4.5,离心(3 000 r/min,10 min)取沉淀,即为蛋白凝乳,加少量水洗涤3次后调pH值至7.0,配成11%的SPI溶液,分为5份,分别在压力10、20、30、40 MPa下均质改性,与对照样品一起冷冻干燥,贮存。
1.3.2粒度测定
参照张媛等[6]的测定方法,采用激光粒度分析仪测定SPI的粒径分布。用50 mmol/L的磷酸盐缓冲液(pH值 7.0)将SPI样品稀释为1 mg/mL的蛋白溶液,于室温(20℃)条件下进行测量。
1.3.3溶解性测定
参照王辰等[7]的测定方法,称取100 mg SPI样品分散于10 mL去离子水中,磁力搅拌30 min,20℃、12 000g离心20 min。上清液经适度稀释,采用Lowry法测定蛋白质含量,以牛血清白蛋白为标准物绘制标准曲线。蛋白质的溶解度表示为上清液蛋白质量浓度占总蛋白质量浓度的百分比。
1.3.4乳化活性及乳化稳定性测定
参照TANG等[8]的方法,测定SPI的乳化活性指数(Emulsifying activity index,EAI)和乳化稳定指数(Emulsion stability index,ESI)。将处理后的SPI样品稀释到2 mg/mL,处理后SPI样品与大豆油以体积比3∶1混合,以10 000 r/min高速乳化1 min,迅速吸取底部乳液50 μL加入到5 mL 0.1%十二烷基硫酸钠(SDS)溶液中,在漩涡混合器上混合均匀。分别测定0 min和10 min吸光度,检测波长500 nm下的吸光度,计算公式为
(1)
(2)
式中EAI——乳化活性指数,m2/g
ESI——乳化稳定性指数,%
T——反应速率常数,取2.303
V——稀释倍数
A0——零时刻的吸光度
A10——静止10 min的吸光度
C——蛋白质量浓度,g/mL
Φ——乳化液中油的体积分数,%
1.3.5荧光光谱测定
参照唐传核等[9]的方法,低压均质的SPI内源性荧光光谱(色氨酸荧光光谱)采用F-4500型荧光分光光度计测定。将SPI样品用0.01 mol/L的磷酸盐缓冲液(pH值为7.0)配制成质量浓度为0.20 mg/mL的蛋白溶液。SPI内部的色氨酸基团为荧光探针分析荧光发射光谱,激发波长设定为290 nm,发射波长扫描范围为300~400 nm,激发狭缝宽度为5 nm,同样发射狭缝宽度也为5 nm。重复扫描3次。
1.3.6三维荧光光谱测定
参照ZHANG等[10]的方法,采用荧光光谱仪将不同低压均质处理条件下的SPI样品,用0.01 mol/L的磷酸盐缓冲液(pH值为7.0)配制成质量浓度为0.15 mg/mL的蛋白溶液。激发波长扫描范围为200~350 nm,发射波长扫描范围为200~500 nm,激发狭缝宽度为10 nm,同样发射狭缝宽度也为10 nm,重复扫描3次。
1.3.7DSC测定
参照王中江等[11]的方法,称取不同低压均质处理条件下SPI样品5 mg与10 μL的0.01 mol/L磷酸缓冲溶液(pH值为7.0)混合放入铝盒中,压盘密封,室温条件下放置8 h。将经过平衡处理的样品铝盒放入到DSC操作台左侧,空白铝盒放置在右侧。以10℃/min升温速率在20~110℃范围内扫描。将此过程中记录SPI的变性温度(TD)和变性焓变(ΔH)。重复测定3次取平均值以减少实验误差。
1.3.8统计分析
图表制作采用OriginPro 8.5软件,使用SPSS 19.0进行ANOVA差异显著性分析和方差分析(P<0.05为显著性差异)。每个实验重复3次,结果表示为平均值±标准差。
2 结果与分析
2.1 粒径分布
近年来,激光光散射技术广泛应用于高分子和胶体科学研究中,包括静态(经典)和动态两部分。本文应用动态光散射技术表征SPI在不同均质压力条件下的溶液行为。

图1 低压均质对大豆分离蛋白粒径分布的影响Fig.1 Effect of low pressure homogenization on particle size distribution of SPI
由图1可知,均质压力由0 MPa增大至30 MPa时,SPI溶液的粒径分布逐渐向小粒径方向移动,主要分布在50~1 000 μm之间。毕爽等[12]研究发现,大豆蛋白-磷脂酰胆碱复合体系经过高压均质机后在狭小的空间内被撞击,造成复合体系颗粒的解聚、破碎,所以粒径较小。而当均质压力达到40 MPa时,大豆分离蛋白的粒径分布则表现出向右平移的趋势,主要分布在100~1 000 μm之间。这可能是均质压力进一步增大时,大豆分离蛋白分子之间相互作用加强,促进了蛋白质聚集体的形成,从而使平均粒径有所提高。YU等[5]得出了相似的结果,贻贝肌原纤维蛋白的粒径分布宽度随着均质压力的增大而减小,但100 MPa下发现更宽的粒径分布,推测可能是形成了更大的聚集体。
2.2 溶解度
由图2可知,未经均质处理的样品溶解度为46.8%,随着均质压力的逐渐增大,溶解度逐渐增大, 30 MPa时,相对于未处理样品,溶解度提高了11个百分点,这主要是由于低压均质过程中,SPI受到剪切力和冲击力作用,粒径降低,比表面积增大,增大了蛋白与水的接触面积,水溶性得到提高。与文献[13-15]的结论一致,即粒径减小时,蛋白质分子的表面区域变大,分子活性基团暴露,其通过氢键与水相互作用从而提高了溶解度。姜梅等[16]的研究则认为高压均质使得大豆蛋白的紧密结构逐渐展开,使得球状蛋白质内部的极性基团和疏水基团暴露,蛋白质分子(颗粒)的表面电荷分布加强,围绕着新暴露的极性基团的结合水也增多,蛋白质的水化作用增强,进一步提高溶解性。

图2 低压均质对大豆分离蛋白溶解度的影响Fig.2 Effects of low pressure homogenization on solubility of SPI
而当均质压力为40 MPa时,SPI的溶解度有所降低,产生这种现象的原因可能是蛋白质分子在解折叠的过程中,更快速的剪切力和撞击作用使得展开的分子之间发生强的静电引力而产生部分聚集,从而降低了SPI在水中的溶解性[17]。
2.3 乳化活性及乳化稳定性
乳化性是指蛋白质导致油与水混合,形成乳化液,并使其保持稳定,包括乳化活性和乳化稳定性。由图3可知,SPI的乳化活性和乳化稳定性均随着均质压力的升高而呈先增大后降低的趋势。30 MPa时,SPI的乳化活性指数达到49.5 m2/g,比未处理样品提高了8.3 m2/g。这可能是由于随着均质压力增大,大分子蛋白受到的剪切作用增强,使得分子平均粒径降低,更多的极性基团吸附到油水界面,从而改善乳化活性和乳化稳定性。郭丽等[18]得出了相似的结论,即蛋白质分子经过均质处理后在水中进一步伸展,极性侧链基团的水合作用增强,亲水性提高,同时聚集在油-水界面,降低其表面张力,进一步提高乳化活性。文献[19-20]的研究也证实上述结论。而当压力继续增大到40 MPa时,乳化性反而降低,可能是由于均质压力的增大进一步降低了蛋白分子粒径,反而提高了分子间的静电引力,从而导致溶解性降低,乳化性也随之降低。LIU等[21]研究发现,高压均质对乳清蛋白的乳化活性和乳化稳定性具有负面影响,这可能与界面膜的粘弹性部分降低有关,也可能与可溶性超分子聚集体引起的絮凝效应有关。
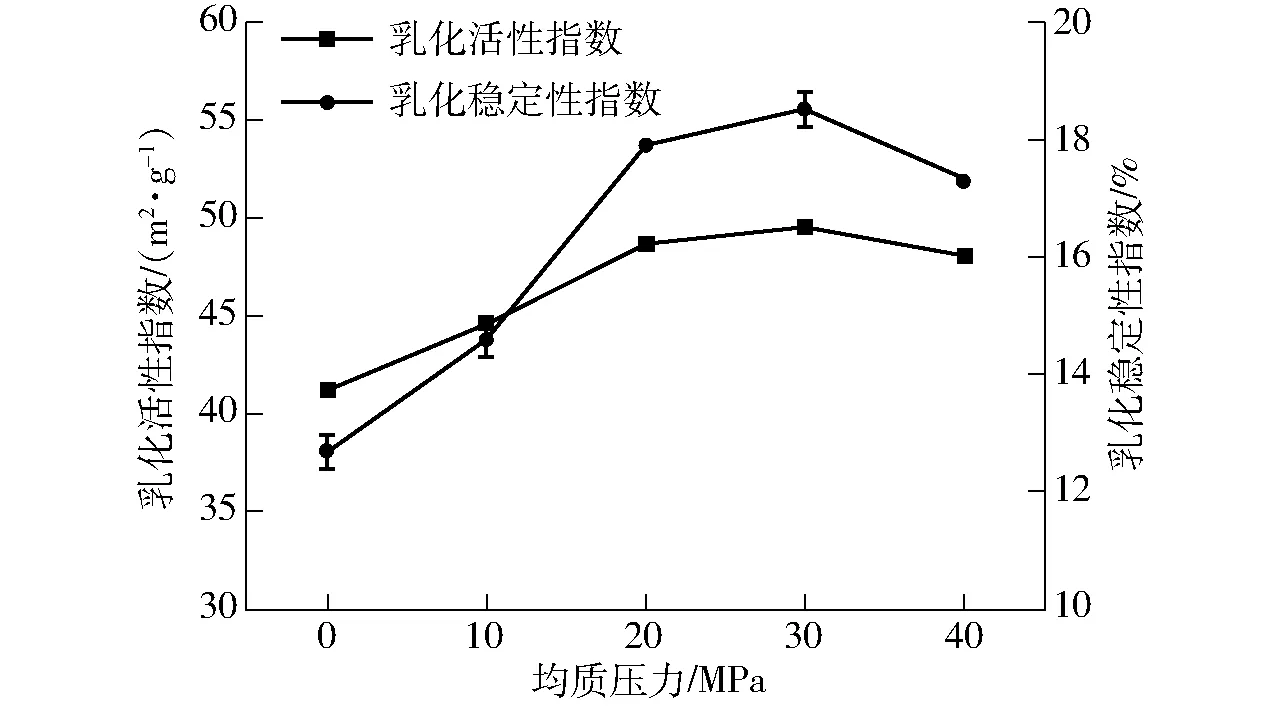
图3 低压均质对大豆分离蛋白乳化性的影响Fig.3 Effects of low pressure homogenization on emulsifying of SPI
2.4 蛋白溶解性和乳化性的相关性分析
由图4、5可知,随着溶解度的增加,乳化活性指数和乳化稳定性指数均呈递增趋势,具有良好的线性相关关系,其中,SPI的溶解度与乳化活性指数、乳化稳定性指数的线性拟合模型函数分别为y=0.788 8x+4.863 6、y=0.561 4x-13.373,相关系数分别为0.956 8、0.962 5。当均质压力为30 MPa 时,SPI的溶解性与乳化性达到最强,并且低压均质处理通过改变蛋白的溶解性,进而影响乳化性和乳化稳定性。
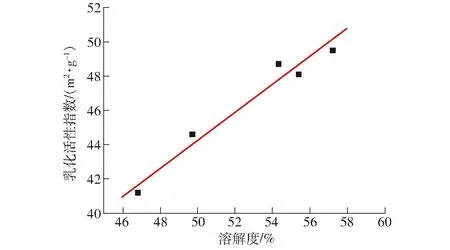
图4 大豆分离蛋白溶解性和乳化活性的关系Fig.4 Relationship between solubility and emulsification of SPI

图5 大豆分离蛋白溶解性和乳化稳定性的关系Fig.5 Relationship between solubility and emulsification stability of SPI
2.5 荧光光谱分析
荧光光谱是分析蛋白质三级局部结构的有效方法。本文采用290 nm作为激发波长,所得图谱主要是以色氨酸(Try)为发射基团的荧光光谱,表征色氨酸微环境极性的变化,是一种在三级结构水平反映蛋白质构象变化的比较灵敏的技术手段。
由图6可知,随着均质压力的增大,SPI的最大发射波长红移,荧光强度随着均质压力的增大而升高,当均质压力为30 MPa时,荧光强度达到最大。可能是SPI在低压均质作用下发生了部分结构解折叠,内部疏水性基团逐渐暴露,更多的Try残基暴露于蛋白质分子表面,荧光强度增大;王喜波等[22]研究表明,随着均质压力的增加,SPI 空间结构发生变化,Try残基暴露于蛋白质分子表面,蛋白质的疏水区域局部改变,发色基团如色氨酸残基所处环境由非极性向极性转化,这可能是高压均质处理导致SPI蛋白分子部分解折叠造成的,即随着柔性的增加,SPI 三级结构变得更加舒展。当均质压力为40 MPa时,最大发射波长发生蓝移,荧光强度有所降低,这可能与蛋白质在此状态下发生的亚基重聚集行为有关。YU等[5]研究了蚕豆蛋白随着压力的增加,发射峰的强度逐渐降低。最大发射波长蓝移,表明蚕豆蛋白的芳香族氨基酸残基从疏水环境转移到更亲水的环境中,与上述结果不同,可能是由于后者的均质压力更高,导致结构变化有所差异。

图6 不同均质压力下大豆分离蛋白荧光光谱Fig.6 Fluorescence spectra of SPI under different homogenization pressures
2.6 三维荧光光谱分析
三维荧光光谱是解析蛋白结构特征的重要方式之一。图7a~7e分别表示经过0~40 MPa均质处理的SPI的三维荧光谱。图中,峰a为瑞利一级散射峰,峰b为二级散射峰。经过均质处理后的SPI,光散射作用增强,荧光强度增大。图中峰1表示色氨酸和酪氨酸产生的特征峰[23],经过均质处理后,峰1的颜色变浅,颜色越浅表示荧光强度越低,表明SPI经过低压均质压力处理后,荧光强度显著降低,等高线变稀疏,可能是由于更多的酪氨酸和色氨酸残基包埋于蛋白的疏水区域中。峰2表示多肽链骨架结构产生的特征峰[24],随着均质压力升高,此区域面积减少,表示均质处理使得蛋白质多肽链的骨架伸展,蛋白结构发生变化;当均质压力达到40 MPa时,峰2所在区域的面积有所增大,侧面证明了蛋白聚集体的形成。
2.7 DSC分析
差示扫描量热法(DSC)是用于测量样品热力学特性的一种热分析技术,具有分辨能力强、灵敏度高、用料少等特点,被大量应用于蛋白质热变性研究领域。在DSC谱图中,通过最大峰对应的温度和峰面积可分别确定变性温度(TD)及焓变(ΔH)。变性温度代表蛋白质的热稳定性,而焓变则反映蛋白质分子的疏水性和/或亲水性,同时也反映蛋白质分子的聚集程度[25]。

图7 低压均质处理大豆分离蛋白的三维荧光光谱Fig.7 Three-dimensional fluorescence spectrum analysis diagrams of SPI treated by low pressure homogenization
如表1所示,不同均质条件处理后大豆蛋白的峰形相似,均有两个变性峰,即为SPI中两种主要的蛋白:β-伴球蛋白(7S)和球蛋白(11S)。未经处理的SPI的7S和11S的变性温度分别为76.87℃和96.18℃。与对照样品相比,经10~30 MPa均质处理后SPI的变性温度得到一定程度的降低,这表明均质处理改变了SPI的空间构象,但当均质压力继续升高至40 MPa时,7S和11S的变性温度均表现出上升趋势,FLOURY等[26]的研究表明,高压均质可使大豆蛋白的变性温度升高,加大了大分子结构的稳定性。文献[27-28]也表明高压均质可使天然蛋白质变性并产生紧密的内部结构以增强热稳定性。上述结论证明均质压力40 MPa下,部分解离的7S、11S组分重新结合形成更稳定聚集体。

表1 低压均质处理后大豆分离蛋白的DSC分析Tab.1 DSC analysis of SPI after low pressure homogeneous treatment
注:同一列中不同字母表示显著性差异(P<0.05)。
焓变可以评定蛋白质的变性程度,焓变越小,则表示其变性越大,相反,焓变越大,表明变性越小。ZHOU等[29]研究发现焓变的降低表明蛋白质中有序结构的减少,CHEN等[30]认为高压均质对蛋白内部和分子间疏水键有破坏作用,使其暴露于分子表面,因此蛋白结构中完全热解折叠所需的能量减少,从而焓变降低。由上述结论可得,均质压力为30 MPa时,焓变最小,说明SPI的变性程度较大,影响其内部结构,从而改善溶解性和乳化性。这与之前荧光光谱拟合的大豆蛋白三级结构的变化相吻合。
3 结束语
低压均质处理对SPI的粒径分布、溶解性、乳化活性、乳化稳定性、三级结构和热稳定性均产生了显著的影响,尤其是在30 MPa时,溶解性和乳化性均取得最大值。实验发现:SPI的溶解度与乳化活性指数、乳化稳定性指数具有正相关性,其线性拟合模型函数分别为y=0.788 8x+4.863 6、y=0.561 4x-13.373,相关系数分别为0.956 8、0.962 5。此时,蛋白质的三级结构展开,变性程度最大。荧光光谱结果表明,随着均质压力的增大,SPI结构展开,色氨酸基团暴露,荧光强度增大,40 MPa时,蛋白分子可能发生亚基聚集,疏水基团内卷,从而使荧光强度降低。DSC的结果表明,随着均质压力的增大,变性温度和焓变降低,SPI中的有序结构减少,表明蛋白质结构松散;当均质压力增大到40 MPa时,由于形成蛋白聚集体,提高了分子结构的稳定性,充分验证了荧光光谱拟合的大豆蛋白三级结构变化。

