不同温度对巨柏幼苗光合及生根的影响
辛福梅,王玉婷,李生茂,旦增罗布,普布次仁*
(1.西藏农牧学院资源与环境学院,西藏 林芝 860000;2.西藏自治区林木科学研究院,拉萨 850000)
植物都是生活在具有一定温度的外界环境中并受环境温度变化的影响。在适宜植物生长的温度范围内,温度升高,植物生长旺盛,生理生化反应加快,生长发育加速;温度下降,其生理生化反应变慢,生长发育迟缓。植物幼苗期在其生活史中处于相对重要的阶段,幼苗是否能适应环境、健康生长发育直接决定着该种群的各种功能特征和性状,并最终决定着群落的结构和物种组成[1-3]。温度对植物光合作用的影响是通过影响光合作用相关酶的活性来实现的,适宜的温度有利于植物光合速率达到最高值。发育良好的根系是林木壮苗的一个重要指标,而合适的苗期温度是形成良好根系的关键因素之一。
巨柏(Cupressus gigantea)又名雅鲁藏布江柏木,常绿乔木,仅分布于我国西藏雅鲁藏布江流域海拔3 000~3 400 m沿江漫滩和灰石露头阶地阳坡的中下部地区,由于受自然历史因素和现代人类活动的影响,巨柏个体数量日益减少,分布地域逐渐狭窄、孤立,处于濒危状态,为国家一级重点保护的濒危树种[4-6]。巨柏有较古老的地史,对研究柏科植物的系统发育和西藏植被的发生发展及其与环境的关系都具有重要意义。我国对巨柏的研究主要集中在濒危机制、群落结构、种群更新等方面[7-8],对巨柏光合作用的研究仅见对其大树进行的光合日进程探究[9],而对巨柏根系的研究则主要围绕大树根系结构及大苗根系生长展开[10-11]。为了解温度对巨柏幼苗在早期移植换床过程中生根及光合的影响,本研究通过盆栽控温试验,对一年生巨柏幼苗进行不同温度下的控制处理,从生长指标、光合特性及新生根生长等方面研究了在不同温度下巨柏幼苗的生长、光合生理差异,对巨柏幼苗的温度适应性进行了较为系统的研究和评价,旨在寻求巨柏幼苗生长的理想温度,探讨其对不同温度的适应机制和适应能力,为更好地培育巨柏优质壮苗奠定基础。
1 材料与方法
1.1 材料及处理
试验所用材料来自于西藏自治区林芝市米林县岗嘎林场。选择长势良好、形态特征基本一致的一年生巨柏实生苗,于2016年4月在西藏农牧学院林学实习苗圃进行盆栽培育,所用花盆直径为32 cm,高为28 cm,每盆3株。栽培基质为V(苗圃土)∶V(腐殖质)=3∶1,每盆装入过筛基质17 kg,定植缓苗2个月。2016年6月10日将盆栽苗木放置于人工气候培养箱内培养,箱内光照均为3 000 lx,湿度70%。共设置7.5、12.5、17.5、22.5和27.5 ℃ 5个温度梯度,在各温度梯度下分别放置3盆苗木。培育30 d后测定各处理下的幼苗光合作用指标,之后以全株收获法取样,备用[12]。
1.2 测定指标及方法
1.2.1 生长指标测定
对带回实验室的巨柏幼苗测定其株高、地径后,统计新生根数。之后将根系和地上部分离,在80℃条件下烘至恒量,统计其地上干物质量、地下干物质量及新生根干物质量。
1.2.2 光合指标测定
从5组不同温度处理的各重复中选择5株幼苗的功能叶片,用Li-6400XT便携式光合系统测定仪测定其净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)及胞间CO2浓度(Ci)。由于巨柏叶片不能充满叶室,在光合测定完成后,用Microtek Phantom 3500扫描仪扫描各处理叶片,通过UTHSCSA图像分析系统确定叶面积,之后重新换算净光合速率、蒸腾速率、气孔导度和胞间CO2浓度。
1.2.3 新生根指标测定
每个处理选择5株幼苗,分别采集新生根,清洗干净后,应用Epson perfection V700 photo根系扫描系统和WinRhizo根系图像分析系统对各单株新生根系进行长度、表面积和体积的测定分析。待全部根样扫描完成之后,将各单株根样置于80℃烘箱中烘至恒量,测定各单株根样的生物量。各单株比根长/(cm/g)=各单株根样的新生根长/各单株根样的生物量[13]。
1.3 数据分析
用Excel 2010软件完成全部数据处理和作图,用SPSS 10.0统计软件对各项指标进行单因素方差分析(one-wayANOVA)。
2 结果与分析
2.1 不同温度对巨柏幼苗生长的影响
表1显示,在不同温度处理下巨柏幼苗各生长指标间存在一定的差异。在7.5℃时,巨柏幼苗各生长指标均显著低于其他温度处理,在12.5、17.5、22.5℃时各生长指标表现较好。在27.5℃时幼苗生长指标略有降低,但仍显著优于7.5℃时。巨柏幼苗新生根数在各温度间差异显著,其中在17.5℃条件下新生根数最多,达到11.6,在12.5、22.5和27.5℃条件下新生根数差异不显著,分别为8.5、8.7和9.1,在7.5℃时幼苗新生根数最少,仅为4.0。各温度间新生根干质量差异也较大,在17.5℃时新生根干质量最大,而在7.5℃时最小,仅约为17.5℃时的1/10。幼苗高度、地上干质量、地下干质量在5个温度间的变化规律基本一致,各温度间存在一定的差异,其中在12.5、17.5和22.5℃时表现最好,其次为27.5℃,在7.5℃条件下表现最弱。幼苗地径在各温度处理下变化不显著,在7.5℃时最小,仅为1.96 mm,在其他温度下略有增加,但差异不显著,可能由于巨柏是慢生树种,短时期内难以看到地径的显著变化。
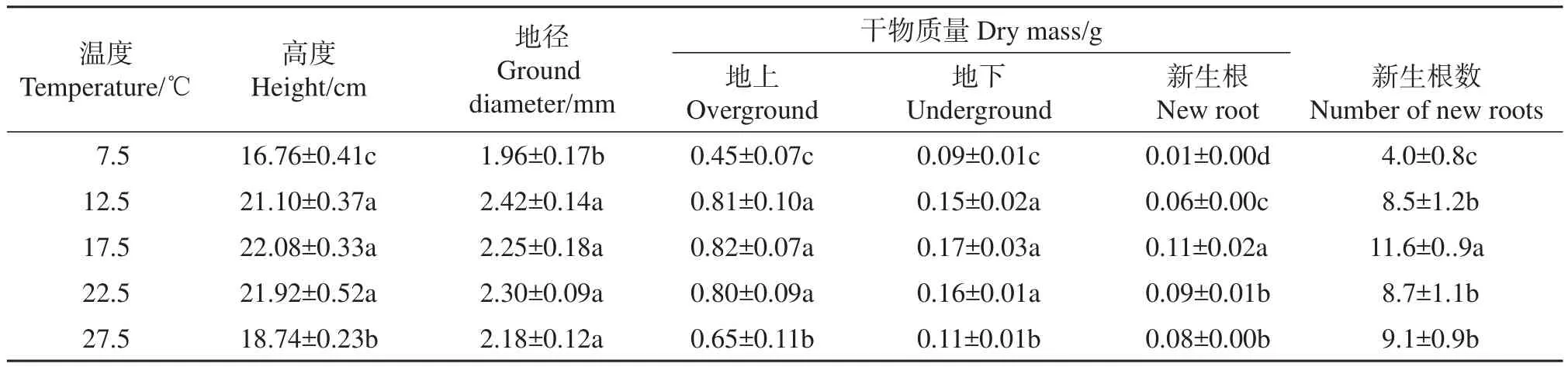
表1 在不同温度下巨柏幼苗生长的差异Table 1 Growth differences of C.gigantea seedlings under different temperatures
2.2 不同温度对巨柏幼苗光合作用的影响
从图1A可以看出,在不同温度下巨柏幼苗的净光合速率之间存在差异,随着温度的升高其净光合速率不断升高,当温度达到17.5℃时,其净光合速率达到最大值,为10.11µmol/(m2·s),之后随着温度的升高净光合速率下降,在7.5和27.5℃条件下巨柏幼苗的净光合速率均较低,仅约为17.5℃时的1/2。图1B显示,巨柏幼苗在不同温度下气孔导度差异显著:17.5℃时气孔导度达到最大值,显著高于其他温度;在22.5和27.5℃时气孔导度较17.5℃时有所下降,但二者之间差异不显著;在12.5和7.5℃条件下,幼苗的气孔导度急剧下降,约为17.5℃时的1/4,二者无显著差异。由图1C可以看出,幼苗胞间CO2浓度在各温度下差异显著:在7.5和27.5℃时胞间CO2浓度相对较高,而在17.5℃时幼苗胞间CO2浓度最小,为174.23 µmol/mol;在12.5和22.5 ℃时幼苗胞间CO2浓度处于中间水平。图1D表明,在不同温度下巨柏幼苗的蒸腾速率间存在差异,其中在17.5℃时蒸腾速率最大,达到1.433 mmol/(m2·s),其次为22.5和27.5℃,约为17.5℃时的1/2,在7.5和12.5℃条件下幼苗蒸腾速率急剧下降,约为17.5℃时的1/5。
2.3 不同温度对巨柏幼苗新生根的影响
2.3.1 新生根生物量的变化
图2表明,不同温度处理显著影响巨柏幼苗新生根生物量。在17.5℃时巨柏幼苗新生根生物量最高,达到0.013 2 g(P<0.05);在22.5 ℃时新生根生物量较最大值有所下降;在12.5和27.5℃时新生根生物量较17.5和22.5℃时显著下降,约为17.5℃时的1/2,但二者间差异不显著;在7.5℃时新生根生物量最小,仅为17.5℃时的21.2%。

图1 在不同温度下巨柏幼苗净光合速率(A)、气孔导度(B)、胞间CO2浓度(C)及蒸腾速率(D)的变化Fig.1 Net photosynthetic rate(A),stomatal conductance(B),intercellular CO2concentration(C)and transpiration rate(D)of C.gigantea seedlings under different temperatures
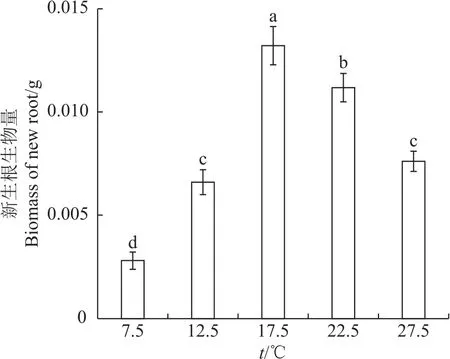
图2 在不同温度下巨柏幼苗新生根生物量的变化Fig.2 Changes of new root biomass of C.gigantea seedlings under different temperatures
2.3.2 新生根长度的变化
图3表明,巨柏幼苗新生根长度在不同温度处理下存在差异。在7.5℃时巨柏幼苗新生根长度最短,为18.29 cm;随着温度上升,新生根长度增加,在17.5℃达到最大值,为58.76 cm;在22.5℃处理下,新生根长度较最大值略有下降,但差异不显著;在27.5℃时新生根长度明显下降,约为最大值的70%。
2.3.3 新生根表面积的变化
从图4看出,随着温度的升高新生根表面积先增大后减小,在各温度处理下新生根表面积之间存在差异。在17.5和22.5℃时巨柏幼苗新生根表面积较大,且二者之间差异不显著;在27.5℃时新生根表面积有所下降,约为17.5℃时的87%;在7.5和12.5℃时新生根表面积继续呈下降趋势,且二者之间差异不显著;在7.5℃时新生根表面积最小,为10.86 cm2,是17.5℃时的75%。
2.3.4 新生根体积的变化
从图5可以看出:随温度升高巨柏幼苗新生根体积先增大,在17.5℃时其体积达到最大值(0.65cm3),之后温度再升高其体积呈减小趋势;在7.5℃低温时新生根体积最小,为0.28 cm3;在27.5℃时新生根体积达到0.47 cm3;在12.5和22.5℃时新生根体积差异不显著,约为17.5℃时的85%。
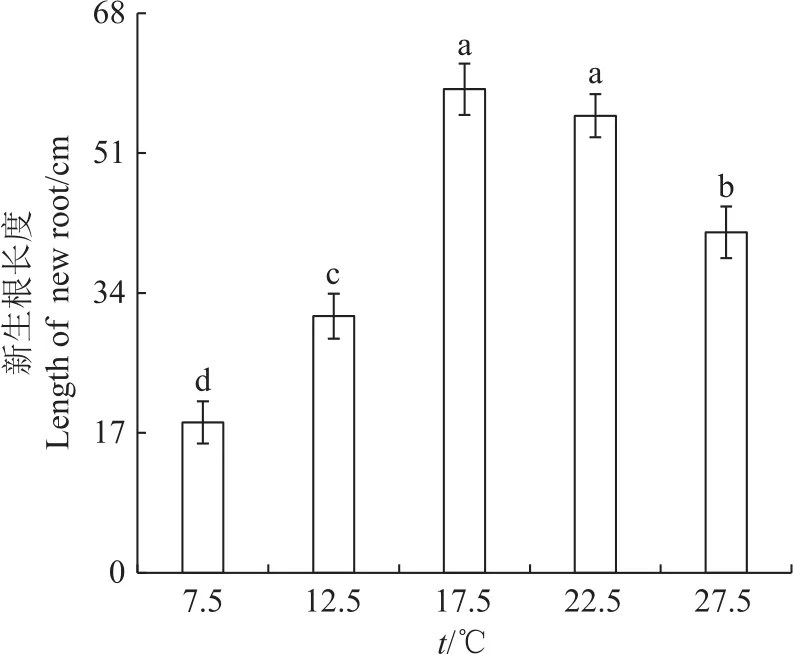
图3 在不同温度下巨柏幼苗新生根长度的变化Fig.3 Changes of new root length of C.gigantea seedlings under different temperatures

图4 在不同温度下巨柏幼苗新生根表面积的变化Fig.4 Changes of new root surface area of C.gigantea seedlings under different temperatures
2.3.5 新生根比根长的变化
从图6可以看出,在不同温度处理下巨柏幼苗比根长的变化趋势为两端高中间低,随着温度的升高其比根长不断减小。当温度达到17.5℃时其比根长达到最低值(45 cm/g),之后随着温度增加其比根长呈上升趋势;在7.5℃时巨柏幼苗新生根比根长最大,为65 cm/g,其次为27.5℃时的比根长,约为7.5℃时的83%;在12.5、17.5和22.5℃时新生根比根长之间差异不显著,为7.5℃时的70%左右。
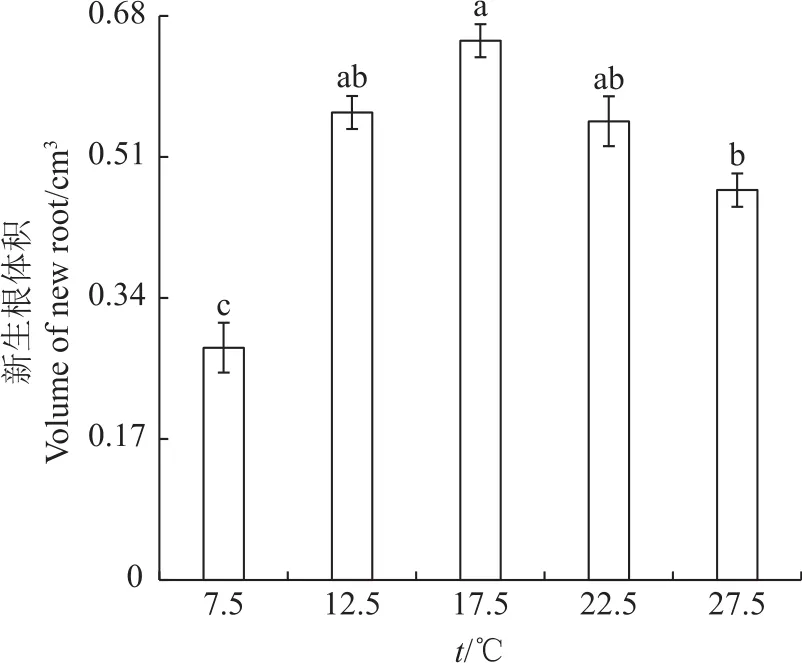
图5 在不同温度下巨柏幼苗新生根体积的变化Fig.5 Changes of new root volume of C.gigantea seedlings under different temperatures
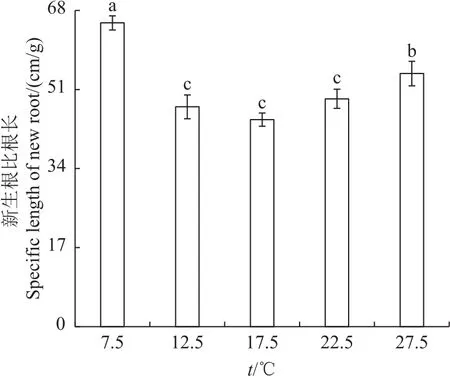
图6 在不同温度下巨柏幼苗新生根比根长的变化Fig.6 Changes of new root specific length of C.gigantea seedlings under different temperatures
3 讨论与结论
3.1 不同温度处理对巨柏幼苗光合作用的影响
光合作用是植物积累生物产量的基础,植物对环境胁迫响应的共同特征是叶片净光合速率降低[14]。温度作为重要的环境因子直接影响植物体内的酶活性,进而通过引起一系列代谢过程的变化来影响植物的生长发育,其中高等植物的光合作用受温度影响尤为显著,特别是幼苗在受到低温的损伤之后会使光合作用强度显著减弱[15]。在光合作用中一系列的酶促反应受温度的制约较大,在反应过程中无论哪种反应受阻或反应速率下降,都会使植物的光合速率降低[16]。前人研究也表明,过高和过低的生长温度都会对植物的生长发育及光合特性产生显著的影响[17-20]。巨柏幼苗在7.5和27.5℃时的净光合速率较低,这主要是由于在低温条件下部分气孔关闭,和光合作用有关的酶活性较低,而在高温条件下植物为了减小蒸腾作用也会关闭部分气孔,酶在高温下被钝化。酶活性降低及部分气孔关闭导致其净光合速率降低,植物体内水分的蒸腾损耗减少,蒸腾速率降低。当温度升高到17.5℃时,影响光合作用的酶活性相应增强,气孔开度增加,净光合速率、气孔导度及蒸腾速率均达到最大值,植物在光合作用中消耗的CO2增多,而气态的CO2在液相的胞间和胞内存在着扩散阻力,因此胞间CO2得不到迅速补足,浓度就会下降;反之,光合作用强度小,胞间CO2浓度增加。而气孔调节是植物对温度变化的重要反应,温度下降可降低气孔导度,进而减少水分散失速率和降低温度胁迫的危害性[21]。温度升高,气孔导度增加,有利于其体内水分的蒸腾散失,而较高的温度则会导致叶片气孔部分关闭及酶的钝化,从而引起光合速率的下降。
3.2 不同温度处理对巨柏幼苗新生根的影响
苗木移栽后,原有老根逐渐失去吸收功能,新生根取而代之成为水分及养分的主要吸收单元,因此,新生根系的重建对苗木成活至关重要。新生根生物量是移栽苗木对地下部分投入的反映,可以代表其对地下空间的占有和对地下资源的竞争。在本研究中,巨柏幼苗新生根生物量在不同温度间差异显著,在17.5℃时生物量最大,显著高于其他温度,之后依次为22.5℃>27.5℃>12.5℃>7.5℃,在7.5℃时仅约为17.5℃时的1/5。在适当范围内温度增加能促进植物体内的新陈代谢,从而加速植物生长,但在相对高的温度条件下植物体内酶被钝化,反而不利于植物的生长发育[22-23]。新生根长度、表面积、体积是反映根系功能的重要结构参数[24]。巨柏幼苗在17.5和22.5℃时新生根长度、表面积及体积较大,而在27.5、12.5和7.5℃时表现欠佳,说明适宜的生长温度可以促进巨柏幼苗根系的分枝,使得单位体积上细根数量增多、表面积增大,对增加根系吸收能力极为有利。新生根比根长是单位生物量新生根的总长度,比根长越大,说明用于构建和维持单位长度根系所需的碳水化合物越少,更多的能量用于吸收作用[25]。在本研究中,巨柏幼苗新生根比根长在7.5和27.5℃时均较大,而在12.5、17.5、22.5℃时较小,且三者之间差异不显著。可见,相对较低和较高的温度均会影响巨柏幼苗根系的正常生长,幼苗通过增加比根长来更有效地吸收土壤中的养分和水分。
以上研究结果表明,巨柏幼苗在不同温度下生长发育和光合作用表现不同,17.5℃左右是其相对适宜的生长温度,在此温度条件下幼苗光合效率、新生根生长及各部分干物质的积累最大。而相对高温和相对低温条件均不利于巨柏幼苗光合产物的积累及新生根的生长。本研究结果可为巨柏优质壮苗的生产和科学合理的种植提供一定的参考,同时可为全球气候变暖对巨柏生长发育和光合性能的影响研究奠定一定的理论基础。
参考文献(References):
[1]郑伟.植物幼苗生长对策研究.长春:东北师范大学,2011.ZHENG W.The study on plant seedling growth strategy.Changchun:Northeast Normal University,2011.(in Chinese with English abstract)
[2]SAGE R F,KUBIEN D S.The temperature response of C3and C4photosynthesis.Plant Cell and Environment,2007,30(9):1086-1106.
[3]HANLEY M E.Seedling herbivory and the influence of plant species richness in seedling neighborhoods.Plant Ecology,2004,170(1):35-41.
[4]吴征镒.西藏植物志:第1卷.北京:科学出版社,1983:386.WU Z Y.Flora in Tibet(Vol.1).Beijing:Science Press,1983:386.(in Chinese)
[5]王景升,郑维列,潘刚.巨柏种子活力与濒危的关系.林业科学,2005,41(4):37-41.WANG J S,ZHENG W L,PAN G.Relation between being endangered and seed vigor aboutCupressus giganteain Tibet.Scientia Silvae Sinicae,2005,41(4):37-41.(in Chinese with English abstract)
[6]汪松,解炎.中国物种红色名录.北京:高等教育出版社,2004:305.WANG S,XIE Y.China Species Red List.Beijing:Higher Education Press,2004:305.(in Chinese)
[7]郑维列,薛会英,罗大庆,等.巨柏种群的生态地理分布与群落学特征.林业科学,2007,43(12):8-15.ZHENG W L,XUE H Y,LUO D Q,et al.Eco-geographic distribution and coenology characteristics ofCupressus gigantea.Scientia Silvae Sinicae,2007,43(12):8-15.(in Chinese with English abstract)
[8]杨宁.西藏林芝巨柏群落现状与保护.中南林业调查规划,2015,34(2):52-54.YANG N.Current status and protection ofCupressus giganteaCheng et L.K.Fu communities in Nyingchi of Tibet.Central South Forest Inventory and Planning,2015,34(2):52-54.(in Chinese with English abstract)
[9]兰小中,廖志华,王景升.西藏高原濒危植物西藏巨柏光合作用日进程.生态学报,2005,25(12):3172-3175.LAN X Z,LIAO Z H,WANG J S.The diurnal course of photosynthesis of the endangered species TibetanCupressus giganteain Tibet Plateau.Acta Ecologica Sinica,2005,25(12):3172-3175.(in Chinese with English abstract)
[10]边喜丽,杨小林,马和平,等.藏东南巨柏根系结构特征分析.西部林业科学,2017,46(4):107-112.BIAN X L,YANG X L,MA H P,et al.Root structure and specific characteristics ofCupressus giganteain Southeast Tibet.Journal of West China Forestry Science,2017,46(4):107-112.(in Chinese with English abstract)
[11]尹金迁,赵垦田,邹林红.基质和温度对巨柏移植苗根系生长发育的影响.西部林业科学,2017,46(5):87-92.YIN J Q,ZHAO K T,ZOU L H.Impact of different substrates and temperatures on the growth and development ofCupressus giganteatransplant seedling roots.Journal of West China Forestry Science,2017,46(5):87-92.(in Chinese with English abstract)
[12]罗桑卓玛,辛福梅,杨小林,等.干旱胁迫对香柏幼苗生长和生理指标的影响.西北农林科技大学学报(自然科学版),2014,43(5):51-57,70.LUOSANGZUOMA,XIN F M,YANG X L,et al.Effect of drought stress on growth and physiological indicators of seedlings ofSabina pingiivar.wilsoniiseedlings.Journal of Northwest Agriculture and Forestry University(Natural Science Edition),2014,43(5):51-57,70.(in Chinese with English abstract)
[13]辛福梅,刘济铭,杨小林,等.色季拉山急尖长苞冷杉叶片及细根性状随海拔的变异特征.生态学报,2017,37(8):2719-2728.XIN F M,LIU J M,YANG X L,et al.Variation in leaf and fine root traits with altitude inAbies georgeivar.smithiiin Mt.Shergyla.Acta Ecologica Sinica,2017,37(8):2719-2728.(in Chinese with English abstract)
[14]平晓燕,周广胜,孙敬松.植物光合产物分配及其影响因子研究进展.植物生态学报,2010,34(1):100-111.PING X Y,ZHOU G S,SUN J S.Advances in the study of photosynthate allocation and its controls.Chinese Journal of Plant Ecology,2010,34(1):100-111.(in Chinese with English abstract)
[15]刘贤赵,宿庆,李嘉竹,等.控温条件下C3、C4草本植物碳同位素组成对温度的响应.生态学报,2015,35(10):3278-3287.LIU X Z,SU Q,LI J Z,et al.Responses of carbon isotopic composition of C3and C4herbaceous plants to temperature under controlled temperature conditions.Acta Ecologica Sinica,2015,35(10):3278-3287.(in Chinese with English abstract)
[16]景立权,赖上坤,王云霞,等.大气CO2浓度和温度互作对水稻生长发育的影响.生态学报,2016,36(14):4254-4265.JING L Q,LAI S K,WANG Y X,et al.Combined effect of increasing atmospheric CO2concentration and temperature on growth and development of rice:a research review.Acta Ecologica Sinica,2016,36(14):4254-4265.(in Chinese with English abstract)
[17]ANDREWS M,RAVEN J A,SPRENT J I.Environmental effects on dry matter partitioning between shoot and root of crop plants:relationswith growth and shootprotein concentration.Annals of Applied Biology,2001,138(1):57-68.
[18]XU D Q.Progressinphotosynthesisresearch:from molecular mechanisms to green revolution.Acta Phytophysiologica Sinica,2001,27(2):97-108.
[19]姜籽竹,朱恒光,张倩,等.低温胁迫下植物光合作用的研究进展.作物杂志,2015(3):23-28.JIANG Z Z,ZHU H G,ZHANG Q,et al.Progress of influence of low temperature on plant photosynthesis.Crops,2015(3):23-28.(in Chinese with English abstract)
[20]HOGLIND M,HANSLIN H M,MORTENSEN L M.Photosynthesis ofLolium perenneL.at low temperatures under low irradiances.Environmental and Experimental Botany,2011,70(2/3):297-304.
[21]LU G H,WU Y F,BAI W B,et al.Influence of high temperature stress on netphotosynthesis,dry matter partitioning and rice grain yield at flowering and grain filling stages.Journal of Integrative Agriculture,2013,12(4):603-609.
[22]ALLEN L H,VU J C V.Carbon dioxide and high temperature effects on growth of young orange trees in a humid,subtropical environment.Agricultural and Forest Meteorology,2009,149(5):820-830.
[23]许辰森,熊德成,邓飞,等.杉木幼苗和伴生植物细根对土壤增温的生理生态响应.生态学报,2017,37(4):1232-1243.XU C S,XIONG D C,DENG F,et al.The ecophysiological responses of fine-roots of Chinese fir(Cunninghamia lanceolata)seedlings and the associated plants to soil warming.Acta Ecologica Sinica,2017,37(4):1232-1243.(in Chinese with English abstract)
[24]LI M.Impact factors on fine roots seasonal dynamics inFraxinus mandshuricaplantation.Scientia Silvae Sinicae,2006,42(9):7-12.
[25]GUO D L,XIA M X,WEI X,et al.Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate treespecies.NewPhytologist,2008,180(3):673-683.

