干旱胁迫下大麦蜡质缺失突变体的生理生化指标及蜡质基因表达
郑好,吕夏晨,谭赛琼,路雪丽,张弦,张晓勤,薛大伟
(杭州师范大学生命与环境科学学院,杭州 310036)
干旱是世界上最为严重的灾害之一,其出现次数、持续时间、影响范围、造成的损失等均居各种自然灾害之首[1]。大麦(Hordeum vulgare)是一种生产面积仅次于小麦、玉米和水稻的重要粮食作物[2]。在大麦生长季节,常常遭遇到不同程度的干旱胁迫,严重地影响了大麦的生产。因此,研究抗旱作物新品种有利于解决世界粮食问题,同时也是当下研究领域的一大热点。
蜡质是覆盖在大多数陆生植物表面、能够保护植物免受生物和非生物胁迫的疏水表层。植物表皮蜡质在对抗各种逆境中发挥着巨大的作用,如抵御干旱等功能,对植物适应外界环境起到了非常重要的作用[3]。张海禄等[4]研究发现,大麦蜡质含量与水分利用效率之间的相关性达到了显著水平,认为表皮蜡质含量能够反映出水分利用效率的高低。某些植物的蜡质缺失突变体均表现出了对外界环境中水分含量的敏感性,如拟南芥的cer突变体[5]。这些均充分说明蜡质在植物自身的抗逆响应机制中具有积极的作用。当下,对蜡质的成分和形态已经有了较深的研究,但植物蜡质合成和相关调控非常复杂,所以目前对于植物蜡质在干旱胁迫下相关基因的响应机制还未十分明确。这些基因的详细功能和调控需要进一步研究,特别是关于蜡质代谢的关键基因,包括其参与蜡质代谢调节所起的具体作用[3]。
我们在大麦浙农大3号(ZJU3)的甲基磺酸乙酯(ethylmethylsulfone,EMS)突变体库中鉴定到1个典型的表皮蜡质突变体[6]。经过多年选育,其性状能稳定遗传,命名为P1,该突变体茎秆、穗部、叶鞘蜡粉缺失,但叶片蜡质含量正常。本文通过研究干旱处理下大麦蜡粉缺失突变体P1和野生型大麦ZJU3的生理生化指标及10个蜡质相关基因表达情况,以期进一步了解蜡质合成相关基因响应干旱胁迫的分子机制;并比较二者在干旱胁迫下是否会表现出不同的生理及分子响应机制。研究结果将为培育具有优良抗旱性状的作物品种提供理论支持。
1 材料与方法
1.1 试验材料
取野生型大麦ZJU3、蜡粉缺失突变体P1种子,脱粒,备用。
1.2 试验处理
将大麦种子(P1、ZJU3)用 0.1%H2O2消毒 10 min,蒸馏水冲洗,暗处萌发24 h后,种植于培养盒中。当幼苗生长到1叶1心时转移到1/2霍格兰(Hoagland)营养液中培养。幼苗生长到2叶时,用一定浓度的聚乙二醇(macrogol)6000(PEG-6000)溶液模拟干旱胁迫处理。生理生化试验设定3个浓度梯度(0%、10%、20%PEG)处理,分别在干旱处理0、24、48 h时取大麦幼苗叶片测定各项生理生化指标。基因表达研究设定2个浓度梯度(0%、20%PEG)处理,在干旱处理24 h时取叶片进行测定。其中Hoagland营养液的配方为:48.2 mg/L(NH4)2SO4,65.9 mg/L MgSO4,15.9 mg/L K2SO4,18.5 mg/L KNO3,59.9mg/LCa(NO3)2,24.8mg/LKH2PO4,5mg/L FeC6H5O7,0.9 mg/L MnCl2·4H2O ,0.11 mg/L ZnSO4·7H2O ,0.04 mg/L CuSO4·5H2O ,2.9 mg/L HBO3,0.01 mg/L H2MoO4。
1.3 生理生化指标的测定
参考朱双艳的方法[7]:超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用氮蓝四唑(NBT)光化还原法,以抑制50%的NBT光化还原为一个酶活性单位(U);过氧化物酶(peroxidase,POD)活性测定采用愈创木酚法;MDA含量测定采用硫代巴比妥酸(TBA)法。脯氨酸(proline,Pro)含量测定使用脯氨酸(Pro)含量测试盒(江苏省苏州科铭生物技术有限公司),具体步骤参考说明书。
1.4 干旱胁迫下大麦幼苗10个蜡质基因的表达分析
1.4.1 总RNA的提取
参考RNeasy®Plant Mini Kit试剂盒(QIANGEN公司,德国)提取叶片总RNA,并用DNase I(RNase free)去除DNA污染。
1.4.2 cDNA的合成
参考ReverTra Ace®qPCR RT Master Mix试剂盒(TOYOBO,日本)的说明书,将各样品总RNA反转录合成cDNA第一条链。获得的cDNA产物直接用于聚合酶链式反应(polymerase chain reaction,PCR)或于-20℃冰箱中贮藏,备用。
1.4.3 特异性引物的设计
选取表1中所列的10个基因,所得序列在GenBank中比对,找到大麦中的同源基因序列。根据实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)的引物设计原则,利用Primer Premier v5.0 软件设计各基因的引物。

表1 大麦蜡质合成相关基因引物Table 1 Primers of barley wax synthesis related genes
1.4.4 各基因目的片段的普通PCR扩增
PCR反应体系(25 μL):2.5 μL 10×PCR 缓冲液(含 MgCl2),0.5 μL dNTP 混合物,0.5 μL上游/下游引物,1 μLTaqDNA聚合酶,1 μL cDNA,19 μL无菌水。PCR程序:95℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸90 s,40个循环。扩增后取10 μL扩增产物用1%琼脂糖凝胶电泳进行分析,检查反应产物及长度。
1.4.5 基因的实时荧光定量PCR及数据分析
采用CFX96 Real-Time PCR Detection System(Bio-Rad公司,美国)进行各基因的实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)分析。实时荧光定量PCR反应体系(10 μL):5 μL SYBR Green Fast qPCR Master Mix(BBI),0.5 μL 上游/下游引物,2 μL cDNA,2 μL无菌水。实时荧光定量PCR程序:95℃预变性10 s;95℃变性5 s,55℃退火并延伸30 s,40个循环。试验数据采用相对定量法分析。
1.5 数据处理
试验数据采用SigmaPlot 10.0和SPSS 20.0软件进行统计分析,采用配对t检验法进行差异显著性检验。
2 结果与分析
2.1 干旱对大麦幼苗抗氧化酶活性的影响
SOD是植物体内清除氧自由基的一种重要的保护酶。由图1A可知:在10%PEG处理下,P1的SOD活性呈先上升后下降的趋势,而ZJU3的SOD活性呈持续上升的趋势。而在20%PEG处理下,P1的SOD活性持续维持在较低水平,且呈缓慢增长的趋势;ZJU3的SOD活性呈先上升后下降的趋势。
在植物体内,POD酶具有和SOD酶相似的功能。由图1B可知:在不同浓度的PEG处理下,P1和ZJU3的POD活性均呈先上升后下降的趋势;P1和ZJU3之间POD活性变化在干旱处理24 h时呈显著性差异。由上可知:同为抗氧化酶的SOD和POD的活性变化规律具有相似性;蜡粉缺失突变体P1的抗逆性要弱于野生型ZJU3,说明蜡粉的缺失造成了突变体P1抗逆性的减弱。
2.2 干旱对大麦幼苗Pro和MDA含量的影响
MDA是膜脂过氧化作用的最终产物之一,也是衡量膜系统受害的重要指标之一,用于表示细胞膜脂过氧化程度和植物对逆境条件反应的强弱。由图2A可知:在10%PEG处理下,P1和ZJU3的MDA含量未见明显差异。而在20%PEG处理下,P1和ZJU3的MDA含量急剧上升,说明膜系统受到严重损害。在PEG处理下,总体上ZJU3的MDA含量要略低于P1,说明其抗逆性较好。由此可知,蜡粉缺失突变体P1在干旱胁迫时,调节能力较野生型ZJU3差,细胞膜损伤较严重。
Pro是调节植物水分胁迫条件下细胞水势的物质之一。SINGH等研究了在水分胁迫下大麦体内游离脯氨酸积累的品种间差异,得出其与品种的抗旱性呈正相关的结论[8]。由图2B可知:在不同浓度的PEG处理下,P1和ZJU3的Pro含量均呈持续上升的趋势。ZJU3的上升速率要略大于P1,说明其抗逆性较好。
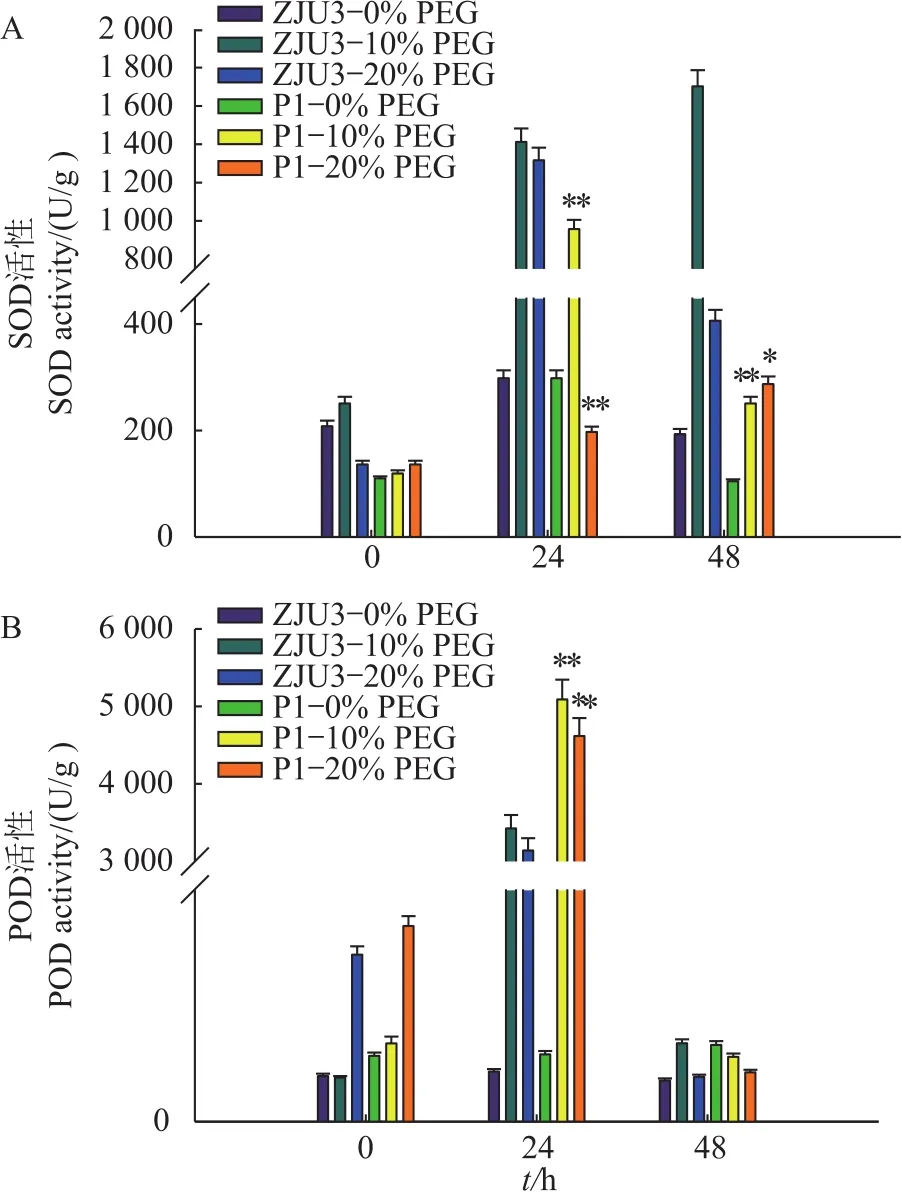
图1 干旱胁迫下大麦幼苗的抗氧化酶活性Fig.1 Antioxidant enzyme activities of P1 and ZJU3 seedlings under drought stress
2.3 干旱对大麦幼苗蜡质基因表达的影响
本研究所选取的10个蜡质基因全部被成功检测,溶解曲线峰值单一性良好,没有非特异性扩增。把野生型ZJU3的基因表达量作为1,对比分析蜡粉缺失突变体P1的基因表达量。由图3可知:干旱处理24 h后,选取的10个蜡质基因中,有6个基因表达下调,分别是CER60、LACS1、WIN1、CER10、FTSH10和WRKY57,与ZJU3相比,在P1中表达量分别下调了40%、50%、50%、95%、47%和73%。有3个基因表达上调,分别是CER6、MYB94和DWA1,在P1中的表达量分别是ZJU3中的1.4倍、2.1倍和3.6倍。另有1个基因WIN2表达量未见明显差异。除WIN2外,P1所测基因相对于ZJU3均呈显著性差异。

图2 干旱胁迫下大麦幼苗的Pro和MDA含量Fig.2 Pro and MDA contents of P1 and ZJU3 seedlings under drought stress
3 讨论
植物在正常的生长条件下,体内活性较高的保护酶系统使活性氧的产生和清除维持在一个动态平衡之中。而逆境胁迫打破了这种动态平衡,迫使植物体内的活性氧迅速产生,其对植物的生长具有强烈的破坏作用。在植物保护酶系统中,SOD和POD共同作用可将H2O2转化为H2O,使自由基保持在较低水平,从而避免膜的损伤。在本次试验中,在干旱胁迫下,P1的SOD活性出现降低的趋势,说明超出了其调控范围,保护酶系统受到了损伤。而在干旱胁迫下,P1和ZJU3之间POD活性均呈先上升后下降的趋势,未见显著性差异。这可能与大麦幼苗较小、干旱胁迫均对其造成了损伤有关。在需氧生物中,活性氧代谢失调时自由基的积累及自由基对大分子的破坏作用是遭受逆境迫害时的重要特征[9]。在植物组织中,随着活性氧的增多,也加剧了膜脂过氧化程度,MDA可作为衡量过氧化程度的指标,以间接测定膜系统的受损程度及植物的抗逆性[10]。在20%PEG处理下,P1和ZJU3的MDA含量急剧上升,但是P1的MDA含量较高,说明P1的膜系统受害更为严重。脯氨酸(Pro)是调节植物水分胁迫条件下细胞水势的物质之一,Pro含量的积累反映了植物对不良环境条件的忍耐能力[11-12]。ZJU3中Pro含量的上升速率大于P1,说明其耐受性较好。综上所述,野生型ZJU3的抗逆性要高于蜡粉缺失突变体P1,可推测蜡质的存在可直接或间接地提高植株的抗旱能力。
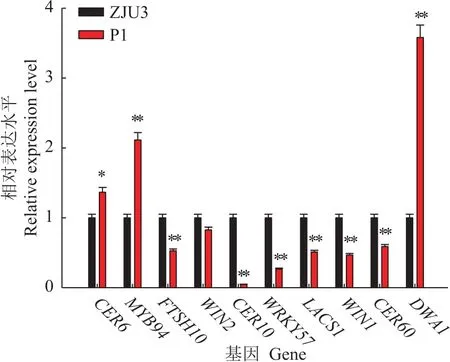
图3 干旱胁迫下苗期无蜡粉突变体P1与野生型ZJU3蜡质基因表达情况Fig.3 Expression of waxy genes of mutant P1 and wild-type ZJU3 seedlings under drought stress
植物对干旱胁迫的应答过程中发生的一系列生理生化变化,是复杂的内在分子机制调控的结果。植物在逆境下蜡质相关基因的表达情况与其抗逆性密切相关。在本试验选取的10个基因中,P1相对于ZJU3有6个基因表达下调,3个基因表达上调,1个基因表达未见明显差异。CER6基因是与超长脂肪酸合成特异相关的关键基因,在cer6突变体中,茎上几乎不存在蜡质[13]。CER60作为CER6的同源基因,可能受到CER6高表达的影响反而表达被抑制。这与CER60在P1中表达量约为ZJU3的60%这一试验结果相符。MYB94转录因子已经被证实通过WSD1、KCS2/DAISY、CER2、FAR3和ECR基因表达的上调来激活蜡质的合成[14]。由结果推测,MYB94转录因子的过表达可能还作用于CER6基因,促进其表达。LACS1基因[15]和DWA1基因[16]均和酰基辅酶A(CoA)的形成有关,但在结果中表达量变化未一致,需进一步研究。拟南芥中WIN1/SHN1基因及其同源基因SHN2和SHN3是最早被发现与表皮蜡质合成有关的转录因子,后续的报道证实WIN1能够直接参与角质合成的调控并间接影响蜡质的积累[17-18],与本次试验中P1的WIN1基因低表达这一结果相符。ECR/CER10催化的反应是超长链脂肪酸延长的最后一步[19],可能是该基因的低表达导致了突变,体P1的无蜡性状。FTSH10基因和WRKY57基因此前已被报道参与植物对干旱胁迫的反应[20-21]。本次试验中,FTSH10基因和WRKY57基因均低表达。推测突变体P1在CER10基因上发生了突变,导致其无蜡性状。由于CER10的低表达,可能导致在其下游将长链脂肪酸转化为酰基辅酶A相关的基因DWA1过表达。同时,CER10的低表达可能导致了在其上游的MYB94基因和蜡质合成关键基因CER6过表达。由结果推测,可能存在某一调控蜡质合成的未知基因发生了突变,导致相关转录和调控基因低表达。
4 结论
在干旱胁迫下,大麦蜡粉缺失突变体和野生型在生理生化及蜡质基因表达模式上存在不同,表明了蜡粉缺失突变体的特性和性状产生与蜡质基因有关,以及野生型较无蜡粉突变体在抗逆性上的优势。由于蜡质的相关机制还十分复杂,因此需要对相关基因的功能和作用机制进行深入的研究。
参考文献(References):
[1]柯贞进,尹美强,温银元等.干旱胁迫下聚丙烯酰胺浸种对谷子种子萌发及幼苗期抗旱性的影响.核农学报,2015,29(3):563-570.KE Z J,YIN M Q,WEN Y Y,et al.Effects of polyacrylamide seed soaking on seed germination and drought resistance of millet(Setaria italica)seedings under drought stress.Journal of Nuclear Agricultural Sciences,2015,29(3):563-570.(in Chinese with English abstract)
[2]SCHULTE D,CLOSE T J,GRANER A,et al.The international barley sequencing consortium:at the threshold of efficient access to the barley genome.Plant Physiology,2009,149:142-147.
[3] XUE D W,ZHANG X Q,LU X L,et al.Molecular and evolutionary mechanisms of cuticular wax for plant drought tolerance.Frontiers in Plant Science,2017,8:621.
[4] 张海禄,齐军仓,王祥军.干旱胁迫对大麦叶片表皮蜡质含量及主要生理指标的影响.麦类作物学报,2012,32(2):280-283.ZHANG H L,QI J C,WANG X J.Effects of water stress on epicuticular wax content and main physiological parameters of barley.Journal of Triticeae Crops,2012,32(2):280-283.(in Chinese with English abstract)
[5]BOURDENX B,BERNARD A,DOMERGUE F,et al.Overexpression ofArabidopsis ECERIFERUM1promotes wax very-long-chain alkane biosynthesis and influences plant response to biotic and abiotic stresses.Plant Physiology,2011,156(1):29-45.
[6] 张晓勤,薛大伟,周伟辉,等.用甲基磺酸乙酯(EMS)诱变的大麦浙农大3号突变体的筛选和鉴定.浙江大学学报(农业与生命科学版),2011,37(2):169-174.ZHANG X Q,XUE D W,ZHOU W H,et al.Screening and identification of the mutants from two-row barley cultivar ZJU3 induced by ethyl methanesulfonate(EMS).Journal of Zhejiang University(Agriculture and Life Sciences),2011,37(2):169-174.(in Chinese with English abstract)
[7] 朱双艳.大麦幼苗叶片表皮蜡质沉积与膜脂过氧化的关系及其对表皮透性影响的研究.新疆,石河子:石河子大学,2014:1-10.ZHU S Y.Study on the relationship of epicuticular wax deposition and membrane peroxidation in barley seeding leaves and its impacts on epidermal permeability.Shihezi,Xinjiang Uyghur Autonomous Region:Shihezi University,2014:1-10.(in Chinese with English abstract)
[8]SINGHTN,ASPINALLD,PALEGLG.Proline accumulation and varietal adaptability to drought in barley:a potential metabolic measure of drought resistance.Nature New Biology,1972,236(67):188-190.
[9] 刘训财,陈华锋,井立文,等.盐胁迫对中国春-百萨燕麦草双二倍体SOD、CAT活性和MDA含量的影响.安徽农学通报,2009,15(8):43-46.LIU X C,CHEN H F,JING L W,et al.Effects of salt stress onSOD/CAT activitiesandmalondialdehyde(MDA)content ofTriticum aestivum Thinopyrum bessarabicumdiploid.Anhui Agricultural Science Bulletin,2009,15(8):43-46.(in Chinese with English abstract)
[10]SALIN M L.Toxic oxygen species and protective systems of the chloroplast.Physiologia Plantarum,1988,72(3):681-689.
[11]余玲,王彦荣,GARNETT T,等.紫花苜蓿不同品种对干旱胁迫的生理响应.草业学报,2006,15(3):75-85.YU L,WANG Y R,GARNETT T,et al.A study on physiological responses of varieties ofMedicago sativaand their relationship with the drought resistance capacity under drought stress.Acta Prataculturae Sinica,2006,15(3):75-85.(in Chinese with English abstract)
[12]李予霞,崔百明,董新平,等.PEG处理下葡萄试管苗脯氨酸及内源ABA含量变化的研究.石河子大学学报(自然科学版),2004,22(1):43-45.LI Y X,CUI B M,DONG X P,et al.A study on proline and ABA content changes under water stress induced by PEG.Journal of Shihezi University(Natural Science),2004,22(1):43-45.(in Chinese with English abstract)
[13]LEE S B,JUNG S J,GO Y S,et al.Two Arabidopsis3-ketoacyl CoA synthase genes,KCS20andKCS2/DAISY,are functionally redundant in cuticular wax and root suberin biosynthesis but differentially controlled by osmotic stress.Plant Journal,2009(60):462-475.
[14]DUBOS C,STRACKE R,GROTEWOLD E,et al.MYB transcription factors inArabidopsis.Trends in Plant Science,2010,15(10):573-581.
[15]ZHAO L,KATAVIC V,LI F,et al.Insertional mutant analysis reveals that long-chain acyl-CoA synthetase 1(LACS1),but notLACS8,functionally overlaps with LACS9 inArabidopsisseed oil biosynthesis.The Plant Journal,2010,64(6):1048-1058.
[16]ZHU X Y,XIONG L Z.Putative megaenzyme DWA1 plays essential roles in drought resistance by regulating stressinduced wax deposition in rice.Proceedings of the National Academy of Sciences of the United States of America,2013,110(44):17790-17795.
[17]BROUN P,POINDEXTER P,OSBORNE E.WIN1,a transcriptional activator of epidermal wax accumulation inArabidopsis.Proceedings of the National Academy of Sciences of the United States of America,2004,101(3):4706-4711.
[18]SCHNURR J,SHOCKEY J,BROWSE J.The acyl-CoA synthetase encoded byLACS2is essential for normal cuticle development inArabidopsis.Plant Cell,2004,16(3):629-642.
[19]ZHENG H Q,ROWLAND O,KUNST L.Disruptions of theArabidopsisenoyl-CoA reductase gene reveal an essential role for very-long chain-fatty acid synthesis in cell expansion during plant morphogenesis.Plant Cell,2005,17:1467-1481.
[20]LANGER T.AAA proteases:cellularmachinesfor degrading membrane proteins.TrendsinBiochemical Sciences,2000,25(5):247-251.
[21]GOLLDACK D,LÜKING I,YANG O.Plant tolerance to droughtandsalinity:stressregulatingtranscriptionfactorsand their functional significance in the cellular transcriptional network.Plant Cell Reports,2011,30(8):1383-1391.

