怀地黄内生产红色素真菌血红红曲霉(Monascussanguineus)的分离与鉴定
何亚涛,高丹丹,甘森宁,孙婷,蔡葵蒸,刘俊林
(西北民族大学生命科学与工程学院,兰州 730124)
随着人们对食品安全问题的普遍关注,绿色无公害的天然色素的使用便引起了人们的重视[1-2]。红曲色素作为我国传统的红色天然食用色素,近些年来发现其不仅可用于食品染色,还具有抑制胆固醇合成、降低血压、抗疲劳、治疗骨质疏松、预防老年痴呆等多种保健功能。红曲色素稳定性好,安全性高,并不断有新的功效被发现,值得深入研究[3-4]。
药用植物内生真菌普遍存在于健康植物组织和器官中,种类繁多,分布广泛,是一个巨大的菌种资源宝库[5]。虽然许多种药用植物的化学成分及药效功能已明确,但是其共生的微生物类群及其和微生物的生理互作还有待阐明[6]。植物 怀 地 黄(Rehmannia glutinosa)为玄参科(Scrphulariaceae)地黄属(Rehmannia)多年生草本植物,有清热凉血,养阴生津的功效[7]。近几年的研究表明,怀地黄内生菌及其代谢产物具有抑菌、促生等活性作用[8-9]。
红曲霉(Monascus)为子囊菌门(Ascomycecota)散囊菌目(Eurotiales)的丝状真菌。至今,红曲霉属及其属内物种的分类地位在国际上都没有被统一。血红红曲霉(Monascus sanguineus)于1995年被分离于伊拉克的阿拉伯河(Shatt-al-Arab River)[10],还曾在印度尤纳塔克邦(Karnataka)的石榴(Punica granatum)中被分离得到[11]。尽管在我国红曲霉应用历史悠久,但菌种来源相对单一,大多分离自红曲米、酿酒大曲、发酵糟、红腐乳、丢糟、酒醅等材料中[12-15]。菌种的分类地位大都为红色红曲霉进化枝(SectionRubri),包括红色红曲霉(M.ruber)和紫色红曲霉(M.purpureus)[16]。本研究从药用植物怀地黄中首次分离得到能够产生丰富可溶性红色素的内生真菌M.sanguineus,为我国红曲霉属菌种拓展了新的来源,通过2个M.sanguineus培养菌株的形态学观察和基因序列分析相结合的手段对菌株RJL03进行了详细的描述和鉴定,初步探讨了菌种M.sanguineus与M.purpureus的关系,为怀地黄及红曲霉属真菌的进一步研究和开发应用奠定了基础。
1 材料与方法
1.1 材料
1.1.1 材料来源
药用植物怀地黄于2016年10月采自河南省焦作市武陟县北郭乡东安村地黄人工种植基地(海拔97 m,35.01°N,113.20°E),取回后立即进行内生真菌分离(图1)。菌株M.sanguineus(SICC 3.292)购自四川省工业微生物菌种保藏管理中心(Sichuan Center of Industrial Culture Collection,SICC)。

图1 药用植物材料怀地黄Fig.1 Plant material Rehmannia glutinosa
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(货号:P8931)、麦芽浸粉琼脂(malt extract agar,MEA)培养基(货号:LA4980),购自北京索莱宝科技有限公司;查氏酵母膏琼脂(Czapek yeast extract agar,CYA)培养基(货号:M4208B),购自山东拓普生物工程有限公司。
1.1.3 主要试剂和仪器
2.5%戊二醛固定液(货号:P1126),购自北京索莱宝科技有限公司;1×磷酸盐缓冲液(货号:SH30256.01),购自美国HyClone公司;Taq酶(货号:DTM-101),购自日本东洋纺公司;HWS型智能恒温恒湿箱,购自宁波东南仪器有限公司;BME生物显微镜,购自上海徕卡显微系统有限公司;JSM-5600LV低真空扫描电子显微镜,购自日本电子光学公司。
1.2 内生真菌的分离培养
取新鲜的怀地黄块根先在自来水下冲洗干净,并在无菌条件下,依次用70%乙醇表面杀菌1 min,无菌水冲洗3次,0.1%氯化汞溶液浸泡3 min,最后用无菌水清洗5次,晾干。再将其切成0.5 cm×1 cm×0.5 cm的小块,然后接种于含有1%双抗溶液(mycillin,100 IU/L)的PDA培养基上,于28℃环境下培养3~5 d,待怀地黄块周围长出真菌后,转移到新鲜PDA培养基上,直至得到菌落单一的纯化菌株[17]。将分离得到的菌株RJL03用于后续试验。
1.3 真菌的形态学鉴定
将菌株RJL03和SICC 3.292分别接种于PDA、MEA、CYA培养基上,置于25℃环境下培养7 d。其间记录其生长速率并详细描述其菌落特征。光学显微镜观察采用透明胶带法制片,在载玻片上滴1滴乳酸酚棉蓝染液,用透明胶带将菌丝粘上。在菌丝面滴1滴乙醇,放在有染液的玻片上,再在胶带上表面滴1滴染液,覆上盖玻片,置于显微镜下观察菌丝、孢子、孢子梗、孢子囊等的显微特征。扫描电镜观察采用插片培养法培养菌株,待菌丝爬片后轻轻取出盖玻片进行处理。附有菌的玻片放入2.5%的戊二醛固定液中固定4 h以上,然后用1×磷酸盐缓冲液漂洗3次。采用不同质量分数梯度(50%、70%、80%、90%、95%、100%)的乙醇依次浸泡脱水20 min,最后转入纯的乙酸异戊酯中置换1 h,喷金后进行菌株形态观察[18]。
1.4 真菌基因组提取及序列扩增
使用真菌基因组提取试剂盒提取菌株RJL03和SICC 3.292 的 DNA,使 用 通 用 引 物 ITS1(5´-TCCGTAGGTGAACCTGCGG-3´)/ITS4(5´-TCCT CCGCTTATTGATATGC-3´)对rDNA的ITS片段进行扩增,进行聚合酶链式反应(polymerase chain reaction,PCR),反应条件为:94℃预变性2 min;94 ℃变性30 s,50.3 ℃退火30 s,68 ℃延伸90 s,35个循环;最后72℃延伸7 min。使用通用引物NS1(5´-GTAGTCATATGCTTGTCTC-3´)/NS8( 5´-TCCG CAGGTTCACCTACGG-3´)对rDNA的18S片段进行扩增。PCR反应条件为:94℃预变性4 min;94℃变性45 s,50.3 ℃退火30 s,68 ℃延伸1 min 45 s,35个循环;最后72℃延伸10 min。PCR扩增采用20 μL反应体系,包括预混Taq酶 10 μL,ddH2O 6.6 μL,DNA 1.8 μL,上下游引物各 0.8 μL[19]。PCR 产物经1%的琼脂糖凝胶电泳检测并纯化后送至天津金唯智生物科技有限公司进行双向测序。
1.5 真菌的系统发育学分析
对双向测序得到的基因序列拼接并检查,将测序结果提交到GenBank。使用菌株RJL03的ITS和18S rDNA序列作为查询序列,在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行BLAST比对,下载与查询序列相似的序列,得到15条18S rDNA序列,17条ITS rDNA序列,所得序列用于后续的系统发育分析。采用MAFFT网页服务器(https://mafft.cbrc.jp/alignment/server/)对同源序列进行多序列比对,使用MEGA 7.0软件手动调整序列[20]。核苷酸替换模型使用MrModeltest 2.3进行选择,采用raxmlGUI 1.5软件[21]按照最大似然法(maximum likelihood,ML)构建系统发育树,其中自展数(bootstrap)为1 000,模型为GTR+I。
2 结果和分析
2.1 产红色素真菌的形态学鉴定
RJL03培养7 d后,CYA培养基上菌落直径为24~26 mm,PDA上为28~31 mm,MEA上为29~32 mm(图2A~C)。菌株在CYA培养基上生长受限,而在PDA与MEA上生长速率相当。在不同培养基上,菌落初均为白色,后产色素变红,绒毡状,可溶性红色素在MEA培养基中存在最为明显。菌丝分枝,分隔;分生孢子倒梨形,单生或至多10个成短链状,大小为(8.0~16.5)μm×(7.5~14.0)μm;孢子囊球形,外壳褐色,直径32~70 μm;孢子梗菌丝状,子囊孢子椭圆形,子囊孢子椭圆形,大小为(6.0~7.5)μm×(4.0~5.0)μm,表面平滑,无色或红色(图2D~G)。菌株SICC 3.292(非模式菌株)与RJL03宏观形态略有不同,其产色素量较RJL03略低,而微观形态基本一致。通过与《真菌鉴定手册》等资料[22-25]比对,可以确定菌株RJL03为红曲霉属(Monascus)物种。然而,仅依据形态学特征很难准确地将物种鉴定到种一级水平,尤其是红曲霉属的物种分类还未被统一,这更加给RJL03物种的确定增加了难度。因此,我们进一步采用序列分析的分子学手段来获得更多的分类信息。
2.2 真菌的ITS和18S序列分析
测序后得到菌株RJL03和SICC 3.292的18S序列长度分别为1655和1680bp。整理后提交GenBank,获得ITS序列号为MF175372和MF372833。如图3所示,根据18S rDNA序列构建的系统发育树可以看出,RJL03与SICC 3.292菌株处于同一分支,亲缘关系最近,相似度达93%。而且可以看出,物种M.sanguineus进化枝与M.purpureus进化枝亲缘关系较近,相似度达91%。18S rDNA序列在进化上比较保守,同属菌株的18S rDNA序列碱基差异较小,在系统发育研究中可以鉴定到属及以上。而且GenBank中除本研究得到的2条M.sanguineus的18S序列外,无可用比对序列,故进一步对ITS rDNA序列进行分析。ITS区进化较快,在真菌的种间存在着丰富的变异,而在种内不同菌株间却高度保守,可以用它鉴定到种及以下水平。
测序得到RJL03和SICC 3.292菌株的ITS序列长度分别为589和584 bp(序列号分别为MF175371和MF372832)。如图4所示,根据ITS序列构建的系统发育树可以看出,5个M.sanguineus菌株处于同一分支,亲缘关系达100%。另外,物种M.sanguineus与M.purpureus进化枝亲缘关系较近,相似度达92%。M.sanguineus、M.purpureus和M.ruber与其他4个红曲霉属物种亲缘关系较远。结合形态学结果及根据2个基因序列的分析结果,可将RJL03鉴定为血红红曲霉(Monascus sanguineus),并且菌株SICC 3.292也被确定为物种M.sanguineus。
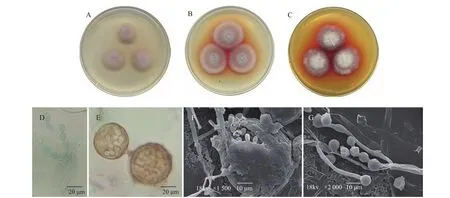
图2 内生真菌RJL03的形态特征Fig.2 Morphology of endophytic fungi RJL03
3 讨论
本研究根据形态观测和序列分析的结果将RJL03鉴定为M.sanguineus。但值得提出的是,BARBOSA等[16]在2017年采用多相方法对红曲霉属的研究中,根据多基因序列分析暂时提出将M.sanguineus与M.purpureus视为同一物种,在图3和图4中的M.sanguineus、M.purpureus和M.ruber被视为红色红曲霉组合(SectionRubri),保留其下2个物种M.purpureus和M.ruber,另外的如M.floridanus等7个物种被视为佛罗里达红曲霉组合(SectionFloridani)。其中佛罗里达红曲霉组合中的7个物种亲缘关系都较远,把它们分别视为独立物种无疑,但是广泛存在于我国的红色红曲霉组合中的物种来源复杂,其内物种多样性问题值得深入研究[10-11,26]。本研究中在同条件下培养对比SICC 3.292与RJL03发现其培养特征仍有差异。与BARBOSA等[16]的M.purpureus对比存在较大差别,故本研究倾向于大多数学者的观点,仍视M.sanguineus为独立物种[23,25,27-29]。
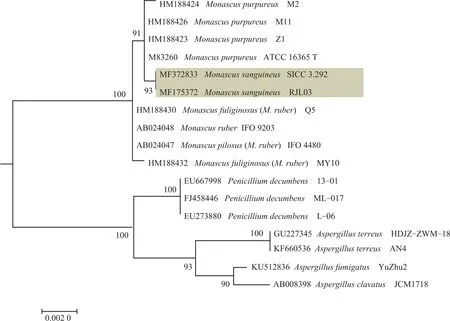
图3 基于18S rDNA序列的RJL03与SICC 3.292进化树Fig.3 Maximum likelihood tree based on RJL03 and SICC 3.292 18S rDNAgene sequences

图4 基于ITS rDNA序列的RJL03与SICC 3.292进化树Fig.4 Maximum likelihood tree based on RJL03 and SICC 3.292 ITS rDNAgene sequences
目前关于M.sanguineus所产红色素的应用研究还不是很多,有如RASHMI等采用响应面法对其液态发酵产色素条件进行优化,红色素产量可达55.67 CVU/mL[11],并对其作为天然红色素潜在来源进 行 了 探 索[30]。 稻 属 植 物(Oryzaspp.)是M.sanguineus好的固态发酵底物,该红色素有革兰氏阳性细菌的抑菌活性,可产生霉桔素(citrinin)[31]。另外,笔者也对该菌作为天然红色素的来源进行了探索,发现其固态培养菌丝中红色素提取液最大吸收波长在515 nm处[17],而液态发酵液中水溶性色素成分不单一,最大吸收波长在474 nm处[32],色素产量较高,存在进一步进行固态发酵或液态发酵研究其产红色素最佳条件的价值。
本研究从购自河南焦作人工种植的怀地黄中初步分离得到了13株植物内生真菌,这些真菌包括青霉属(Penicilliumsp.)、曲霉属(Aspergillussp.)、木霉属(Trichodermasp.)等,并且首次从怀地黄中分离鉴定得到了Monascus sanguineus描述种,拓宽了红曲霉属菌种资源的来源。初步探讨了M.sanguineus与M.purpureus的关系,认为M.sanguineus应为独立物种,以期为红曲霉属菌种资源的分类鉴定及开发利用提供理论依据。
参考文献(References):
[1]徐春明,王晓丹,焦志亮.食用微生物色素的研究进展.中国食品添加剂,2015(2):162-168.XU C M,WANG X D,JIAO Z L.Research progress of edible pigments by microorganisms.China Food Additives,2015(2):162-168.(in Chinese with English abstract)
[2]张水军,张军兵,熊勇.天然食用色素的研究进展.中国食品添加剂,2014(8):172-177.ZHANG S J,ZHANG J B,XIONG Y.Research advances of natural food pigment.China Food Additives,2014(8):172-177.(in Chinese with English abstract)
[3]周文斌,贾瑞博,李燕,等.红曲色素组分、功效活性及其应用研究进展.中国酿造,2016,35(7):6-10.ZHOU W B,JIA R B,LI Y,et al.Research progress of components,biological activity and application ofMonascuspigment.Forum and Summary,2016,35(7):6-10.(in Chinese with English abstract)
[4]贾氏臣,孟金明,穆红霞,等.红曲菌发酵产物中的新功能性成分及功效的研究进展.中国食品添加剂,2015(4):179-184.JIASC,MENGJM,MUHX,etal.Advancesofnewfunctional ingredients and efficacy onMonascusfermented products.China Food Additives,2015(4):179-184.(in Chinese with English abstract)
[5]邢晓科.药用植物内生真菌资源:一个亟待开发的宝库.菌物学报,2018,37(1):14-21.XING X K.Endophytic fungal resource of medicinal plants:a treasure need to be developed urgently.Mycosystema,2018,37(1):14-21.(in Chinese with English abstract)
[6]郭顺星.药用植物内生真菌研究现状和发展趋势.菌物学报,2018,37(1):1-13.GUO S X.The recent progress and prospects of research on endophytic fungi in medicinal plants.Mycosystema,2018,37(1):1-13.(in Chinese with English abstract)
[7]国家药典委员会.中华人民共和国药典:一部.北京:中国医药科技出版社,2015:124-125.Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China:1st part.Beijing:China Medical Science Press,2015:124-125.(in Chinese)
[8]杨清香,谢永生,张昊,等.怀地黄活性内生菌的分离鉴定及抗菌抗肿瘤活性.微生物学通报,2010,37(10):1467-1474.YANG Q X,XIE Y S,ZHANG H,et al.Isolation,identification and antagonism on microorganisms and cancer cells by active endophytes fromRehmannia glutinosaLibosch.Microbiology China,2010,37(10):1467-1474.(in Chinese with English abstract)
[9]元辉明,朱金华,马广强.地黄内生菌的分离鉴定及其抑菌活性测定.江西中医药大学学报,2015,27(1):86-88.YUAN H M,ZHU J H,MAG Q.Isolation,identification and antibacterial activities of endophytes in freshRehmannia.Journal of Jiangxi University of Traditional Chinese Medicine,2015,27(1):86-88.(inChinesewithEnglishabstract)
[10]CANNON P F,ABDULLAH S K,ABBAS B A.Two new species ofMonascusfrom Iraq,with a key to known species of the genus.Mycological Research,1995,99(6):659-662.
[11]RASHMI D,PADMAVATHI T.Statistical optimization of pigment production byMonascus sanguineusunder stress condition.Preparative Biochemistry&Biotechnology,2014,44(1):68-79.
[12]王柱,宋萍,张晓娟,等.红曲霉菌种资源的收集及标准化整理.食品与发酵科技,2012,48(3):10-12.WANG Z,SONG P,ZHANG X J,et al.Collection and standardized arrangement of resources forMonascusstrains.Food and Fermentation Technology,2012,48(3):10-12.(in Chinese with English abstract)
[13]孙艳君.红曲中红曲菌的分离、鉴定及产色素的研究.武汉:武汉工业学院,2011:9-18.SUN Y J.Isolation,identification and pigment production research ofMonascusfrom red yeast rice.Wuhan:Wuhan Polytechnic University,2011:9-18.(in Chinese with English abstract)
[14]许璐.分子标记技术在红曲菌菌种鉴别中的应用.武汉:华中农业大学,2007:19-30.XU L.Application of molecular markers for the identification strains inMonascusspp.Wuhan:Huazhong Agricultural University,2007:19-30.(in Chinese with English abstract)
[15]邢旺兴,苏国同,王晓明.关于红曲霉分类地位的认识.解放军药学学报,2004,20(2):119-121.XING W X,SU G T,WANG X M.Knowledge about the status ofMonascustaxa.Pharmaceutical Journal of Chinese People’s Liberation Army,2004,20(2):119-121.(in Chinese)
[16]BARBOSA R N,LEONG S L,VINNERE-PETTERSSON O,et al.Phylogenetic analysis ofMonascus,and new species from honey,pollen and nests of stingless bees.Studies in Mycology,2017,86:29-51.
[17]何亚涛,高丹丹,郑田留,等.产红色素真菌Monascus sanguineus的分离及其色素提取条件研究.天然产物研究与开发,2017(11):1952-1958.HE Y T,GAO D D,ZHENG T L,et al.Isolation and extraction optimization of red pigment fromMonascus sanguineus.Natural Product Research and Development,2017(11):1952-1958.(in Chinese with English abstract)
[18]QIU M,XIE R S,SHI Y,et al.Isolation and identification of endophytic fungus SX01,a red pigment producer fromGinkgo bilobaL.World Journal of Microbiology and Biotechnology,2010,26(6):993-998.
[19]王晓敏,王惠,刘天行,等.一株不产生孢子的盐生海芦笋内生真菌鉴定.食品科学,2013,34(17):146-149.WANG X M,WANG H,LIU T X,et al.Identification of sterile endophytic fungus isolated fromSalicornia bigelovii.FoodScience,2013,34(17):146-149.(in Chinese with English abstract)
[20]KUMAR S,STECHER G,TAMURA K.MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets.Molecular Biology&Evolution,2016,33(7):1870-1874.
[21]DANIELE S,INGO M.raxmlGUI:a graphical front-end for RAxML.Organisms Diversity&Evolution,2012,12(4):335-337.
[22]魏景超.真菌鉴定手册.上海:上海科学技术出版社,1979:129-134.WEI J C.Fungal Identification Manual.Shanghai:Shanghai Science and Technology Press,1979:129-134.(in Chinese)
[23]李钟庆.红曲霉属的一个新种.微生物学报,1982,22(2):118-122.LI Z Q.A new species of the genusMonascus.Acta Microbiologica Sinica,1982,22(2):118-122.(in Chinese with English abstract)
[24]LI Z Q,GUO F.A further studies on the species ofMonascus.Mycosystema,2004,23(1):1-6.
[25]WEI Y H,HSIEH S Y,YUAN G F,et al.Re-identification ofMonascusstrains based on molecular and morphological characteristics.Fungal Science,2012,27(2):139-145.
[26]MANAN M A,SAMAT N,KASRAN M,et al.Proximate and amino acids composition ofMonascusfermented products with potential as functional feed ingredients.Cogent Food&Agriculture,2017,3(1):1295767.
[27]PARK H G,JONG S C.Molecular characterization ofMonascus,strains based on the D1/D2regions of LSU rRNA genes.Mycoscience,2003,44(1):25-32.
[28]SHAO Y C,LEI M,MAO Z J,et al.Insights intoMonascus,biology at the genetic level.Applied Microbiology&Biotechnology,2014,98(9):3911-3922.
[29]CHEN W P,HE Y,ZHOU Y X,et al.Edible filamentous fungi from the speciesMonascus: early traditional fermentations,modern molecular biology,and future genomics.Comprehensive Reviews in Food Science&Food Safety,2015,14(5):555-567.
[30]RASHMID,PADMAVATHIT.ExploringMonascus sanguineusas a potential natural source for pigment production.International Research Journal of Biological Sciences,2013,2(5):59-67.
[31]DIKSHIT R,TALLAPRAGADA P.Comparative study ofMonascus sanguineusandMonascus purpureusas potential sources for red pigment production.International Journal of Pharma&Bio Sciences,2012,3(4):885-895.
[32]何亚涛,刘俊林,郑青波,等.产红色素真菌Monascussanguineus的液态发酵条件研究.天然产物研究与开发,2018(3):438-443.HE Y T,LIU J L,ZHENG Q B,et al.Optimization of flask fermentation conditions for the production of red pigment fromMonascus sanguineus.Natural Product Research and Development,2018(3):438-443.(in Chinese with English abstract)

