国产盐酸林可霉素滴眼液的质量评价
王强 李香荷 高燕霞 庞文哲
(河北省药品检验研究院,石家庄 050000)
盐酸林可霉素为林可酰胺类抗生素,临床主要用于由革兰阳性菌引起的各种感染。1962年,由美国人Mason在链霉菌林可变种培养液中获得[1],1975年我国开始批量生产。国内现有剂型包括:片剂、胶囊剂、注射剂、滴眼液和滴耳液。
盐酸林可霉素滴眼液对革兰阳性菌如葡萄球菌属(包括耐青霉素株),链球菌等有较高抗菌活性。对少数阴性菌也有良好抗菌活性。主要不良反应有:(1)皮疹、瘙痒等过敏反应;(2)过量使用并吸收可致中性粒细胞减低,血小板减低,念珠菌感染等;(3)耳鸣、眩晕等。
盐酸林可霉素原料质量标准收载于美国药典(USP)41、欧洲药典(EP)9.0、BP2017和中国药典2015年版二部;滴眼液仅中国药典2015年版二部收载。
盐酸林可霉素滴眼液为2017年度国家食品药品监督管理总局的国家药品计划抽验品种。本文在完成法定标准检验的基础上,结合探索性研究对检验结果进一步分析,进而对国产盐酸林可霉素滴眼液的质量现状进行评价,并从安全性和有效性角度对企业生产工艺和现行法定标准提出建议。
1 仪器与试药
1.1 仪器
2DLC/LCMS-IT-TOF离子阱-飞行时间质谱仪(日本岛津公司)。LC-20AT液相色谱仪(日本岛津公司)。Mettler Toledo型电子天平(Mettler公司)。Mettler Seveneasy酸度计(Mettler公司)。
1.2 试药
林可霉素对照品(批号:130432-201510,85.5%)、苯甲酸钠对照品(批号:100433-201702,99.7%)、羟苯乙酯对照品(批号:100847-201604,99.9%)、苯扎溴铵对照品(批号:135051-201401,含苯扎溴铵10.9mg/mL)、硫柳汞钠对照品(批号:135050-201401, 94.6%)均由中国食品药品检定研究院提供。丙烯基类似物和Z-异构体、α-酰胺基差向异构体林可霉素、N-去甲基林可霉素均由TLC公司提供。
试剂均为分析纯,水为超纯水。
1.3 样品
共抽验盐酸林可霉素滴眼液57批次,涉及生产企业4家,批准文号4个。抽样覆盖了全国21个省、自治区和直辖市。本次抽样样品能代表国内本品种目前的生产和使用状况,对其进行检验和统计分析,结果能较好地反映目前国产盐酸林可霉素滴眼液的质量现状。
2 试验方法
2.1 法定标准检验
按照中国药典2015年版二部进行检验。
2.2 探索性研究
通过调研,了解该品种处方及生产工艺、掌握大量与本品质量相关的信息,探索性研究主要根据法定检验结果,围绕药品安全性、有效性和质量可控性开展以下研究:抑菌剂使用的合理性研究、杂质谱研究、有关物质方法修订、抑菌剂检测方法修订等。上述探索性研究LC-MS/MS条件为:
一维液相条件:色谱柱为Phenomenex Luna 5u C18(4.6mm×250mm, 5μm);柱温:50℃;流速:1.0mL/min;进样量:10μL;流动相:pH6.1缓冲液(取磷酸34g,溶于900mL水中,用浓氨水调节pH值至6.1,加水稀释至1000mL)-甲醇-乙腈(77:8:15,V∶V∶V),等度洗脱。
二维液相条件:色谱柱为Phenomenex Luna 5u C18(4.6mm×250mm, 5μm);柱温:50℃;流速:0.3mL/min;流动相:水-乙腈(40:60, V∶V),等度洗脱。
质谱条件:离子源:ESI(+);检测器电压:1.65kV;雾化气:氮气1.5L/min;干燥气:氮气10L/min;脱溶剂管温度:200℃;加热模块温度:200℃。
3 结果与讨论
3.1 法定检验结果
依据中国药典2015年版二部检验,57批次盐酸林可霉素滴眼液全部合格,合格率100%。对与产品质量紧密相关的主要检查项目如pH值、有关物质、抑菌剂、含量结果进行了统计分析。
3.1.1 pH值
57批次样品pH值检测结果在5.7~6.4之间,经比较,A、C、D企业样品pH值的批间差异不大,极差为0.2,RSD为0.7%~1.4%。B企业样品个别批次pH值与平均值偏离较大,最低pH值5.7,最高pH值6.4,平均值为6.1, RSD为2.5%,提示B企业工艺稳定性和控制水平还需要进一步提高和改进。
3.1.2 有关物质
57批次样品中相对保留时间约为0.72的杂质为0.1%~0.4%,均未超过标准规定的0.5%,A企业样品中2批次和D样品3批次该杂质为0.1%,其他批次差异不大,为0.3%~0.4%。其他单个杂质为0.2%~0.4%,仅1批次(A企业样品)最大单个杂质为0.6%,与其他批次差异较大,也导致了该批次杂质总量最高,为1.1%。其他样品杂质总量为0.3%~0.8%。
检测中发现,A企业样品在主峰相对保留时间0.16和0.25处有两个较大杂质峰(分别命名为降解杂质1和降解杂质2),见图1,含量分别为0.2%~0.8%和0.8%~1.1%。现行标准规定,有关物质在相对保留时间0.27之前的杂质应作为辅料扣除。采用该企业提供的辅料进样,发现在相同保留时间处辅料峰面积远远小于样品中杂质峰面积,分别为0.06%~0.1%和0.3%~0.4%。因此,上述杂质为制剂生产过程中产生,应作为有关物质杂质计算,现行标准中按辅料峰扣除,存在缺陷。
3.1.3 抑菌剂
现行标准规定了3种抑菌剂的检验,分别为苯甲酸钠、苯扎溴铵与羟苯乙酯。本次抽验样品中共抽到D样品5批次,羟苯乙酯含量为85.6%~102.9%。C样品6批次,苯甲酸钠含量为93.4%~102.1%。未抽到采用苯扎溴铵作为抑菌剂的样品。检验中发现,现行标准中规定的对照品溶液的浓度和供试品溶液的浓度差异较大,对照品溶液浓度过高,易造成色谱柱过载,计算结果误差较大,需作进一步改进。
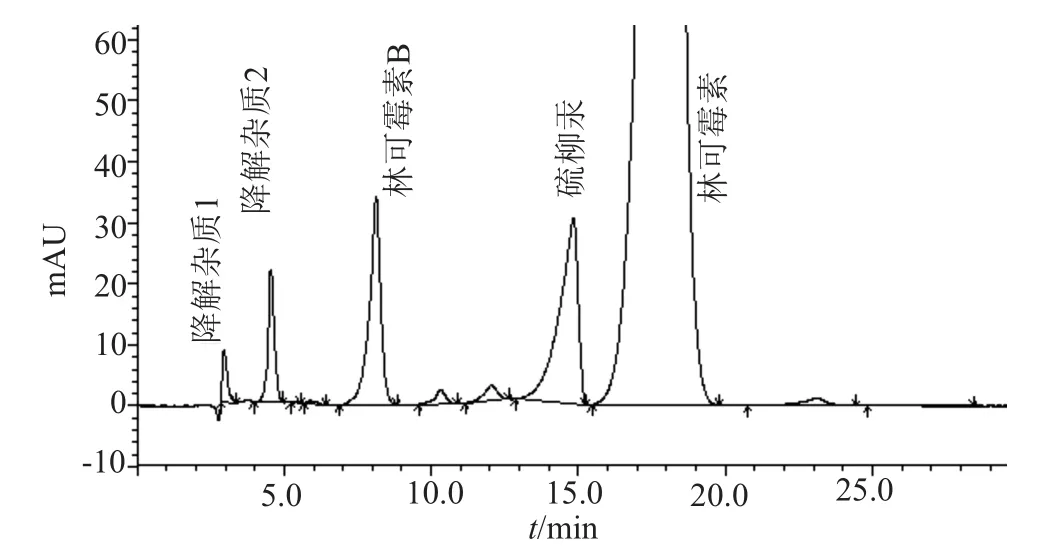
图1 A企业样品有关物质典型HPLC图谱Fig.1 HPLC chromatogram of the a company samples
此外,本次抽样最多的A、B企业共46批样品均采用硫柳汞作为防腐剂,现行标准未作检测要求,质量不可控。相关文献表明[2],含汞化合物可以抑制细胞内的多种酶,特别是活性中心为巯基的酶,可以多路径破坏细胞代谢,造成细胞严重损伤。A、B企业对硫柳汞的使用是否做到合理使用,需进一步研究。
3.1.4 含量测定
5 7批次样品的含量按标示量计均在95.4%~102.8%范围内,平均值为98.9%,总体服从正态分布。对不同企业的样品含量测定结果进行分析,A企业平均含量为99.2%,RSD为1.7%;B企业平均含量为98.6%,RSD为1.3%;C企业平均含量为97.5%,RSD为1.0%;D企业平均含量为99.9%,RSD为2.1%;各企业样品平均含量差异不大,D企业的数据离散程度相对较大,提示该企业的投料量稳定性欠佳。
3.2 探索性研究
通过现行标准检验,发现盐酸林可霉素滴眼液在抑菌剂的使用及杂质控制方面存在较大问题。
3.2.1 抑菌剂使用的合理性研究
(1)处方合理性分析:本次抽验涉及的4家企业使用了3种抑菌剂,分别为硫柳汞、苯甲酸钠和羟苯乙酯,见表1。辅料包括氯化钠(渗透压调节)、氢氧化钠、硼砂、磷酸二氢钠、三乙醇胺等。分析可知,A、B企业的样品中硫柳汞与氯化钠存在配伍禁忌[3],导致滴眼液中硫柳汞不稳定,降解产生杂质,存在安全隐患。C、D样品未发现配伍禁忌。
此外,对比发现A企业处方未遵循中国药典规定的抑菌剂选择最低有效原则,已有文献报道[4],滴眼液中硫柳汞含量为0.02mg/mL时其抑菌效力即可达到药典要求,A企业硫柳汞加入量为该有效抑菌浓度的10倍。硫柳汞对眼部组织的伤害不容小视,已有文献表明[5],含0.01%~0.1%硫柳汞的GBR(谷胱甘肽碳酸氢钠林格氏液)灌注角膜,角膜厚度快速和立即增加,1h内内皮细胞坏死,长期使用可能引起内皮功能和结构损害。因此,A企业抑菌剂加入量过高,处方欠缺合理性。
(2)生产工艺的影响:各企业均采用称量、配制、过滤、灌装、检验、包装、入库等工艺流程,主要区别在于药液配制环节的温度控制。A企业配制温度为80℃,辅料溶解后直接投入原料,搅拌溶解,自然冷却(约24h),再经灌装,检验合格后入库。B、C、D企业的溶解温度较低,为35~60℃。
采用中国药典2015年版二部的有关物质检查方法,结果表明,盐酸林可霉素在常温条件下非常稳定,水溶液96h内不会产生新的杂质。在80℃下24h,也无明显杂质产生。而硫柳汞稳定性差,在常温下即发生降解,经96h降解为84.7%,降解杂质2为0.02%,降解杂质1为0.5%。在80℃下,硫柳汞快速降解,经24h,降低至72.6%。可见,A企业配制温度选择不合理,过高的温度会加剧硫柳汞降解,产生降解杂质,存在安全风险。
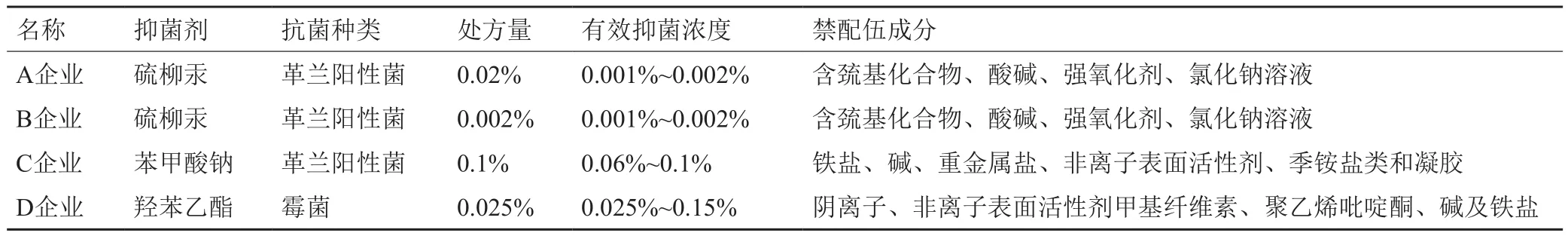
表1 各企业使用抑菌剂的作用机制、抗菌活性及配伍禁忌Tab.1 Mechanism of action of bacteriostat, antibacterial activity and incompatibility
(3)硫柳汞含量及抑菌效力测定:针对现行标准中检测指标的缺失,采用中国药典2015年版二部的抑菌剂检查方法,对A、B企业共46批次样品的硫柳汞含量进行了测定:A企业25批次样品,7批次合格,合格率28%,硫柳汞含量为54.4%~84.1%,结果离散性较大,可见处方和工艺参数的不合理对药品质量产生了严重影响;B企业21批次样品,16批次合格,合格率76.2%,硫柳汞含量为76.3%~84.5%。结果表明,两家企业的硫柳汞在样品中均已经发生降解,数据统计见图2。
参照中国药典通则1121抑菌效力检查法,选取不合格产品进行抑菌效力定,结果表明,虽然硫柳汞已经部分降解,但由于加入量过高,其抑菌效力仍可达到药典要求。
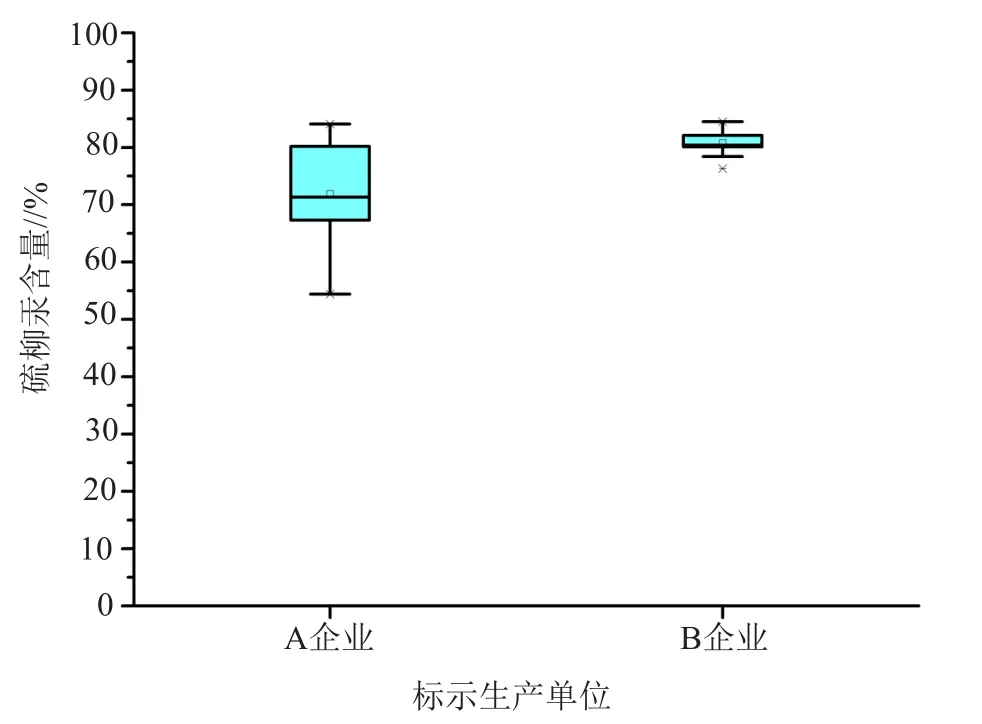
图2 硫柳汞含量测定数据统计Fig.2 Boxplots of the thiomersal content
(4)硫柳汞降解杂质的LC-MS/MS测定:采用A企业提供的辅料,将氯化钠与硫柳汞按照处方量进行混合,考察硫柳汞降解杂质产生的原因及变化情况。结果表明,常温条件下氯化钠与硫柳汞的反应较为强烈,硫柳汞快速降解,混合后含量降解至94.9%,并产生降解杂质2,含量为0.5%;在产生降解杂质2后,反应继续进行,24h降解杂质2含量逐步减少,产生降解杂质1和其他杂质;96h,硫柳汞降解为47.3%,降解杂质2含量降低为0.3%,降解杂质1增加为2.6%,并产生其他杂质,详见图3。
采用LC-MS/MS法测定并验证杂质的结构,结果发现,降解杂质2的一级质谱(m/z 304.8[M-H]-,153[M-C7H5O2S]+)与2,2'-二硫代二苯甲酸对照品质谱图一致,推断该杂质为2,2'-二硫代二苯甲酸,详见图4。
参考相关文献方法[6],在硫代水杨酸溶液中加入双氧水进行氧化,氧化产物为2-亚磺基苯甲酸,将此溶液作为对照品溶液进样,与样品中降解杂质1保留时间相同。降解杂质1的一级质谱(m/z 184.9[M-H]-,120[M-SO2H]+)与该溶液质谱图一致,推断降解杂质1为2-亚磺基苯甲酸,见图5~6。
根据上述结果,推测反应过程为:硫柳汞在氯化钠存在的条件下,分解为硫代水杨酸和氯化乙基汞。硫代水杨酸不能稳定存在,经氧化生成较为稳定的2,2'-二硫代二苯甲酸。2,2'-二硫代二苯甲酸在乙基汞的作用下,一部分分解转化为硫柳汞,另一部分经两步氧化转化为2-亚磺基苯甲酸,见图7。

图3 硫柳汞及降解杂质变化情况Fig.3 Statistics on changes in thimerosal and impurities

图4 降解杂质2一级质谱图Fig.4 The MS1 of impurity 2

图5 硫代水杨酸经氧化后质谱图Fig.5 The MS1 of oxidation of thiosalicylic acid solution

图6 样品中降解杂质1质谱图Fig.6 The MS1 of impurity 1
(5)处方中硫柳汞的合理性:A、B企业处方中使用硫柳汞作为抑菌剂不合理,硫柳汞与氯化钠存在配伍禁忌,造成硫柳汞降解产生2,2'-二硫代二苯甲酸和2-亚磺基苯甲酸。A企业在处方中添加0.02%硫柳汞,为B企业处方量10倍,加入量过高,存在安全隐患,并且在配制工艺温度80℃条件下,加速硫柳汞降解,造成降解杂质超出现行标准有关物质限度。眼用药物中抑菌剂对患者眼部的伤害作用已经引起临床广泛关注,汞类抑菌剂对人体组织的伤害不容小视。抗菌类滴眼液中使用汞类抑菌剂存在明显的安全性风险,应尽快从处方中去除。
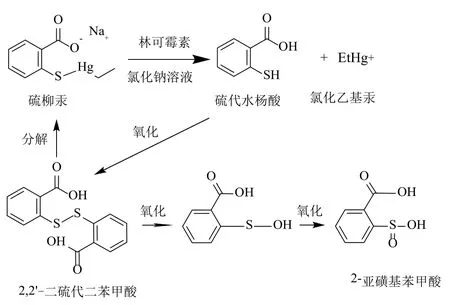
图7 推测硫柳汞降解反应示意图Fig.7 Proposed route of decomposition of thimerosal
3.2.2 杂质谱研究
(1)杂质谱建立:林可霉素在发酵过程中可能伴生的有关物质以及在过量酸性条件下的降解产物成分复杂,生产厂家不同,菌种不尽相同,导致杂质种类及含量也有所不同。
采用中国药典2015年版二部的有关物质检查方法,57批滴眼液样品及4家企业提供的盐酸林可霉素原料共检出7个主要杂质,见图8,其中林可霉素B为已知杂质,经分析不同企业样品有关物质的杂质谱,结果显示滴眼液杂质谱与原料杂质谱基本一致,各主要杂质均为原料引入,杂质含量无明显差异。
通过LC-MS/MS及与杂质对照品定位共确定4个杂质,分别为:N-去甲基林可霉素(N-desmethyl lincomycin)、α-酰胺基差向异构体(α-amide epimer)、丙烯基类似物和Z-异构体(propylidene analogues)。
(2)主要杂质溯源:通过强制降解实验,分析主要影响因素及杂质来源,见表2,降解试验条件如下:①碱破坏:取本品,加入5mol/L的氢氧化钠溶液2mL,在100℃水浴中加热30min后取出放冷至室温,加5mol/L的盐酸溶液2mL中和;②酸破坏:取本品,加入5mol/L的盐酸溶液2mL,在100℃水浴中加热10min后取出放冷至室温,加入5mol/L的氢氧化钠溶液2mL中和;③氧化破坏:取本品,加入10%过氧化氢溶液5mL,放置10min;④光照破坏:取本品,在4000Lx光强度下放置48h;⑤高温破坏:取本品,在60℃水浴中加热30min后取出放冷至室温。

图8 盐酸林可霉素有关物质杂质谱图Fig.8 The chromatogram of lincomycin hydrochloride in related substances
(3)杂质控制建议:盐酸林可霉素的主要杂质为杂质A和B。57批样品均检出上述两种杂质,经二元相关分析,发现杂质A和杂质B均与杂质总量呈正相关(P<0.01)。提示杂质A和B是本品的主要杂质,在生产过程或储存环境降解均可使其增加。
现行标准中已对杂质A进行控制。建议增加特定杂质B(丙烯基类似物和Z-异构体,相对保留时间1.2和1.3)的控制,使标准更加完善。由于本次抽验样品中杂质C(N-去甲基林可霉素)的量均小于0.05%,暂无控制的必要。
3.2.3 抑菌剂测定方法的完善
现行标准主要存在以下问题:①抑菌剂含量采用外标法计算,对照品溶液的浓度和供试品溶液的浓度差异较大,使计算结果产生较大误差。②抑菌剂种类的控制存在欠缺,本次抽验的57批次样品中46批次采用硫柳汞作为抑菌剂,所占比例较大,建议增加硫柳汞的检测。

表2 主要杂质溯源Tab.2 The impurity sources and results
(1)对照品溶液浓度的修订:在实际检验中发现,苯甲酸钠供试品溶液浓度(0.32mg/mL)和对照品溶液浓度(8mg/mL)相差较大。若按照药典规定的对照溶液浓度进样,会造成色谱柱过载,出现平头峰,严重影响计算的准确性。为减小误差,建议对现行标准进行修改,同时增加硫柳汞的检测,修订为“精密称取苯甲酸钠、苯扎溴铵、羟苯乙酯或硫柳汞对照品适量,加流动相溶解并稀释制成约含苯甲酸钠0.3mg/mL、苯扎溴铵0.lmg/mL、羟苯乙酯0.08mg/mL、硫柳汞0.01mg/mL的溶液,作为对照品溶液”。
(2)柱温的影响:现行标准抑菌剂检测方法(同含量、有关物质检测方法)未明确规定柱温,检验中发现硫柳汞峰保留时间受柱温影响较大,柱温不合适会导致硫柳汞峰与杂质峰或林可霉素峰重合,影响有关物质和含量的计算结果。采用不同品牌的色谱柱,对柱温进行考察,结果见表3。建议根据不同的色谱柱选择合适的柱温(40~50℃),确保硫柳汞峰与林可霉素峰及其他杂质的分离,避免对检测结果造成误差。
4 结论
本次药品评价性抽验结果显示,依照现行药典标准检验,全部57批样品均符合规定。但是部分企业处方中存在配伍禁忌,抑菌剂使用不合理,存在安全隐患。因此,国产盐酸林可霉素滴眼液总体质量状况“一般”。
建议中国药典标准进一步完善:(1)提高有关物质的控制水平,完善检测方法,明确色谱条件的柱温,并增加制定降解杂质B的控制限度。(2)修订抑菌剂检查中对照品溶液的配制浓度,减小误差,确保结果准确性。

表3 不同品牌色谱柱最佳柱温试验结果Tab.3 Results of optimum column temperature for different chromatographic columns
另外,建议A、B企业对处方及生产工艺进行完善:(1)选用其他类型抑菌剂代替硫柳汞,避免配伍禁忌产生杂质对人体造成危害。(2)严格控制抑菌剂的使用量,遵循最低有效原则,避免过量添加。(3)降低配液温度,避免工艺参数不合理造成杂质超标,将安全风险降至最低。

