鼠尾悬吊法小鼠抑郁模型的评价及其对下丘脑-腺垂体-甲状腺轴的影响
吕子成 赵富浩 陈力侨 王秋雨 王铮 刘孟琦 林来祥
1天津医科大学基础医学院 300070; 2国家卫生健康委员会激素与发育重点实验室(天津医科大学),天津市代谢性疾病重点实验室,天津医科大学代谢病医院内分泌研究所 300070
抑郁症是一种以心境低落为主要特征的显著而持久的心理障碍,其病因复杂且发病率逐年升高,目前全球约有15%的人或多或少地受到抑郁症的影响,预计至2020年,抑郁症将成为全球造成残疾的第二大疾病[1-2]。研究表明,抑郁症的发生与慢性应激密切相关,慢性不可预知温和应激模型是目前应用最广泛的抑郁症动物模型,但此模型实际操作过程的工作量较大,持续时间较长[3]。鼠尾悬吊法最早用于航天医学中骨质疏松模型的研究,后来发现,长期鼠尾悬吊作为一种持续的、中低水平的慢性应激,对免疫功能和中枢神经系统功能等都有影响[4-6]。亦有研究表明该模型可诱导大鼠出现抑郁症样行为[7]。然而,目前相关的研究仍然较少。甲状腺激素在机体新陈代谢、生长发育和维持中枢神经系统正常的兴奋性等方面具有重要作用。大量临床研究表明,抑郁症与下丘脑-腺垂体-甲状腺轴(HPT轴)功能异常密切相关,多数学者认为,甲状腺功能减退症是抑郁症的重要危险因素,抑郁症患者亦常合并甲状腺功能减退症。然而,亦有研究表明,抑郁症患者可有轻度的甲状腺功能亢进症,且对于抑郁症和HPT轴功能异常之间的因果关系和具体的作用机制,目前尚存在较大争议[8-11]。相关动物实验也进行的较少。本研究通过鼠尾悬吊法建立动物模型,根据动物行为学和下丘脑内单胺类神经递质水平,评价该抑郁症模型是否有效,并通过病理形态学和血清激素水平,探讨该模型对HPT轴功能的影响,为相关疾病的防治以及临床治疗提供理论依据。
1 材料与方法
1.1 实验动物与分组 健康昆明小鼠30只,购自中国人民解放军军事医学科学院实验动物中心,许可证号SCXK-(军)2012-0004,雌、雄各半,体重(26±2)g,适应性喂养3 d后,按照随机数字表法分为空白对照组、悬吊14 d组、悬吊28 d组,每组雌鼠、雄鼠各5只,12 h光照、12 h黑暗,自由饮食、饮水。按照文献所述方法建立动物模型[12]。空白对照组正常饲养,悬吊14 d组正常饲养14 d后进行鼠尾悬吊,悬吊28 d组分组后立刻进行鼠尾悬吊。定期观察各组行为、反应能力,进食及皮毛光泽等方面的差异。
1.2 测定指标与方法
1.2.1 强迫游泳实验 按照文献[13]所述方法,于实验28 d后,将各组小鼠放入水缸(2 000 ml烧杯, 高20 cm,直径14 cm,水深10 cm)中,调节水温23℃~ 25℃,每缸一只,置水中观察6 min,记录各小鼠后4 min内累计不动时间。
1.2.2 下丘脑5-羟色胺(5-HT)、去甲肾上腺素(NE)含量和单胺氧化酶(MAO)活力的测定 各组小鼠于实验开始28 d后处死,立刻在冰上打开颅骨,剥离下丘脑,于-80℃保存,称重,按重量(g)∶体积(ml)=1∶9的比例加入生理盐水,冰水浴条件下制备10%的匀浆,2 500 r/min(r=11 cm)离心,取上清液,弃去取组织过少的样本,每组均保留8个样本。采用双缩脲法测定蛋白含量(试剂盒购自南京建成生物工程研究所),采用ELISA法测定5-HT、NE含量(试剂盒购自北京百奥思科生物医学技术有限公司),采用紫外分光光度法测定MAO活力(试剂盒购自南京建成生物工程研究所),并用蛋白含量校正5-HT、NE含量和MAO活力。
1.2.3 血清FT3、FT4、促甲状腺激素(TSH)浓度的测定 各组小鼠股动脉放血后,收集血液,静置40 min,离心取上清液,弃去取血过少的样本,每组均保留8个样本,采用化学发光免疫分析法测定血清FT3、FT4浓度(试剂盒购自德国西门子公司),采用ELISA法测定血清TSH浓度(试剂盒购自北京百奥思科生物医学技术有限公司)。
1.2.4 甲状腺、垂体的形态学观察 各组小鼠处死后迅速取出甲状腺、垂体、海马,固定后石蜡包埋,常规切片,采用HE染色后于光镜下观察甲状腺、海马,采用三色染色后于光镜下观察垂体[14]。
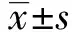
2 结果
2.1 一般状态 悬吊14 d组和悬吊28 d组在干预初期易激惹,常出现尖叫,随着悬吊时间延长,出现精神萎靡、反应迟钝的表现,皮毛光泽差,进食量减少,体重增长减慢,实验结束后,模型组活动减少,常蜷缩成团。实验过程中悬吊28 d组1只雌性小鼠死亡。实验结束后,模型组小鼠体重均显著低于空白对照组,各组实验前、后体重见表1。
2.2 强迫游泳实验 与空白对照组相比,悬吊14 d组和悬吊28 d组强迫游泳实验累计不动时间均显著延长(P<0.01),见表2。
2.3 下丘脑5-HT、NE含量和MAO活力 与空白对照组相比,悬吊14 d组下丘脑内5-HT和NE含量显著降低(P均<0.05),MAO活力有增高趋势;悬吊28 d组下丘脑5-HT和NE含量显著降低(P均<0.05),且5-HT降低幅度比悬吊14 d组更明显,MAO活力显著增加(P<0.05),见表3。
2.4 血清FT3、FT4、TSH水平 与空白对照组相比,悬吊14 d组和悬吊28 d组血清FT4水平显著降低(P<0.01),且悬吊28 d组降低幅度更大,空白对照组、悬吊14 d组、悬吊28 d组血清TSH浓度有依次升高趋势但无统计学意义,各组血清FT3水平无明显变化,见表4。
2.5 甲状腺、垂体病理形态变化 正常甲状腺实质内为圆形或类圆形的甲状腺滤泡,滤泡壁由单层立方上皮围成,腔内含有红色胶状物,滤泡上皮细胞的形态可随机能状况而改变,呈立方形、矮柱状或高柱状,滤泡间为少量间质。与空白对照组相比,悬吊14 d组甲状腺没有明显变化,悬吊28 d组可见甲状腺滤泡明显大小不均、形状各异,大滤泡上皮细胞变扁平,见图1(封3)。各组垂体组织无明显变化。
3 讨论
研究表明,应激可以激活下丘脑-腺垂体-肾上腺轴,使得机体适应应激状态,但长期处于不可逃避的应激状态时,由于下丘脑-腺垂体-肾上腺轴的持续性兴奋,可严重影响身心健康,从而出现抑郁症状,这是目前比较公认的慢性应激引起抑郁症的机制之一。鼠尾悬吊法通过长期给予动物慢性的刺激,使之长期处于慢性应激状态,进而造成一系列神经-内分泌系统的病理生理变化和情感障碍,从而建立抑郁症动物模型。陈怡西等[7]研究发现,悬吊14 d的大鼠可出现血清皮质酮和促肾上腺皮质激素水平升高,并出现空场实验运动减少等抑郁症样行为。本研究中,悬吊14 d组和悬吊28 d组出现了强迫游泳实验累计不动时间延长,一定程度上揭示了小鼠在无法逃避的持续刺激下产生了绝望情绪,也从动物行为学的角度证明了该模型的有效性[3]。研究表明,各种原因引起的下丘脑单胺类神经递质如5-HT、多巴胺、NE的含量减少,与抑郁症的发生密切相关,慢性不可预知温和应激模型大鼠下丘脑5-HT含量明显减少,且经过有效的抗抑郁症治疗后,抑郁症大鼠下丘脑5-HT含量可以恢复[15]。MAO能够分解单胺类神经递质,抑制MAO的药物已经成为临床上应用的经典抗抑郁症药物[16]。本研究中,悬吊14 d组和悬吊28 d组小鼠出现了不同程度的下丘脑5-HT和NE含量减少以及MAO活力增加,这可能是模型组小鼠抑郁样行为出现的原因之一。
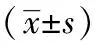
表1 空白对照组、悬吊14 d组、悬吊28 d组实验前后体重比较
注:与空白对照组相比,aP<0.01
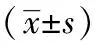
表2 空白对照组、悬吊14 d组、悬吊28 d组累计不动时间比较
注:与空白对照组相比,aP<0.01
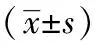
表3 空白对照组、悬吊14 d组、悬吊28 d组下丘脑5-HT、NE含量和MAO活力比较
注:NE:去甲肾上腺素;5-HT:5-羟色胺;与空白对照组相比,aP<0.05
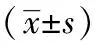
表4 空白对照组、悬吊14 d组、悬吊28 d组血清甲状腺激素水平比较
注:TSH:促甲状腺激素;与空白对照组相比,aP<0.01,bP<0.05
悬吊14 d和悬吊28 d的小鼠,在动物行为学和下丘脑单胺类神经递质含量等方面,均出现了与经典的抑郁症动物模型相似的变化。鼠尾悬吊法建立抑郁模型简单有效,对抑郁症的机制和诊疗方式的进一步研究具有一定的意义。
甲状腺激素不仅对机体新陈代谢和生长发育具有重要的调节作用,亦是调节中枢神经系统兴奋性的重要物质,与情感、精神、记忆等功能密切相关。大量的研究表明,临床上抑郁症患者常合并甲状腺功能异常,较多报道显示抑郁症患者,尤其是女性和老年人,易存在血清FT3、FT4水平降低和TSH水平升高[8]。甲状腺功能的筛查可以作为抑郁症患者的常规评估,然而,也有部分研究者认为,抑郁症患者存在血清FT4水平升高和TSH水平降低,抗抑郁症治疗后血清FT4水平则有所下降[9-10]。关于抑郁症对HPT轴功能影响的动物实验目前较少,且结论亦存在类似的争议。有研究认为,慢性不可预知温和应激抑郁模型使得大鼠血清T3和T4水平降低以及TSH水平升高[17]。也有研究者用完全相同的模型得出了相反的结论,即抑郁症大鼠血清T3和T4水平升高以及TSH水平降低,且抗抑郁症治疗可使这些异常的指标不同程度地恢复正常[18-19]。
本研究中采用鼠尾悬吊法建立抑郁症模型,悬吊14 d组出现了抑郁症样行为和下丘脑单胺类神经递质的减少,与此同时,小鼠的甲状腺功能也发生了变化,表现为血清FT4水平降低和TSH水平升高,悬吊28 d组下丘脑单胺类神经递质和血清FT4、TSH的变化则更加明显,同时,小鼠的甲状腺组织出现了光镜下可见的病理变化。悬吊28 d组的甲状腺滤泡大小不均匀,较大滤泡的上皮细胞变扁平,提示甲状腺功能减退,新生的较小的滤泡增多体现了在TSH作用下甲状腺功能的代偿。血清甲状腺激素水平受垂体TSH的调节,TSH可促进甲状腺滤泡上皮细胞增生以及合成和释放甲状腺激素,甲状腺激素又可以作用于垂体,抑制细胞分泌TSH。因而临床上甲状腺功能减退症患者除了血清甲状腺激素水平降低之外,还有TSH水平的升高。本研究中,悬吊14 d组和悬吊28 d组均出现了上述变化,与临床上伴有甲状腺功能减退症的抑郁症患者较为一致。而与空白对照组相比,悬吊14 d组和悬吊28 d组血清FT3水平并没有明显变化,可能是由于脱碘酶的活力增强,代偿性增加T4向T3转化的结果。
抑郁症与HPT轴功能紊乱之间的关系和相互作用机制十分复杂。研究表明,5-HT可抑制TSH释放激素的分泌[18]。抑郁模型小鼠下丘脑5-HT水平降低,可以通过增加TSH释放激素的分泌,引起TSH水平升高,该机制可能参与了抑郁症时甲状腺功能减退的代偿。值得关注的是,HPT轴功能紊乱不仅是抑郁症的一种合并症,其本身亦参与了抑郁症的发生、发展。动物实验证明,注射T3能够提高大鼠5-HT水平,甲状腺功能减退症会造成5-HT的分泌减少,并且会通过改变中枢神经系统内5-HT受体的敏感性,抑制由5-HT介导的神经元之间的信号转导[20]。因而,甲状腺功能减退症或许通过影响中枢神经系统内5-HT的含量和功能,促进抑郁症的发生、发展,形成一种恶性循环。本研究中,悬吊14 d组下丘脑内MAO活力仅出现增加趋势时,其5-HT水平已经出现了显著降低,提示可能存在独立于MAO活力变化的其他机制,造成5-HT的减少,或许与T4的减少有关。
综上所述,鼠尾悬吊法建立小鼠的抑郁模型有效,且该模型可造成HPT轴功能紊乱,表现为小鼠HPT轴功能降低,但尚可通过增加T4向T3的转化而代偿,其具体机制还有待进一步的研究。

