维生素D缺乏对雌性大鼠糖脂代谢及卵巢形态功能的影响
袁昕 高四书 罗凯明 项守奎 华飞
苏州大学附属第三医院内分泌科,常州 213003
维生素D是一种类固醇激素,通过与靶细胞维生素D受体(VDR)结合发挥生物学作用,经典作用是调节钙、磷代谢[1]。近年来全世界人群维生素D缺乏越来越普遍,随着研究的深入,已发现维生素D与肿瘤、心血管疾病、自身免疫性疾病、糖尿病等的发生和发展密切相关,还有研究表明维生素D可调节女性生殖过程[2-5]。
研究发现,敲除VDR基因或维生素D活化所需的1α-羟化酶基因的小鼠,除有低钙、低磷及佝偻病样表现外,还出现性激素紊乱、卵泡生成受损、子宫发育不全、不育等,而补充钙、磷后可纠正生殖异常,因此认为,维生素D对雌鼠生育系统的影响是通过调节钙、磷水平实现的[6]。本研究拟建立正常钙、磷水平的维生素D缺乏大鼠模型,观察维生素D对雌性大鼠代谢、性激素、卵巢形态及功能的直接影响。
1 材料与方法
1.1 实验动物 48只健康SPF级3周龄Sprague-Dawley(SD)雌性大鼠,体重(59.0±7.1)g,由江苏常州卡文斯实验动物有限公司提供[许可证号:SCXK(苏)2016-0010,合格证编号:201821081]。饲养环境:12 h白炽灯光照/12 h夜晚,温度22℃,湿度50%~60%,大鼠自由饮食、饮水。适应性喂养1周后,将大鼠按随机数字法随机分为对照组(n=24)和维生素D缺乏组(n=24),分别予标准饲料、维生素D缺乏饲料喂养。标准饲料(按AIN-93标准配方生产,维生素D1 000 IU/kg,0.5%钙,0.3%磷)和维生素D缺乏饲料(几乎不含维生素D,2%钙,1.2%磷)由江苏南通特洛菲饲料公司提供。
1.2 试剂 25-羟维生素D[25(OH)D]检测试剂盒购自上海罗氏诊断产品公司。睾酮、雌二醇、孕酮、黄体生成素(LH)、卵泡刺激素(FSH)检测试剂盒购自南京建成生物科技公司。抗苗勒管激素(AMH)检测试剂盒购自Cusabio公司。大鼠胰岛素ELISA试剂盒购自美国Millipore公司。
1.3 实验方法 每周检测摄食量及体重变化。第6、14、22周两组分别按随机数字法取8只大鼠,每日行阴道涂片,在显微镜下观察,记录涂片中的细胞类型,判断动情周期的阶段,共14 d。第8、16、24周,将已观察动情周期的大鼠禁食12 h,戊巴比妥钠麻醉后打开腹腔,腹主动脉取血,摘取双侧卵巢。血标本离心后收集血清,于-80℃保存。卵巢组织用4%甲醛溶液固定,常规石蜡包埋,沿卵巢长轴最大截面切片,HE染色后光镜下观察病理学结构。大鼠血清室温复溶后用全自动生化分析仪检测空腹血糖、甘油三酯、总胆固醇、血钙、血磷,ELISA法检测空腹胰岛素、睾酮、雌二醇、孕酮、LH、FSH、AMH,电化学发光法检测25(OH)D水平。计算稳态模型评估-胰岛素抵抗指数(HOMA-IR)=空腹血糖×空腹胰岛素/22.5。
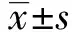
2 结果
2.1 大鼠血清25(OH)D、血钙、磷的比较 第8、16、24周维生素D缺乏组血清25(OH)D水平均显著低于对照组(t=9.69、3.69、4.04,P均<0.05)。3个时间点两组血钙、磷水平差异无统计学意义,见图1。
2.2 大鼠体重及血脂、血糖、胰岛素、HOMA-IR的比较 维生素D缺乏组与对照组的体重差异无统计学意义。第8周时两组甘油三酯、空腹血糖、空腹胰岛素、HOMA-IR差异无统计学意义,第16、24周维生素D缺乏组血清甘油三酯、空腹血糖、空腹胰岛素、HOMA-IR均较对照组升高(t=-2.45、-2.50、-3.08、2.93、-4.02、-3.94、3.87、3.86,P均<0.05)。3个时间点两组血清总胆固醇水平差异无统计学意义,见图2。
2.3 大鼠性激素水平的比较 维生素D缺乏组血清睾酮、雌二醇、孕酮、LH与对照组相比均无明显差异。第8、16周两组大鼠FSH水平无显著差异,第24周维生素D缺乏组FSH水平较对照组显著降低(t= 2.35,P<0.05)。3个时间点维生素D缺乏组LH/FSH比值均高于对照组(t=-2.29、-2.45、-3.12,P均<0.05),见图3。


表1 大鼠动情周期各阶段持续时间的比较
2.4 大鼠血清AMH水平的比较 第8、16、24周维生素D缺乏组AMH水平均较对照组升高(t=-2.54、-2.99、-2.39,P均<0.05),见图4。
2.5 动情周期 第8、16、24周两组的动情前期、动情期、动情后期、动情间期持续的时间差异没有统计学意义,见表1。
2.6 卵巢形态 对照组和维生素D缺乏组的卵巢切片均可见处于各个发育阶段的卵泡和黄体,还可见囊状扩张的卵泡,见图5(封3)。通过对各阶段卵泡计数并比较,发现第24周维生素D缺乏组卵巢的囊状卵泡数量显著高于对照组(P<0.05),见表2。

表2 大鼠囊状卵泡数量的比较(个,
2.7 相关性分析 相关性分析的结果显示,血清25(OH)D水平与甘油三酯水平和LH/FSH比值呈负相关(r=-0.378、 -0.362,P均<0.05);但与总胆固醇、睾酮、雌二醇、孕酮、LH、FSH及AMH没有显著相关性(P均>0.05)。
3 讨论
维生素D缺乏往往合并钙、磷水平降低,既往有研究对敲除VDR基因或1α-羟化酶基因的小鼠补充钙、磷后,小鼠出现的生殖功能异常得到纠正,维生素D对雌鼠生育的影响是通过调节钙、磷水平实现的[6]。还有研究发现,增加钙摄入可改善多囊卵巢综合征(PCOS)患者的高雄激素血症,增加高密度脂蛋白-胆固醇(HDL-C)水平[7]。这些研究结果均表明,血钙、磷可影响代谢、性激素水平及生殖功能。
维生素D缺乏的饲料喂养联合不含紫外线光照环境是建立维生素D缺乏动物模型较为常用的方法之一,且符合现代人由于饮食结构不平衡及户外光照时间减少所致维生素D水平降低的特征[6]。Stavenuiter等[8]通过增加大鼠维生素D缺乏饲料中钙、磷的含量,在引起维生素D缺乏的同时,维持了血清钙、磷水平的稳定。Sun等[6]给予1α-羟化酶基因敲除大鼠高钙、高磷饮食,使大鼠维持正常的钙、磷水平。本实验结合既往文献,在不含紫外线的白炽灯光照环境下,给予维生素D缺乏组几乎不含维生素D的饲料,其中钙和磷的含量较对照组标准饲料均升高4倍。喂养8、16、24周后,维生素D缺乏组维生素D水平显著降低,钙、磷水平较对照组差异无统计学意义。
临床观察性研究表明,维生素D水平与代谢综合征的发生风险及严重程度呈负相关[9-10]。研究发现,PCOS女性血清25(OH)D水平与HOMA-IR呈负相关,补充维生素D则可以降低PCOS女性甘油三酯水平,改善糖代谢[11-12]。笔者研究发现,与对照组相比,维生素D缺乏组甘油三酯、空腹血糖、HOMA-IR增加,且血清25(OH)D水平与甘油三酯水平呈负相关,提示维生素D缺乏会影响糖、脂代谢。关于维生素D作用机制的研究发现,维生素D缺乏会加重细胞氧化应激、炎性反应,损害肝脏和胰腺对糖、脂代谢的调节功能[4, 13]。
VDR不仅存在于下丘脑、垂体,也存在于卵巢、子宫、胎盘等外周生殖器官[5]。提示维生素D可能作用于靶组织VDR,影响生殖功能。敲除VDR基因或1α-羟化酶的大鼠,性腺功能低下,卵泡形成受损,子宫发育不良[5-6]。卵巢颗粒细胞体外实验发现,维生素D在细胞氧化应激和细胞周期调控相关基因的表达中起作用,影响颗粒细胞的增殖与凋亡[14]。与性激素合成密切相关的类固醇合成酶的表达也受维生素D影响,如维生素D可上调3β-羟基类固醇激素脱氢酶、类固醇合成快速调节因子、细胞色素P450羟化酶mRNA表达,增加孕酮、雌二醇的合成[14-15]。本研究中,维生素D缺乏大鼠雌二醇水平有降低的趋势,可能是维生素D缺乏后导致类固醇合成酶相关基因表达降低的结果。但两组之间雌二醇、孕酮、睾酮差异没有统计学意义,可能是因为:(1)大鼠体内存在复杂的反馈机制及其他可能影响类固醇激素合成的因素,与单独颗粒细胞培养时维生素D对类固醇激素的调节作用可能有差异。(2)本实验维持了正常的钙、磷水平,与既往一些研究的条件有所不同。
PCOS是育龄期女性最常见的生殖内分泌疾病,也是无排卵性不孕最常见的原因[12]。临床特点包括高雄激素血症、月经异常、不孕、卵巢多囊样改变等,可伴有肥胖、胰岛素抵抗、血脂紊乱等代谢异常[16]。研究发现,与健康育龄期女性相比,PCOS患者合并维生素D缺乏的比例更高[17]。且维生素D水平与PCOS患者的代谢及生殖异常具有相关性[17-18]。PCOS患者常存在高LH伴正常或低水平的FSH,LH/FSH比值升高,影响卵泡发育,出现生殖功能障碍[19]。本研究发现,维生素D缺乏大鼠LH水平有升高趋势,FSH水平降低,LH/FSH比值升高,这与PCOS患者垂体促性腺激素的变化特点一致,且大鼠LH/FSH比值与25(OH)D水平呈负相关。既往也有研究发现,PCOS女性LH/FSH比值与25(OH)D水平具有相关性[20]。笔者推测维生素D缺乏与性激素水平失调有关,可能影响性激素分泌的中枢机制。
本研究还发现,大鼠维生素D缺乏的同时伴有AMH水平升高,卵巢囊状卵泡数量增加。既往研究发现,维生素D与AMH水平密切相关[21]。维生素D通过抑制AMH水平,降低AMH受体、FSH受体的基因表达,调节AMH信号通路,参与卵泡的发育成熟过程[22]。维生素D缺乏后AMH与性激素的异常,可能共同参与了多囊卵巢卵泡异常的发生。
本研究结果提示,维生素D缺乏可影响雌性大鼠糖、脂代谢、性激素及AMH水平,卵巢出现多囊样改变。维生素D缺乏可能参与PCOS代谢、生殖功能异常的发生,具体机制有待进一步研究。

