2型糖尿病患者葡萄糖负荷后胰岛素分泌达峰时间的影响因素研究
廖世波,吴敏,黄淑玉,邹毅,晏益民,朱钊,黄高,李玲,向成,祝维
健康者在口服75 g葡萄糖后30~60 min胰岛素分泌达高峰,2型糖尿病(T2DM)患者由于胰岛素分泌障碍常表现为胰岛素分泌高峰延迟[1]。实际上不论糖耐量正常与否以及程度如何均可出现胰岛素分泌高峰延迟,胰岛素分泌高峰延迟是胰岛β细胞功能衰竭的早期表现,抑制这一过程就有可能延缓甚至逆转胰岛β细胞功能衰竭[2-4]。目前国内外缺乏对T2DM患者胰岛素分泌高峰延迟影响因素研究的报道,本文旨在探讨T2DM患者胰岛素分泌达峰时间的影响因素,以为延缓T2DM患者胰岛素分泌高峰延迟这一病理过程提供依据。
1 对象与方法
1.1 研究对象 选取2016年1月—2018年6月于武汉科技大学附属孝感医院内分泌科住院的490例T2DM患者为研究对象。纳入标准:(1)符合2006年WHO糖尿病诊断标准[5];(2)签署知情同意书。排除标准:(1)1型糖尿病患者、分型不明确的糖尿病患者、妊娠期或哺乳期患者;(2)近期服用利尿剂、β受体阻滞剂、水杨酸制剂、甲状腺激素、糖皮质激素、避孕药等对血糖有明显影响药物的患者;(3)病毒性肝炎、肝硬化、脾大或肝功能不全的患者;(4)既往明确诊断为酒精性肝病或有大量饮酒史的患者;(5)急、慢性肾功能不全的患者;(6)甲状腺功能异常的患者;(7)血液系统疾病患者;(8)存在急、慢性感染的患者;(9)痛风性关节炎急性发作期患者。本研究经武汉科技大学附属孝感医院医学伦理委员会批准。
1.2 研究方法 (1)问诊和查体:收集性别、年龄、糖尿病病程、是否初治、近3个月外源性胰岛素使用情况、糖尿病家族史、高血压病史;测量身高、体质量,计算体质指数(BMI)。(2)彩色多普勒超声筛查:利用彩色多普勒超声筛查非酒精性脂肪性肝病(NAFLD)、无症状胆囊结石、颈动脉斑块患病情况。NAFLD参照中华医学会肝病学分会脂肪肝和酒精性肝病学组2010年制定的《非酒精性脂肪性肝病诊疗指南》[6]中的超声诊断标准;无症状胆囊结石参照中华消化杂志编辑委员会制定的《中国慢性胆囊炎、胆囊结石内科诊疗共识意见(2014年,上海)》[7]中的超声诊断标准;颈动脉斑块参照中国医师协会超声医师分会2009年制定的《血管超声检査指南》[8]中的超声诊断标准;腹部超声和颈部血管超声由2名专职超声科医师采用美国通用电气Voluson E8彩色多普勒超声诊断仪完成。(3)糖化血红蛋白(HbA1c)的检测:采用Bio-Rad D-10TM全自动糖化血红蛋白分析仪检测HbA1c。(4)血酮体测定:采用Precision Optium血酮测试仪及配套试纸通过β-羟丁酸脱氢酶法测定血酮体。酮症判断标准:β-羟丁酸>0.30 mmol/L[9]。(5)血常规检测:采用XE-2100全自动血液分析仪检测血常规。(6)生化检测:研究对象均空腹12 h以上(使用预混胰岛素、中效胰岛素者,测试前1 天停用;使用长效胰岛素或超长效胰岛素类似物者,停用相应胰岛素,待超过其作用持续时间后;使用胰岛素促泌剂者,根据t1/2,待其在体内的作用消失后)收集静脉血3 ml,采用75 g葡萄糖耐量试验(OGTT)、胰岛素释放试验(IRT)测量葡萄糖负荷,于试验后30、60、120、180 min各抽取静脉血3 ml离心留取血浆(离心温度4 ℃,离心半径4.5 cm,离心速率3 300 r/min,离心时间10 min),采用Beckman CX9.ALX型全自动生化分析仪检测血浆葡萄糖(G0min及试验后G30min、G60min、G120min、G180min)和生化全套项目。(7)胰岛素水平检测及胰岛功能评估:采用Elecsys 2010电化学发光全自动免疫分析仪检测胰岛素水平(I0min及试验后I30min、I60min、I120min、I180min);胰岛功能评估:HOMA-β=20×FINS/(FPG-3.5),HOMA-IR=(FPG×FINS)/22.5,其中HOMA-β为胰岛β细胞功能指数,HOMA-IR为胰岛素抵抗指数,FPG为空腹血糖,FINS为空腹胰岛素。
采用Origin 8.0软件根据多项式拟合法对患者胰岛素测量结果进行曲线拟合和峰值分析,记录胰岛素峰值(Imax)及达峰时间(tmax)(见图1)。根据tmax水平将患者分为短tmax组(tmax≤90 min,n=159)、中tmax组(90 min<tmax≤ 135 min,n=169)和长tmax组(135 min<tmax≤ 180 min,n=162)。
1.3 统计学方法 采用SPSS 24.0统计软件进行统计分析。呈正态分布的计量资料以(x ±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;呈非正态分布的计量资料以〔M(QR)〕表示,多组间比较采用Kruskal-WallisH检验,组间两两比较采用Tamhane "sT2检验;计数资料以相对数表示,组间比较采用χ2检验;采用多因素Logistic回归分析T2DM患者tmax的影响因素。以P<0.05为差异有统计学意义,计数资料组间两两比较调整检验水准为P<0.016 7。
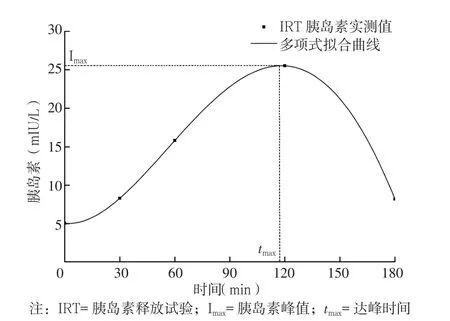
图1 IRT多项式拟合曲线Figure 1 Polynomial fitting curve of IRT
2 结果
2.1 各组一般资料及实验室指标比较 3组患者的年龄、初治者占比、近3个月使用外源性胰岛素者占比、糖尿病酮症发生率、糖尿病家族史、高血压病史、NAFLD病史、胆囊结石病史、颈动脉斑块病史、HbA1c、BMI、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、胆碱酯酶(CHE)、碱性磷酸酶(ALP)、γ-谷氨酰基转移酶(GGT)、唾液酸(SA)、尿素(UREA)、肌酐(Cre)、尿酸(UA)、视黄醇结合蛋白(RBP)、血钾(K+)、血钙(Ca2+)、血镁(Mg2+)、总胆固醇(CHOL)、三酰甘油(TG)、α-羟丁酸脱氢酶(HBDH)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、C反应蛋白(CRP)、白细胞计数、红细胞平均体积、红细胞平均血红蛋白含量、血小板计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数、嗜酸粒细胞计数、嗜碱粒细胞计数、红细胞分布宽度、血小板分布宽度、平均血小板容积、大型血小板比例、中性粒细胞与淋巴细胞比值(NLR)比较,差异无统计学意义(P>0.05);3组患者的性别、病程、红细胞计数、血红蛋白水平比较,差异有统计学意义(P<0.05);其中,中tmax组、长tmax组男性与女性之比小于短tmax组,差异有统计学意义(P<0.016 7);长tmax组红细胞计数、血红蛋白含量低于短tmax组,中tmax组病程短于短tmax组、血红蛋白含量低于短tmax组,差异均有统计学意义(P<0.05,见表1)。
2.2 各组OGTT、IRT指标比较 3组患者的G30min、G60min、I0min、I30min、Imax、HOMA-β、HOMA-IR 比较,差异均无统计学意义(P>0.05);3组患者的G0min、G120min、G180min、I60min、I120min、I180min比较,差异均有统计学意义(P<0.05);其中,长tmax组患者G0min水平高于中tmax组,差异均有统计学意义(P<0.05);长tmax组患者G120min、G180min水平高于短tmax组和中tmax组,I60min水平低于短tmax组和中tmax组,差异均有统计学意义(P<0.05);长tmax组 I120min、I180min水平高于短tmax组,差异均有统计学意义(P<0.05);中tmax组I120min、I180min水平高于短tmax组,差异均有统计学意义(P<0.05,见表2)。
2.3 T2DM患者tmax的影响因素的Logistic回归分析 以tmax( ≤ 90 min=1,>90~135 min=2,>135~180 min=3)为因变量,以G0min、G120min、G180min、性别、病程红细胞计数、血红蛋白含量为自变量(赋值:性别男=1,性别女=2;余自变量以实际值纳入),进行Logistic回归分析,结果显示,G120min水平高是T2DM患者tmax延迟的危险因素,G0min水平高和病程长是T2DM患者tmax延迟的保护因素(P<0.05,见表3)。
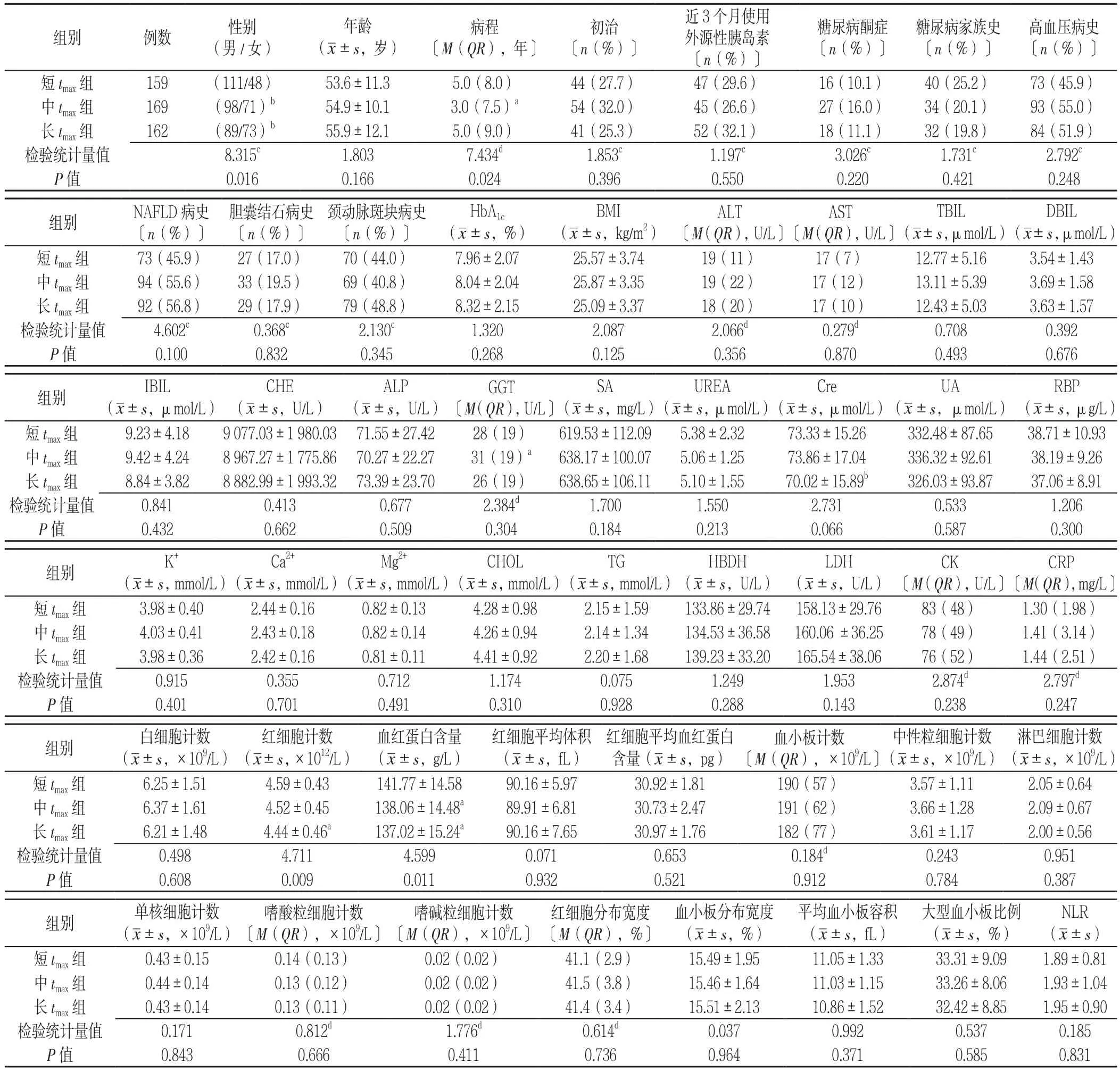
表1 各组一般资料及实验室检测指标比较Table 1 Comparison of general and clinical characteristics among short,medium and long tmax groups
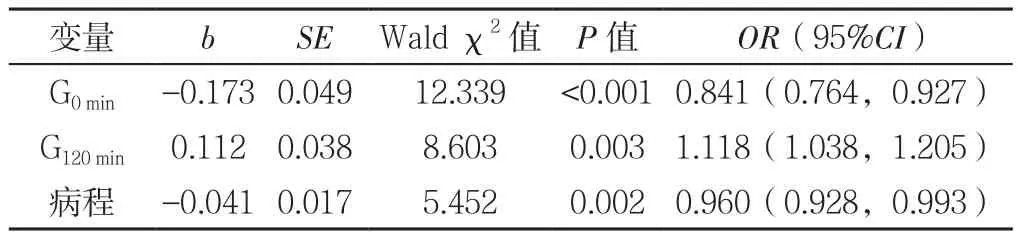
表3 T2DM患者tmax的影响因素的Logistic回归分析Table 3 Logistic regression analysis of the associated factors for tmax level in T2DM patients
3 讨论
T2DM发病涉及胰岛素作用和胰岛素分泌两方面的缺陷,其中“胰岛素分泌缺陷”在空间上表现为胰岛素“量”或“质”的不足,即胰岛素分泌数量不足或胰岛素结构异常;在时间上则表现为胰岛β细胞对外界刺激(葡萄糖等)的反应速度减慢。胰岛β细胞反应速度减慢在宏观上即表现为胰岛素分泌高峰延迟。胰岛素分泌高峰延迟作为糖尿病前期(prediabetes)的一种早期代谢表现,可存在于健康成年人中,且比例高达63%[10]。有研究表明,糖耐量正常人群中胰岛素分泌高峰延迟者(胰岛素分泌高峰在葡萄糖负荷后120 min和180 min)比胰岛素分泌高峰正常者(胰岛素分泌高峰在葡萄糖负荷后30 min)将来发展为糖尿病的风险高7.3倍[2]。胰岛素分泌高峰延迟在T2DM患者中较为普遍[11-12];T2DM患者胰岛素分泌高峰延迟使得其对胰高血糖素分泌的抑制作用减弱,同时对肝脏糖异生的抑制作用也减弱,从而使得患者呈持续高血糖状态[13]。胰岛素分泌高峰延迟作为胰岛β细胞功能减退的表现之一贯穿于糖尿病发展的始终,阻止或延缓胰岛素分泌高峰延迟就有可能延缓糖尿病的发生发展。截至目前,国内外缺乏有对T2DM患者葡萄糖负荷后胰岛素分泌高峰延迟影响因素的研究报道。本研究探讨T2DM患者OGTT后胰岛素分泌高峰延迟的影响因素,为延缓T2DM患者胰岛素分泌高峰延迟这一病理过程提供依据。
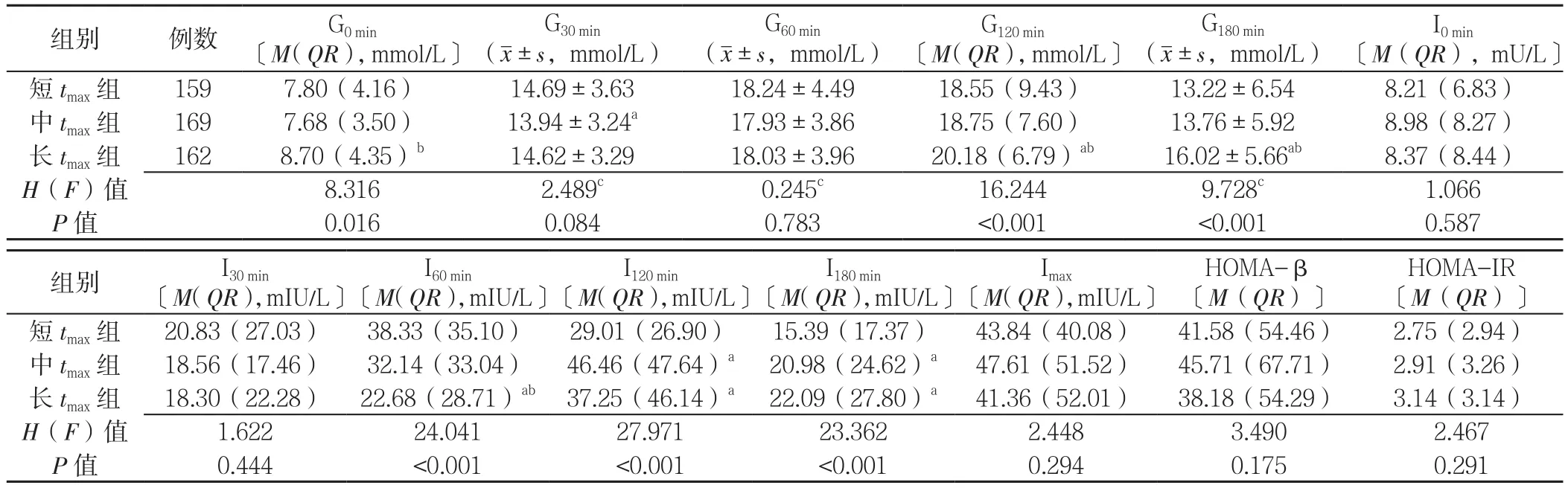
表2 各组OGTT、IRT指标比较Table 2 Comparison of OGTT and IRT parameters among short,medium and long tmax groups
胰岛素分泌高峰反映胰岛β细胞对外界刺激(血浆葡萄糖等)的应答速度。而胰岛β细胞所处的微环境影响其反应性。微环境中温度、pH值、渗透压等的改变均可导致胰岛β细胞对外界刺激的反应性发生改变。机体的物质代谢都直接或间接需要氧气,红细胞是血液循环中运输氧气的主要媒介,其内的血红蛋白在肺泡表面与氧气结合形成氧合血红蛋白,后者通过血液循环到达组织后又与氧气解离释放出氧气供给组织细胞利用。当红细胞数量或血红蛋白含量下降时,组织细胞供氧就相对不足,细胞就会进行无氧酵解。对于胰岛β细胞而言,一方面缺氧和能量利用率低(相对于有氧氧化,无氧酵解产生的三磷酸腺苷明显减少)导致细胞内信号传输速度下降,其对外界的应答速度减慢;另一方面细胞无氧酵解产生的乳酸等酸性代谢产物在局部堆积导致微环境pH值降低,这种毒性作用导致细胞对外界刺激的反应性下降。本研究显示,长tmax组红细胞计数少于短tmax组,长tmax组和中tmax组血红蛋白含量低于短tmax组,与上述观点一致。
许多慢性非传染性疾病如代谢综合征(metabolic syndrome,MS)、高血压、高血脂、非酒精性脂肪性肝病等的发病率存在明显的性别差异[14-17]。全国大样本横断面调查显示T2DM的患病率也存在性别差异,男/女=11.7/10.2[18]。本研究显示,长tmax组和中tmax组性别(男/女)比例均低于短tmax组。推断可能的原因如下:(1)肢体解剖结构和社会分工差异导致男性对外界刺激的适应能力相对女性更强,男性对高糖刺激的耐受性较女性强,所以在同等高糖刺激下,女性患者胰岛β细胞反应速度较男性患者明显减慢。(2)男女患者体内激素水平存在明显差异,这些激素通过不同途径影响机体代谢,例如雄激素维持男性体内更高水平(相对于女性)的红细胞数,更多的红细胞参与氧气、二氧化碳等代谢物质的转运从而保证组织细胞(包括胰岛β细胞)行使正常功能。实际上男女除了生理上的差异外,在人生态度、社会分工、生活经历等方面均存在较大差异,这些因素长期作用势必导致男女性疾病谱及疾病进程的差异[19]。上述差异的确切原因还有待进一步的研究证实。
高葡萄糖钳夹试验中在持续高血糖刺激下,储存在胰岛β细胞颗粒库中的胰岛素快速释放入血使血浆胰岛素在3~5 min达峰值,后又迅速下降并在10 min 后恢复到基线水平,此为第1时相胰岛素分泌。第1时相分泌的胰岛素主要用于降低餐后血糖并维持餐后血糖的稳定性[20]。第2时相胰岛素分泌在葡萄糖刺激后10~20 min开始出现,血浆胰岛素水平上升缓慢,2~3 h达到峰值,并维持至血糖恢复到基线水平。第2时相胰岛素分泌即晚相胰岛素分泌,其生理作用可能是抑制胰高血糖素的分泌[21]。健康者在OGTT后,血糖上升的速度较静脉注射葡萄糖后缓慢,胰岛素分泌高峰出现在糖负荷后30~45 min,称为早相胰岛素分泌[22]。由于早相胰岛素分泌与第1时相胰岛素分泌存在正线性相关,故可用早相胰岛素分泌来反映第1时相胰岛素分泌的情况[23]。葡萄糖负荷后IRT曲线实际上是早相胰岛素分泌峰(S1)和晚相胰岛素分泌峰(S2)的综合表现(见图2)。胰岛素早相分泌受损明显早于晚相分泌受损,在糖尿病前期(糖耐量受损)时胰岛素早相分泌已降至正常值的50%,而此时晚相胰岛素分泌仍处于正常范围[24]。对于糖耐量正常者,早相胰岛素分泌峰明显高于晚相胰岛素分泌峰,故IRT曲线峰位置偏向于早相胰岛素分泌峰;糖尿病初期早相胰岛素分泌受损明显,IRT曲线峰位置较糖耐量正常者明显后移,偏向于晚相胰岛素分泌峰;随着病程的延长,晚相胰岛素分泌受损,甚至出现晚相胰岛素分泌峰消失呈持续低平状态,此时IRT曲线峰位置又逐渐前移偏向于早相胰岛素分泌峰。本研究结果显示中tmax组病程短于短tmax组,可以用上述理论解释。
当体内的葡萄糖浓度升高并持续一段时间,会对一系列的组织、器官造成损伤,这一过程称为“糖毒性”[25]。严格意义上,“糖毒性”有慢性糖毒性和急性糖毒性之分,目前对急、慢性糖毒性的定义和时间划分标准并不统一[26-28]。
空腹血糖主要产生慢性糖毒性,餐后血糖产生急性糖毒性。空腹血糖变化(日间空腹血糖波动)相对餐后血糖变化小而缓慢[29],胰岛β细胞有较长的时间来代偿这种变化;餐后血糖变化相对空腹血糖大而剧烈,血糖剧变导致胰岛局部微环境的剧变,从而使胰岛及胰岛β细胞发生急性损伤如胰岛边界变得不规则、内部细胞排列紊乱、细胞内线粒体嵴断裂、分泌颗粒空泡等[30]。空腹血糖对胰岛功能的影响主要是由于长期持续性高血糖;餐后血糖对胰岛功能的影响涉及持续性高血糖和血糖波动两个方面。
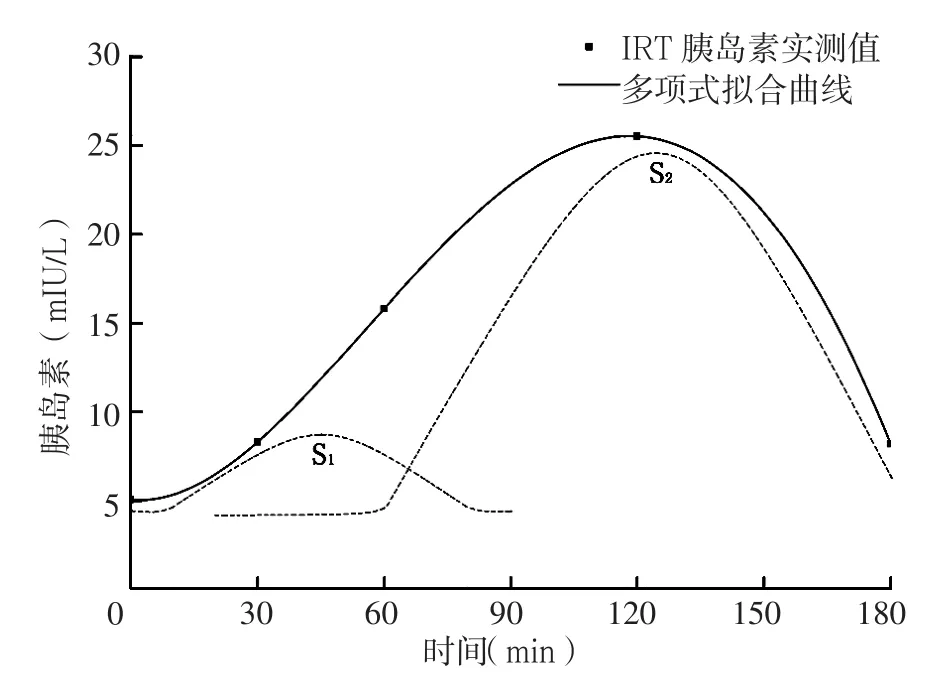
图2 IRT多项式拟合曲线的分峰分析Figure 2 Peak deconvolution methods based on polynomial fitting curve of IRT
早相胰岛素分泌主要是胰岛β细胞内近质膜处储存颗粒中的胰岛素快速释放的结果;晚相胰岛素分泌是胰岛β细胞内远离质膜处储存颗粒中的胰岛素释放和新合成的胰岛素分泌共同作用的结果[31]。2型糖尿病初期阶段早相胰岛素分泌明显受损,而晚相胰岛素分泌受损不明显(当空腹血糖<7.80 mmol/L时,其晚相胰岛素分泌的绝对值甚至高于正常人[32]),此时随着空腹血糖的升高,胰岛素分泌曲线峰位置逐渐后移靠近晚相胰岛素分泌峰。本研究结果显示长tmax组患者G0min水平高于中tmax组支持上述观点。当空腹血糖升高达到或超过某一界值时,早相胰岛素分泌衰减至某一较低水平而不再有明显改变,此时若空腹血糖继续升高,晚相胰岛素分泌开始出现明显下降(主要是新合成的胰岛素明显减少),胰岛素分泌曲线峰位置随之前移逐渐靠近早相胰岛素分泌峰。本研究Logistic回归分析显示,调整性别、病程等影响因素后,G0min水平高是T2DM患者tmax延迟的保护因素,表明对于本研究中的患者总体而言,胰岛素分泌峰值与G0min水平呈负相关。考虑可能原因为本研究中样本对象均选自住院患者,而收住院的患者可能存在如下特点:(1)部分对象为初发的血糖较高的需行胰岛素强化治疗的T2DM患者;(2)部分对象为院外行口服药物治疗失效而血糖进行性升高需改予胰岛素治疗的患者;(3)部分对象为院外“一针长效”或院外“两针预混”继发失效需调整胰岛素种类或增加注射次数的患者。这些患者的共同特点是空腹血糖普遍较高。
已有研究证实,餐后血糖的急剧升高抑制早相胰岛素分泌且促进晚相胰岛素分泌[33]。早相胰岛素分泌减弱导致胰岛素分泌曲线峰位置偏离早相分泌峰,晚相胰岛素分泌增强导致胰岛素分泌曲线峰位置偏向晚相分泌峰,故随着糖负荷后血糖水平的升高,胰岛素分泌曲线峰值后延。另一方面,糖负荷后血糖的急剧变化(血糖波动大)可能对胰岛β细胞产生应激性损伤。有研究显示,急性高血糖使胰岛β细胞内线粒体发生肿胀,线粒体膜发生断裂[30]。这些损伤使胰岛β细胞对外界刺激(高血糖等)的应答速度变慢,从而使得胰岛素分泌进程整体延迟。这两方面的原因均导致胰岛素分泌曲线峰值随餐后血糖的升高而后延。故本研究Logistic回归分析显示,G120min是T2DM患者tmax延迟的危险因素。田景琰等[34]的研究表明G120min与胰岛素分泌峰值时间呈正相关,与我们的研究结论一致。
综上所述,本研究结果显示G0min水平高和糖尿病病程长是tmax延迟的保护因素。除外糖尿病病程这一非人为可控因素,控制空腹血糖并不利于延缓胰岛素分泌高峰延迟。但本课题组前期研究已经证明控制空腹血糖可以改善T2DM患者IRT峰值水平[35]。同时本研究结果也显示G120min水平高是tmax延迟的危险因素,故通过控制餐后血糖可能延缓或阻止胰岛素分泌高峰延迟这一病理生理过程。
作者贡献:廖世波进行文章的构思与设计、统计学处理,撰写与修订论文;廖世波、黄淑玉进行研究的实施与可行性分析;朱钊、黄高、李玲、向成、祝维进行数据收集;朱钊、黄高进行数据整理;廖世波、吴敏、邹毅、晏益民进行结果的分析与解释;黄淑玉负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。

