帕金森病患者血清Cys C与炎症因子 氧化应激反应的关系
王 倩 秦伟伟 龙治华 张杰文△
1)驻马店市中心医院神经内一科,河南 驻马店 463400 2)河南省人民医院神经内科,河南 郑州 450003
帕金森病(Parkinson’s disease,PD)是老年人群中常见的一种神经退行性疾病,通过位于黑质致密部的多巴胺能神经元的退行性变,引起基底节中这些神经元的缺乏[1-2]。帕金森病的主要临床症状是僵硬、姿势不稳、静止震颤和运动迟缓。越来越多的研究表明炎症在帕金森病的病理特征和症状中发挥重要作用[3-4]。炎症标志物,如肿瘤坏死因子和白细胞介素是免疫激活的关键信号分子,在大脑和外周神经系统发挥作用[5]。Meta分析显示帕金森病患者中炎症细胞因子水平均升高[6]。帕金森病患者脑内的生化和细胞功能异常已被证实,包括线粒体功能障碍、自由基介导的损伤、兴奋毒性和氧化应激,这些变化被认为起关键作用[7]。氧化应激可能代表遗传和环境病因趋同的共同途径。胱抑素C(Cystatin C,Cys C)是一种半胱氨酸蛋白酶抑制剂,属于胱抑素2型超家族的成员。CysC是比血清肌酐或估计肾小球滤过率更敏感的肾功能不全的生物标志物[8]。升高的血清Cys C水平与PD患者认知损害有关[9]。近年来有研究显示在女性帕金森病患者中,Cys C浓度与帕金森的发病相关可作为诊断帕金森病患者非运动障碍的生物标志物[10]。目前Cys C与帕金森病相关的发病机制尚不清楚,本研究通过分析CysC与炎症因子及氧化应激反应的相关性,分析Cys C是否可能通过炎症因子及氧化应激途径影响帕金森病的发生与发展,对帕金森病的预防及治疗提供新的可行思路。
1 对象和方法
1.1研究对象选取2017-01—2018-11驻马店中心医院治疗的帕金森病患者76例,男40例,女36例,年龄62~78(68.64±2.17)岁,病程1~20 a。由2名经验丰富的神经科医生严格按照英国帕金森病学会临床诊断标准进行诊断[11]。排除标准:(1)化学药物、创伤、脑血管病等诱发的帕金森病;(2)合并严重心、肾、肝、血液系统疾病以及感染性或炎症性疾病的帕金森病患者;(3)其他神经系统疾病患者被排除。同期进行1∶1年龄、性别匹配选择同期进行健康体检者76例,男40例,女36例,年龄60~75(66.05±3.61)岁。2组年龄、性别等一般资料差异均无统计学意义(P>0.05),具有可比性。所有患者均知情同意。
1.2研究方法
1.2.1 血液样本采集:所有调查对象于清晨空腹抽取外周静脉血7 mL,储存于-20 ℃。本次测量的生化指标主要包括胱抑素C、白介素6(IL-6)、肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、干扰素γ(INF-γ)、C反应蛋白(CRP)及氧化应激指标:一氧化氮合酶(NOS)、超氧化物歧化酶(SOD)、丙二醛(MDA)、对氧磷脂酶1(PON1)和循环谷胱甘肽过氧化物酶(CGP)。
1.2.2 胱抑素C、炎症因子及氧化应激的测定:胱抑素C和CRP均在全自动血生化分析仪中进行检测。使用ELISA法进行测定IL-6、IL-1β、TNF-α和INF-γ的浓度,试剂盒购于深圳普瑞康生物公司,所有操作均严格参照说明书执行。NOS、SOD、MDA、PON1和CGP均采用试剂盒进行检测,试剂盒购于南京建成生物工程公司。

2 结果
2.1 2组胱抑素C和炎症因子比较帕金森病组血清Cys C、IL-1β、TNF-α、IL-6、CRP浓度均高于健康对照组,差异有统计学意义(P<0.01)。2组血清INF-γ浓度相比差异无统计学意义(P>0.05)。见表1。
2.2 2组氧化应激指标比较帕金森病组血清NOS、SOD、PON1、CGP浓度均低于健康对照组(P<0.05),MDA浓度高于对照组,差异有统计学意义(P<0.05)。见表2。

表1 2组胱抑素C及炎症因子比较
2.3帕金森病患者血清胱抑素C与炎症因子、氧化应激指标的相关性分析帕金森病患者血清Cys C浓度与IL-1β、TNF-α、IL-6、CRP和MDA浓度呈正相关(r=0.26、0.34、0.28、0.31、0.44,P<0.05),与NOS、SOD、PON1、CGP呈负相关(r=-0.33、-0.38、-0.30、-0.43,P<0.05)。见表3。
3 讨论
帕金森病又称震颤性麻痹,是最常见的神经退行性疾病之一,慢运动、肌强直、震颤、步态异常、认知障碍、睡眠障碍、自主神经功能障碍和感觉障碍是该病的主要特征[12-14]。帕金森病目前尚无特效治疗方法。帕金森病的治疗主要是从减轻疼痛、延缓病情发展、提高患者生活质量等方面着手。因此本研究通过分析帕金森病患者血清胱抑素C与炎症因子及氧化应激指标之间的相关性为帕金森的治疗提供新的方法及思路。
本次研究说明,帕金森病患者血清胱抑素C与炎症因子及氧化应激指标之间具有相关性,提示血清胱抑素C可能参与炎症过程及氧化应激反应。Cys C通过炎性细胞分泌到血流中,还是肾功能和心血管疾病的敏感指标[15]。与动脉粥样硬化疾病相关的炎性细胞因子刺激溶酶体组织蛋白酶,导致血浆中组织蛋白酶抑制剂Cys C的浓度增加,以平衡潜在的破坏性增加的弹性溶解活性[16-19]。这些炎症因子参与多种生物学和炎症过程,如细胞增殖、吞噬、细胞因子的调节和趋化因子的产生,白细胞的募集,主要是中性粒细胞。有缺陷的炎症因子调节破坏稳态条件,在许多自身免疫和慢性炎症性疾病,如动脉粥样硬化和帕金森的发病机制中起重要作用[5]。同时还有多项研究[20-23]证明,Cys C与炎症因子在多种疾病中都具有相关性,牙周病原体和促炎细胞因子添加到人类牙龈成纤维细胞后发现可增强其Cys C表达,且在慢性鼻窦炎患者的筛窦黏膜中观察到Cys C的水平升高。
氧化应激通过产生过氧化物和自由基,损伤细胞内的所有组成部分,包括蛋白质、脂类和DNA,从而引发病理过程。虽然Cys C可能参与发展的确切机制仍需进一步的研究,已有研究证明在神经系统和心血管系统中氧化应激可上调Cys C的浓度。氧化应激可引起大鼠初代神经元及脑微血管平滑肌细胞中Cys C水平的升高[24-27]。CysC通过激活AMPK的自噬作用促进突变型SOD的降解,同时抑制溶酶体

表2 2组氧化应激指标比较
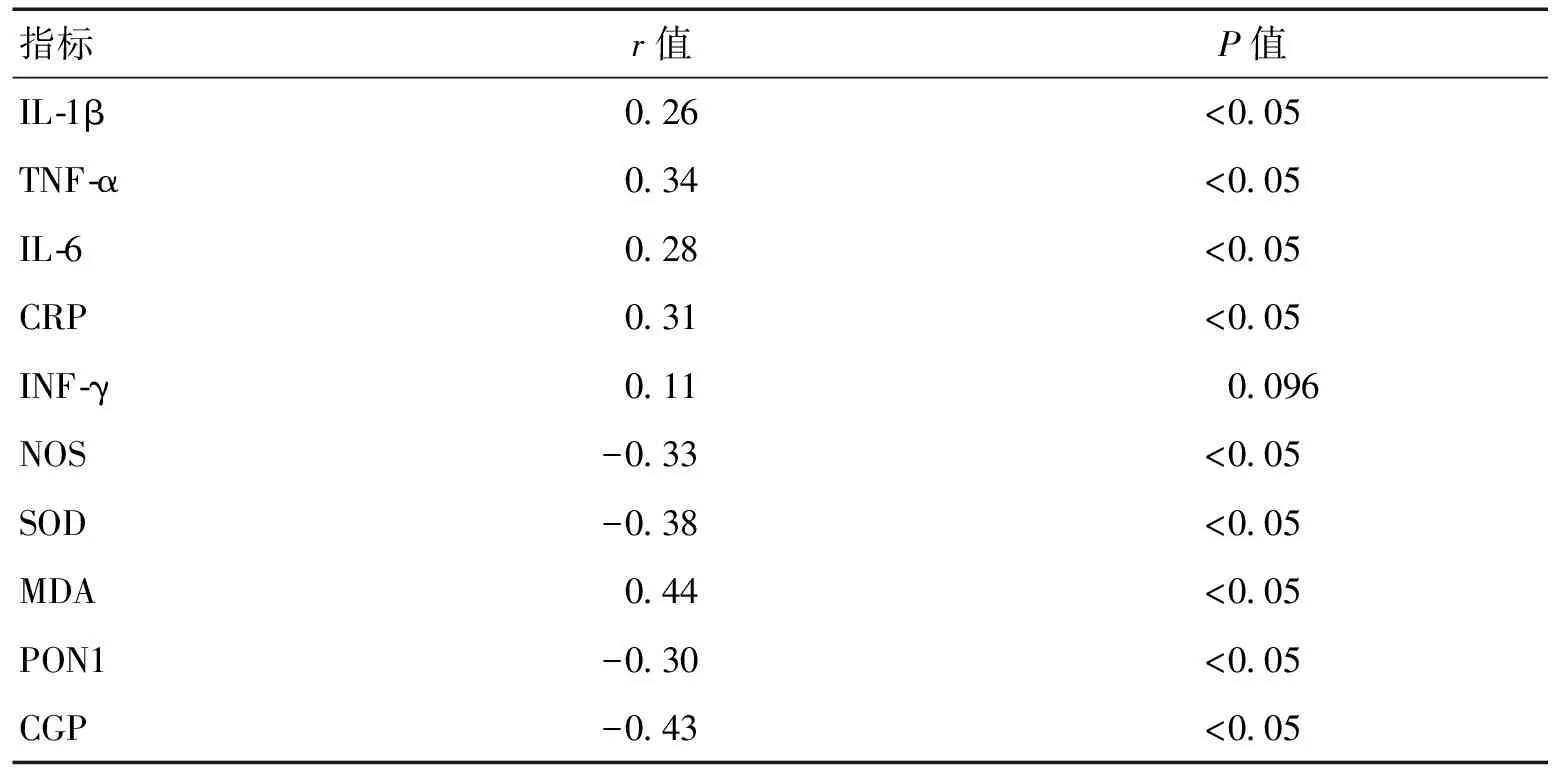
表3 帕金森病患者血清胱抑素C与炎症因子、氧化应激指标的相关性分析
组织蛋白酶的异常蛋白水解。同时也有研究表明氧化应激与胱抑素C水平相关,胱抑素C水平升高似乎是氧化应激的结果[28-29]。氧化应激刺激胱抑素C表达可能由活性氧(包括超氧阴离子、过氧化氢、羟基自由基和过氧亚硝酸盐)介导,但目前尚不清楚活性氧如何触发胱抑素C表达[30-31]。据报道[32-33],由于溶酶体膜损伤或断裂,氧化应激可迅速启动组织蛋白酶B和L从溶酶体向胞浆的转移,胱抑素C也可从溶酶体释放到在氧化应激条件下存在神经球蛋白的细胞质中。此外,研究[34-35]显示,暴露于氧化应激的培养神经元中,胱抑素C表达上调。
帕金森病患者血清胱抑素C与炎症因子及氧化应激指标之间存在一定的相关性,但胱抑素C是如何通过炎症因子及氧化应激参与到帕金森的发生发展中还需进一步研究。

