梅鱼鱼鳔胶原蛋白的制备及抗疲劳活性实验
王丰雷,徐宝贵,徐 敏,吴飞红,杨最素,丁国芳
(1.海力生集团有限公司,浙江舟山 316013;2.浙江海洋大学食品与医药学院,浙江舟山 316022)
梅鱼Callichthys lucidus 属于脊索动物门,硬骨鱼纲,鲈形目鲈总科,是温水性近底层的小型经济鱼类,产量较大,是我国海洋远近海域捕捞的海产品之一。梅鱼亦称“梅大头”,味道极其鲜美,以鲜食、冷冻或加工成干品为主[1]。随着近年来对延长梅鱼货架期的要求和净菜市场的需求扩大,水产企业对梅鱼的精细加工不断增加,而加工后的下脚料如鱼鳔,常作为废料处理,无法有效利用。我国食用鱼鳔有着悠久的历史,有“海洋人参”誉称,鱼鳔中含有高级胶原蛋白、多种维生素、粘多糖及钙、锌、铁、硒等多种微量元素,其中蛋白质一般在80%以上,而脂肪含量低,是较理想的高蛋白低脂食品。近年来学者们对海鱼鱼鳔的的研究日益增加,从鮸鱼、大黄鱼、鲣鱼、日本黄姑鱼等鱼鳔中提取了胶原蛋白及胶原蛋白肽,发现具有较好的抗氧化活性、提高小鼠记忆、促进创伤皮肤的修复等功能[2-5],并研制了鱼鳔营养液、鱼鳔胶原蛋白果冻等营养食品[6-8],也有学者利用鱿鱼皮胶原蛋白模拟加工成鱼鳔[9]。任玉翠等[10]、曾丽[11]根据“保健食品的功能学评价程序和方法”,发现海鱼鱼鳔的提取物对小鼠具有较好的抗疲劳活性,可作为滋补品进行开发。然目前对梅鱼鱼鳔胶原蛋白的提取及抗疲劳活性尚未见报导。胶原蛋白的提取有热水法、酸法、碱法、酶法等,而应用胃蛋白酶提取得到的胶原蛋白结构最完整[12],因此本研究采用胃蛋白酶提取梅鱼鱼鳔胶原蛋白,并检测其对小鼠体内的抗疲劳活性,为梅鱼鱼鳔胶原蛋白的开发利用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
雄性ICR 健康小鼠,体重为18~22 g,购置于浙江省实验动物中心,饲养于浙江海洋大学实验动物房。
1.1.2 实验原料与试剂
新鲜梅鱼鱼鳔购于舟山市南珍菜场,剥离鱼鳔内壁的血管及结缔组织,经组织捣碎机捣碎后,小剂量分装后于-20℃冷冻备用。胃蛋白酶(1:3 000):美国SIGMA 公司;次高分子量Marker(43 000~200 000 D):中国科学院上海生命科学研究院;L-羟脯氨酸:上海朝晖生物科技有限公司;血清尿素氮试剂盒、肝糖原试剂盒、肌糖原试剂盒:南京建成生物工程研究所;其它所用试剂:国药试剂分析纯。
1.1.3 仪器
BSA124S 型电子天平:Sartorius AG 公司;RE-2000 旋转蒸发仪:上海亚荣生化仪器厂;DS-1 型高速组织捣碎机:上海标本模型厂;RLPHR 1-4LD 冷冻干燥机:德国Christ 公司;垂直电泳仪:美国伯乐公司IRPrestige-21 傅立叶转换红外光谱仪:日本岛津公司。
1.2 实验方法
1.2.1 梅鱼鱼鳔胶原蛋白的制备
1.2.1.1 梅鱼鱼鳔胶原蛋白的提取工艺
选用胃蛋白酶进行酶解,考虑到A(料液比)、B(酶解温度)、C(酶解时间)和D(加酶量)4 个因素,进行L9(34)的正交试验(具体设定值如表1),比较在不同酶解条件下胶原蛋白的提取率,以达到胃蛋白酶法提取胶原蛋白的工艺优化。
酶解具体工艺流程如下:
鱼鳔洗净→除去其内壁血管及结缔组织→0.1 mol·L-1的NaOH 除去杂蛋白→10%的正丁醇溶液除脂→加酶水解→灭酶(终浓度为20±1 mmol·L-1的EDTA)→离心(5 000 r·min-1,15 min)→除色素(活性炭)→过滤得到酶解液→沉淀在相同条件下再次酶解→合并两次酶解液离心(10 000 r·min-1,30 min)→透析(蒸馏水)→离心(12 000 r·min-1,30 min)→取上清液→浓缩→冷冻干燥。

表1 胃蛋白酶提取鱼鳔胶原蛋白的因素与水平设定值Tab.1 The factors and levels of collagen which extracted from swim bladders by pepsin
1.2.1.2 样品中胶原蛋白含量的测定
采用羟脯氨酸标准曲线法测定。分别取浓度为1.0 μg·mL-1、2.0 μg·mL-1、2.5 μg·mL-1、3.0 μg·mL-1、3.5 μg·mL-1、4.0 μg·mL-1、4.5 μg·mL-1的羟脯氨酸标准溶液1 mL 于试管中,相继加入0.05 mol·L-1氯胺T溶液、柠檬酸缓冲液(pH 6.0)各1 mL,混匀后在室温下氧化10 min,再加入高氯酸(3.5 mol·L-1) l mL,混匀后在室温下放置10 min,加入l mL 对二甲基氨基苯甲醛溶液显色,振荡混匀后将其放至65℃水浴锅中,反应20 min,于560 nm 处测OD 值。横坐标为羟脯氨酸的浓度,纵坐标为所测得的OD 值,绘制羟脯氨酸的标准曲线并建立线性回归方程。
1.2.1.3 鱼鳔和所得胶原蛋白中羟脯氨酸含量的测定
取鱼鳔1 g,加入50 mL 6 mol·L-1的盐酸,置于120℃电热套中水解10 h。水解液冷却后定容至100 mL后抽滤,取滤液1 mL,稀释50 倍后调节pH 至7.0,转移到容量瓶中并定容至100 mL。取冷冻干燥好的胶原蛋白粗品0.01 g,加入20 mL 6 mol·L-1的盐酸和20 mL 蒸馏水,置于120℃的电热套中水解7.5 h。取鱼鳔和胶原蛋白水解液1 mL 于试管中,按上述的方法,分别计算鱼鳔原料中羟脯氨酸的含量和样品中的胶原蛋白含量。
胶原蛋白的提取率=(粗品中羟脯氨酸的总质量)/(对应质量的鱼鳔羟脯氨酸的总质量)
1.2.1.4 胶原蛋白性质的确定
采用SDS -PAGE 垂直电泳,电泳缓冲液为Tris -甘氨酸缓冲液。
1.2.1.5 傅立叶转换红外光谱仪检测(FTIR)
取1 mg 冻干的梅鱼胶原蛋白粗提取物与脱水处理后的KBr(分析纯) (二者比值为1 :100)充分研磨混匀,放入相应模具压制成KBr 片。在400~4 000 cm-1的条件下测定其FTIR。扫描条件设置为:分辨率4 cm-1,扫描次数40 次。
1.2.2 鱼鳔胶原蛋白体内抗疲劳实验
1.2.2.1 实验动物分组
健康雄性ICR 小鼠64 只,适应性饲养7 d 后,随机分成空白对照组、梅鱼鱼鳔胶原蛋白低剂量组、中剂量组和高剂量共4 组,每组16 只。每天定时给小鼠灌胃,空白对照组只给等量生理盐水,鱼鳔胶原蛋白低剂量组、中剂量组和高剂量灌胃剂量分别是50 mg·kg-1·d-1、100 mg·kg-1·d-1和200 mg·kg-1·d-1,喂食剂量均为0.2 mL。实验期间,进食和饮水自由,连续28 d。在小鼠开始灌胃的第1 天及最后1 天称其体重。
1.2.2.2 小鼠负重游泳实验
在4 组动物中每组随机抽取8 只小鼠,在最后一次灌胃给药后30 min,标记称重后用于小鼠负重游泳实验。自制50 cm×50 cm×35 cm 的游泳箱,在小鼠尾根部系上自身体重5%的铅丝,遂将其放入水深30 cm、水温为25±1℃的游泳箱中。用玻璃棒不间断搅动游泳箱中的水,以保证小鼠在游泳箱中能不停地游动,至完全疲劳状态。当小鼠头部没入水中10 s 后,始终不能正常把头伸出水面,则认为此时小鼠已进入力竭状态,记录小鼠从开始进入水面游泳到力竭状态的时间为力竭游泳时间。
1.2.2.3 3 项生理指标的测定
每组剩下的8 只小鼠,用于检测血清尿素氮含量、肝糖原和肌糖原含量这3 项生理指标。小鼠在最后一次灌胃给药30 min 后,在游泳箱中游泳60 min,休息45 min 后进行眼球取血,用于测定血清尿素氮的含量。快速取出肝脏用于测肝糖原的含量,取小鼠腓肠肌用于肌糖原含量的测定,具体步骤按试剂盒操作说明。
1.3 数据处理
实验数据采用SPSS 19.0 统计软件进行处理,计量数据以±SD 表示,组间差异采用t 检验,以P<0.05表示差异有统计学意义。
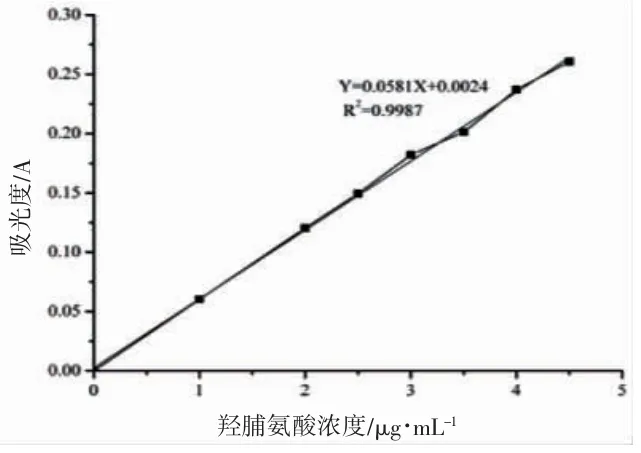
图1 羟脯氨酸标准曲线Fig.1 Hydroxyproline standard curve
2 结果
2.1 鱼鳔胶原蛋白的制备
2.1.1 羟脯氨酸标准曲线的制定
如图1 显示为羟脯氨酸标准曲线的测定结果,羟脯氨酸标准曲线的线性回归方程为:Y=0.058 1 X+0.002 4。羟脯氨酸质量浓度与吸光度之间的相关系数为R2=0.998 7,这一结果表明吸光度值与羟脯氨酸浓度之间有着良好的相关性。
2.1.2 鱼鳔羟脯氨酸含量的测定
经计算得新鲜梅鱼鱼鳔中羟脯氨酸的含量为1.16 %。
2.1.3 鱼鳔胶原蛋白的酶解工艺结果
按照1.2.1.1 的方法和L9(34)正交表进行正交试验,梅鱼鱼鳔正交试验结果如表2。

表2 鱼鳔酶解工艺的正交试验结果Tab.2 Orthogonal experimental results of enzymatic hydrolysis of swim bladders
从表2 的的实验数据进行分析发现:以羟脯氨酸含量计算胶原蛋白提取率确定最佳酶解工艺,各因素对胶原蛋白提取率的影响程度依次为:酶解时间>酶解温度>加酶量>料液比,通过分析得出梅鱼鱼鳔胶原蛋白胃蛋白酶法提取的最佳提取工艺条件为A2B3C2D3,即以1.0 %的胃蛋白酶为提取剂,采用1:40 的料液比,在24℃条件下酶解36 h,其提取率最高,经验证实验确定为63.96%。
2.1.4 SDS -PAGE 的电泳结果
鱼鳔胶原蛋白经SDS-PAGE 的电泳结果如图2 所示。从图中可以发现,该胶原蛋白是由α 链(α1 和α2),β 链,以及少量的γ 链组成的,其分子含有从44.3 kDa 到97.2 kDa 的大量低分子组分。此外梅鱼鱼鳔胶原蛋白中含有的α1 链和α2 链的比例约为2 :1,其分子量分别为为112~122 kDa 和187 kDa,这表明它属于分子组成为[α1(I)]2α2(I)的I 型胶原蛋白。因为胃蛋白酶能消除蛋白分子间的交联作用,同时作用于其端肽,因此,梅鱼胶原蛋白中仅含有少量的较高分子组分,即γ 链,以及分子间和分子内交联组成。
2.1.5 傅里叶红外光谱仪(FTIR)分析
梅鱼鱼鳔中胶原蛋白的FTIR 扫描图谱如图3 所示。从图中可以看出,由N-H 的伸缩振动引起的振动波数为3 400~3 440 cm-1,此处振动为酰胺A 谱带的特征振动,但当多肽中的N-H 有氢键形成时,其振动波数会向低频率偏移。因此胶原蛋白的酰胺A 带的γN-H伸缩(氢键)振动是在3 314 cm-1处的吸收峰;胶原蛋白的酰胺B 带的γC-H伸缩振动是在2 925 cm-1附近。由此得出,胶原蛋白的CH2为非对称拉伸。
在2 000~1 500 cm-1为双键区,通常情况下肽链侧基对酰胺I 谱带的影响基本没有或不影响其频率,在这一范围内的振动频率只取决于肽链构型。在1 653 cm-1处胶原蛋白出现酰胺I 带的γC=O伸缩振动强峰,这一振动峰与蛋白质的二级结构密切相关。在1 544 cm-1处和在1 240 cm-1处是胶原蛋白酰胺Ⅱ带的γN-H弯曲振动吸收峰和酰胺Ⅲ带的γN-H 的变形峰。在1 460~1 240 cm-1附近的吸收峰证明所提胶原蛋白存在完整的3股螺旋结构。结果提示所提取的梅鱼鱼鳔胶原蛋白基本保留了天然胶原蛋白的原有形态。FTIR 图谱证明了胃蛋白酶仅对胶原蛋白的非螺旋区产生酶切作用,对胶原分子的螺旋区没有破坏作用。此外FTIR 图谱进一步证明了本试验所提取的胶原蛋白是I 型胶原蛋白,并且保持了胶原蛋白所特有的完整生物结构。
2.2 鱼鳔胶原蛋白体内抗疲劳结果
2.2.1 ICR 小鼠的体重变化
小鼠连续灌胃鱼鳔胶原蛋白4 周后,每组小鼠体重的变化结果如图4所示。从图中可以看出,各组小鼠体重虽然都有不同程度的增加,但各组之间没有显著性差异,说明鱼鳔胶原蛋白对小鼠体重的影响没有统计学意义。
2.2.2 小鼠负重游泳时间结果
用梅鱼鱼鳔胶原蛋白灌胃小鼠4 周,4 组小鼠负重游泳时间的测定结果如图5。从图5 可知,胶原蛋白实验组与空白对照组相比,它们不同程度地延长了小鼠负重游泳的时间。其中,中剂量组和高剂量组的小鼠负重游泳平均时间分别为19.16 min 和21.20 min,中剂量组游泳时间延长了73.24 %,高剂量组游泳时间延长了91.69%,均有显著性差异(P<0.05)。低剂量组的小鼠负重游泳时间仅为16.4 min,比空白对照组增加了48.73%(P>0.05),没有统计学差异。
2.2.3 3 项生理指标的测定结果

图2 梅鱼鱼鳔胶原蛋白电泳图Fig.2 Electrophoresis of collagen from Redlip croker swim bladders

图3 梅鱼鱼鳔胶原蛋白红外扫描图Fig.3 Infrared scan of collagen from redlip croker swim bladders
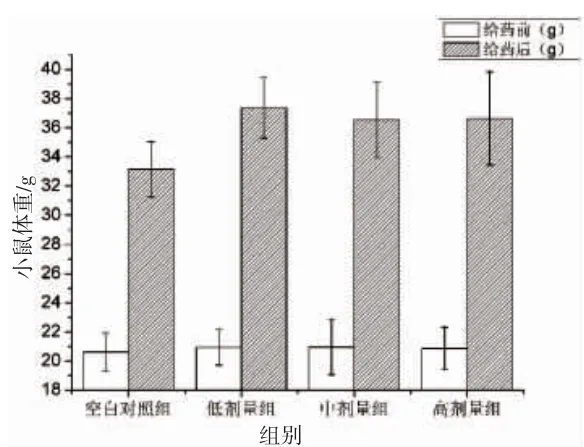
图4 梅鱼鱼鳔胶原蛋白对小鼠体重的影响(n=8,±SD)Fig.4 Effects of collagen from redlip croker swim bladders on the weight of mice (n=8,±SD)

图5 梅鱼鱼鳔胶原蛋白对小鼠负重游泳时间的影响(n=8,±SD)Fig.5 Effects of collgen from Redlip croker swim bladders loading forced swimming time of mice (n=8,±SD)
小鼠血清尿素氮、肝糖原、肌糖原的含量变化如表3 所示。从表3 中可以看出,各剂量组小鼠的血清尿素氮含量比空白对照组都有减少,中剂量组和高剂量组比空白对照组小鼠减少了23.88%和24.07%(P<0.05),均有显著性差异;低剂量组小鼠比空白对照组减少了18.56%(P>0.05),没有显著性差异。各组肝糖原的含量均比空白对照组均有增加,高剂量组小鼠的肝糖原含量比空白对照组增多了114.38%(P<0.05);中剂量组和低剂量组肝糖原的含量比空白对照组增多了42.75%和31.19%,后二者没有统计学意义。各组肌糖原的含量均比空白对照组增加,高剂量组比空白对照组增多了123.81%(P<0.05),差异具有显著性;中剂量组和低剂量组肌糖原的含量比空白对照组增多了55.95%和40.87%,差异无显著性。
表3 小鼠3 项生理指标的含量变化(n=8,±SD)Tab.1 Effects of collgen from redlip croker swim bladders on serum urea nitrogen content(n=8,±SD)
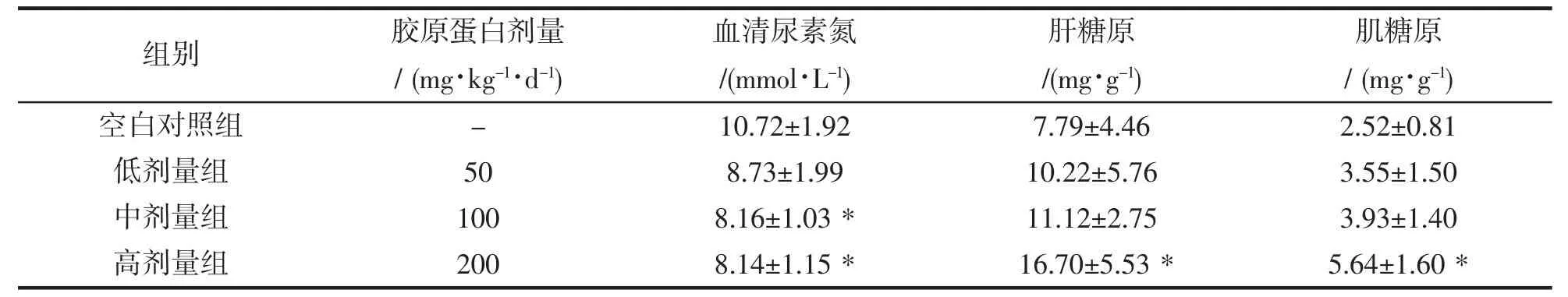
表3 小鼠3 项生理指标的含量变化(n=8,±SD)Tab.1 Effects of collgen from redlip croker swim bladders on serum urea nitrogen content(n=8,±SD)
注:与空白对照组相比,*P<0.05.
3 讨论与分析
提高水产品加工过程中废弃物的高值化利用是近年来学者们关注的热点。鱼鳔是硬骨类鱼加工过程中被丢弃的或低值利用的下脚料,但鱼鳔具有相当的滋补作用和药用价值,是一类非常重要的药食两用生物资源。鱼膘中含有丰富的胶原蛋白,基于鱼膘胶原蛋白的高营养、高保湿、低免疫活性和低的生物降解性,对其研究日益增多,可应用于功能食品、化妆品、医药、生物材料等高附加值领域[13-15]。然目前对梅鱼鱼鳔的相关研究报道不多。
本实验采用正交实验的方法,应用胃蛋白酶酶解提取梅鱼鱼鳔胶原蛋白,以羟脯氨酸含量作为提取率标准,考察了温度,料液比,加酶量以及酶解时间对胶原蛋白提取率的影响,确定梅鱼鱼鳔最佳提取工艺为加酶量为1.0 %,料液比为1 :30,酶解温度为4℃,酶解时间为36 h,最高提取率为63.96%。通过SDS 凝胶电泳和红外光谱图检测得到的胶原蛋白为I 型胶原蛋白,并且较好地保持其三级结构,这将为后续梅鱼鱼鳔胶原蛋白的研究提供实验依据。
胶原蛋白是动物体内含量最丰富、分布最广的蛋白质,是与组织器官功能有关的功能性蛋白,具有支撑机体器官、保护组织等功能[16]。研究发现鱼鳔胶原蛋白具有较好的抗疲劳活性[10-11]。疲劳是身体剧烈运动时产生的一种综合性生理过程,持续的运动过程使肌肉的耗氧量增加、血糖下降及蛋白质消耗,疲劳最主要的表现是运动耐力的下降,这是反映机体疲劳程度最直接和最客观的指标[17]。因此学者们特别是运动学家们越来越重视天然性抗疲劳功能食品的研究,为提高运动员的运动耐力,延缓疲劳发生,加快疲劳恢复,现已从海洋生物如螺旋藻、扇贝、牡蛎中研制出许多抗疲劳制品[18]。力竭游泳实验是评价动物抗疲劳特性的常用指标,小鼠力竭游泳时间与抗疲劳活性成正相关[19];本实验采用小鼠负重游泳试验检测梅鱼鱼鳔胶原蛋白的抗疲劳活性,发现灌胃胶原蛋白后的小鼠负重游泳时间明显延长,特别是中剂量组和高剂量组的小鼠更明显,说明梅鱼鱼鳔胶原蛋白具有较好的抗疲劳活性。
机体运动过程中提供能量的主要来源是肝糖原和肌糖原,它们含量的多少间接反映了有氧运动的能力。糖原的储备增加能有效减少蛋白质的氧化分解,保证了机体的正常代谢;肝糖原和肌糖原的含量变化是反映疲劳程度的重要指标。血清尿素氮是蛋白质代谢的产物,无氧情况下的蛋白质代谢对机体是一种消耗,随运动程度的加深尿素氮含量增加,负荷能力越差[20]。因此本实验通过检测小鼠运动后肝糖原、肌糖原和尿素氮的含量,进一步衡量鱼鳔胶原蛋白的抗疲劳活性。通过实验发现,梅鱼鱼鳔胶原蛋白高剂量组能大幅度增加肝糖原、肌糖原的含量,降低血清尿素氮含量,因此认为经胃蛋白酶提取的梅鱼胶原蛋白具有较好的抗疲劳活性,是值得开发利用的来自于海洋的可食性、低免疫原性胶原蛋白。

