马氏珠母贝(Pinctada fucata martensii) FBP基因的克隆及其对温度胁迫的响应*
赖卓欣 刘 雅 王庆恒,2① 郑 哲,2 邓岳文,2
(1.广东海洋大学水产学院 湛江 524088;2.广东省珍珠养殖与加工工程技术研究中心 湛江 524088)
由非碳水化合物转变为葡萄糖或糖原的过程称为糖异生(Gluconeogenesis),糖异生是增加葡萄糖产生的一个主要途径(Cota-Ruizet al,2015)。果糖-1,6-二磷酸酶(Fructose 1,6-bisphosphatase,FBP)又称果糖1,6-二磷酸酯酶,它催化果糖-1,6-二磷酸水解生成果糖-6-磷酸和无机磷,在糖的异生代谢过程中起关键性的作用(Lozinska-Gabskaet al,2003; Kaiseret al,1996)。FBP几乎存在于所有生物体中,包括细菌、真菌、植物和动物,但不存在于有异源蛋白的古细菌中(Stecet al,2000)。已有研究表明,在高温、干旱(Xiaoet al,2014; 曲玲等,2015)和缺氧(Cota-Ruizet al,2016)等非生物胁迫下,FBP通过参与催化动植物体能量产生途径产生更多的能量,在动植物体度过不良环境过程中起着重要的作用。第一个被人们所知的FBP序列全长是从小鼠(Rattus norvegicus)中克隆得到(el-Maghrabiet al,1988)。已有关于部分水产经济动物FBP的研究报道,如凡纳滨对虾(Litopenaeus vannamei)的肝胰腺具有糖异生的能力(Rosaset al,1999);大菱鲆(Scophthalmus maximus)在不同喂食情况下,其FBP在各个组织中的表达量不同(Nieet al,2015);银鲫(Carassius auratus gibelio)被证实存在肝脏型和肌肉型2种FBP同工酶(王锐等,2010)等。目前,尚未有贝类FBP的报道。关于FBP在温度胁迫条件下的研究主要集中于植物(徐文亭等,2013; 何斌等,2015; 陈虎等,2016; 曲玲等,2015),贝类FBP基因的相关功能有待进一步的研究。
贝类属于变温动物,温度的变化对贝类的生命活动有显著的影响(Kimet al,2009; Cotteret al,2010; Ivaninaet al,2013)。马氏珠母贝(Pinctada fucata martensii)又称合浦珠母贝,是中国海水珍珠养殖的主要品种,广泛分布于广东、广西和海南沿海等地,具有重要的经济价值(田荣荣等,2015)。昼夜温差的变化、一年四季的更替及无法控制的自然灾害带来的温度骤变都会对马氏珠母贝造成很大的负面影响。目前,有关马氏珠母贝对温度变化的响应机制研究较少。本研究采用RACE技术获得Pm-FBP的基因序列全长,并研究了其在不同温度下的时序表达模式,以期为深入研究马氏珠母贝温度胁迫的响应机制提供基础资料。
1 材料与方法
1.1 实验材料
本研究所用的马氏珠母贝采自广东省雷州市后洪村海区,将贝体表面的附着物清理干净后运回实验室,22℃暂养2 d后,选取鳞片旺盛、活力正常的马氏珠母贝用于实验,实验贝壳长为(69.23±3.80) mm。其中,随机取6只马氏珠母贝的全组织,包括闭壳肌、鳃、性腺、肝胰腺、足和外套膜,经液氮速冻后置于-80℃冰箱备用。
150只马氏珠母贝随机分为3组,分别置于3个300 L的实验桶中,微充气养殖,水温分别设为17℃(低温组)、22℃(对照组)和32℃(高温组),养殖过程中每天投喂等量的单胞藻,每天换水50%。在实验养殖开始后6 h、24 h、72 h和120 h,分别从每个实验桶中随机取8个个体,剪取鳃组织,经液氮速冻后置于-80℃冰箱保存。
1.2 主要试剂
Trizol、SYBR Select Master Mix和GeneJET Gel Extraction购买于Life Technologies公司;DH5α大肠杆菌(Escherichia coli)以及RACE试剂盒(Clontech)购买于TaKaRa公司;其他试剂均为国产分析纯。
1.3 Pm-FBP全长克隆
1.3.1 总RNA提取及cDNA第一链合成 采用Trizol法分别提取马氏珠母贝闭壳肌、鳃、性腺、肝胰腺、足和外套膜的总RNA。3′ RACE和5′ RACE模板的制备参考SMARTTMRACE cDNA Amplification Kit试剂盒说明书。
1.3.2 引物设计 实验采用Primer Premier 5.0软件设计了实验所需引物,引物序列见表1。

表1 引物序列 Tab.1 Primer sequences
1.3.3 RACE PCR获得Pm-FBP全长序列 利用引物Pm-FBP-F/Pm-FBP-R进行Pm-FBP中间片段的扩增。PCR产物用1%的琼脂糖凝胶电泳检测,将与目的片段长度一致的PCR产物和载体pMD18-T连接,连接产物转化到DH5α感受态细胞中,用氨苄青霉素选择培养基培养后,挑取阳性菌送往生工生物工程(上海)股份有限公司测序。将测序获得的Pm-FBP中间片段、3′和5′序列与马氏珠母贝基因组(Duet al,2017)中已知的部分进行比对,利用软件将获得的Pm-FBP中间片段与3′和5′的序列片段进行拼接,最终得到Pm-FBP全长序列。
1.3.4 Pm-FBP的生物信息学分析 利用SMART在线分析工具确定本研究克隆所得的cDNA序列为FBP基因;利用DNAMAN软件进行氨基酸序列推导;ORF Finder软件找到Pm-FBP的开放阅读框;ExPASy- ProtParam tool进行氨基酸的理化性质分析(王玉红等,2018);SignalP 4.1软件进行信号肽的预测;TMHMM Server软件分析氨基酸的跨膜结构(王修芳等,2016);SWISS-MODEL软件进行氨基酸三级结构分析(曲玲等,2015);通过多序列比对,将Pm-FBP与部分已知物种的FBP氨基酸序列进行同源性分析;利用Mega 6.0构建生物系统进化树(王竹青等,2018)。
1.3.5Pm-FBP在各组织以及不同温度下鳃中的时序表达差异 本研究以β-actin为内参基因,利用2-ΔΔCt法计算Pm-FBP基因在不同组织以及实验温度下各时间点的相对表达量,分别以外套膜和22℃组为对照进行标准化处理以后,利用SPSS软件以进行单因素方差分析(One-way ANOVA)、组间表达量均值比较和Duncan多重比较(P<0.05)。
2 结果与分析
2.1 Pm-FBP序列分析
本研究通过RACE技术获得了Pm-FBP的全长序列。Pm-FBP总长为1381 bp,5′ UTR为54 bp,3′ UTR为62 bp,开放阅读框(ORF)为1020 bp,编码339个氨基酸(图1)。Pm-FBP无信号肽,无跨膜结构,具有FBP保守的FBPase结构域,1个潜在的N-糖基化位点,6个潜在的O-连接糖基化位点(Ser36、Ser56、Ser57、Ser76、Ser80和Thr115),46个磷酸化位点。
2.2 Pm-FBP质理化性质分析

图1 Pm-FBP的核苷酸序列分析 Fig.1 The nucleotide sequence analysis of Pm-FBP
Pm-FBP的理论分子量为37.13 kDa,等电点为6.02。其中,含量较高的氨基酸有Gly(G) 8.8%,Ser(S) 8.6%,Leu(L) 8.0%;带负电的残基总数(Asp+Glu) 为40个,正电的残基总数(Arg+Lys)为37个;脂溶指数是86.58,平均亲水性(Grand average of hydropathicity,GRAVY)为-0.211,为亲水性蛋白(图2)。FBP的二级结构预测结果显示,α螺旋结构占整体的30.97%,β转角为11.50%,延伸链为22.71%,无规则卷曲为34.81%。
2.3 FBP多序列比对及进化树构建
为确定Pm-FBP与其他物种的同源性,将Pm-FBP与长牡蛎(Crassostrea gigas)、虾夷扇贝(Mizuhopecten yessoensis)、文昌鱼(Branchiostoma belcheri)和果蝇(Drosophila elegans)的FBP序列进行比对,结果显示,Pm-FBP与长牡蛎FBP相似度最高,为83%(图3)。对Pm-FBP进行三级结构的预测,与长牡蛎、虾夷扇贝FBP的三级结构进行比较分析,发现三者的相似性极高,都以无规则卷曲为主(图4),说明FBP在三维结构上的保守性较高。

图2 Pm-FBP的疏水性 Fig.2 The hydrophobicity of Pm-FBP
将Pm-FBP与长牡蛎、虾夷扇贝、章鱼(Octopus bimaculoides)、海兔(Aplysia californica)、美洲鲎(Limulus polyphemus)、中华绒螯蟹(Eriocheir sinensis)、凡纳滨对虾、日本囊对虾(Marsupenaeus japonicus)、文昌鱼、锦龟(Chrysemys picta bellii)、鲦鱼(Cyprinodon variegatus)、红树林鳉鱼(Kryptolebias marmoratus)的FBP基因序列建立系统进化树,结果显示,FBP先与长牡蛎、虾夷扇贝汇聚一支,再与其他软体动物汇聚成一支,节肢动物和脊椎动物分别汇聚成两支(图5),这与传统的分类基本一致。
2.4 Pm-FBP在马氏珠母贝不同组织中的表达量检测
本研究通过实时荧光定量PCR技术检测Pm-FBP在马氏珠母贝闭壳肌、鳃、性腺、肝胰腺、足和外套膜的表达情况,结果如图6所示,Pm-FBP基因在不同组织中表达量的变化从高到低依次为GO>HE>GI>M>F>A,Pm-FBP在性腺中表达量最高(P<0.05),其次是肝胰腺和鳃,足和外套膜的表达量较低,闭壳肌中几乎不表达。
2.5 不同温度下马氏珠母贝鳃中FBP的时序表达
实验采用实时荧光定量PCR技术检测了Pm-FBP在鳃中的表达量,结果显示,Pm-FBP在高温组和低温组的表达量都出现了先升高后降低的趋势,且均在72 h时达到最大值(P<0.05),由此可推测,该基因与马氏珠母贝环境温度胁迫存在很强的相关性;120 h时,高温组和低温组Pm-FBP表达量均显著下降(P<0.05),说明Pm-FBP很可能主要在短期温度胁迫中起重要作用(图7)。
3 讨论
本研究利用RACE技术克隆获得Pm-FBP全长序列,该基因全长为1381 bp,共编码339个氨基酸。Pm-FBP具有FBP共有的一个保守结构域Pfam FBPase(曲玲等,2015; Cota-Ruizet al,2015),证实了本研究克隆所得到的序列为Pm-FBP。FBP是糖异生过程中的关键酶,受到异构调节、共价修饰和激素等机制的共同调节(王锐等,2010)。其中,共价修饰又包括蛋白的磷酸化和去磷酸化(Wanget al,2017)。Pm-FBP中存在46个磷酸化位点、6个O-连接糖基化位点和1个N-糖基化位点,也说明FBP可能通过蛋白质磷酸化修饰和糖基化来行使其蛋白功能(陈虎等,2016)。此外,Pm-FBP中存在1个FBPase序列基序DPLDGSS(Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser),此基序已被证明能够结合金属离子参与催化(Yorket al,1995),与FBPase需要金属离子催化的结论相符(Serratoet al,2009; Rakuset al,2013)。序列比对结果表明,Pm-FBP与长牡蛎FBP同源性最高,为83%;Pm-FBP与长牡蛎、虾夷扇贝的FBP三级结构极为相似,说明Pm-FBP在双壳类动物进化过程中相对保守。
实时荧光定量PCR结果显示,Pm-FBP在肝胰腺有较高水平的表达,与大菱鲆(Nieet al,2015)、银鲫(王锐等,2010)的研究结果一致。此外,研究表明,贝类处于繁殖期时,需要大量的能量储备用于精卵发育。在性腺发育过程中,贝体摄食获得的粗蛋白和粗脂肪含量随着精卵细胞的发育成熟不断增加,然后在休止期大量流失,糖类的含量在增殖期开始下降,成熟期达到最低,排放期后急剧升高,贝体肥满度及生化成分变化与繁殖周期的变化有着密切的关系(程亮等,2013; Mendoet al,2016)。本研究发现,Pm-FBP在性腺中高表达(P<0.05),说明FBP作为能量产生途径的关键酶,可能参与了性腺发育过程中的能量提供。
温度胁迫对贝类生理代谢具有显著影响。研究表明,海水温度剧烈变化时,急剧的水温变化对虾夷扇贝(吴彪等,2016; 高振锟等,2017)、栉孔扇贝(Azumapecten farreri)(Jianget al,2017)和文蛤(Meretrix meretrixL)(冯建彬等,2004)等海洋贝类的摄食能力、呼吸及排泄等均有较大影响。此外,温度能够直接影响贝体的新陈代谢活动,进而影响贝体的能量收支和生长过 程(姜娓娓等,2017)。糖异生作用是在机体处于饥饿状态下,各种非糖苷底物经过一系列酶促反应合成内源性葡萄糖的过程,以保证机体的血糖处于正常水平(宫官等,2013)。FBP作为催化糖异生过程中的限速酶,关于FBP应对温度胁迫的研究主要集中在植物(徐文亭等,2013; 何斌等,2015),贝类中关于温度胁迫与FBP的关系尚未明确。鳃是贝类的重要的代谢器官,具有呼吸和滤食等多种功能。作为与外界接触的器官,水温的变化能够直接影响鳃的功能以及作用。本研究采用实时荧光定量PCR技术检测了Pm-FBP在低温组、对照组和高温组马氏珠母贝鳃的时序表达模式。结果表明,Pm-FBP表达量在高温组和低温组都出现了先升高后降低的趋势,且均在72 h时达到最大值(P<0.05),由此可推测,该基因与马氏珠母贝生存环境温度和胁迫存在很强相关性;120 h时高温组和低温组Pm-FBP表达量均显著下降(P<0.05),这说明Pm-FBP很可能主要在短期温度胁迫中起重要作用。在植物体处于高温情况下,FBP基因在短期会有一个应激上调的过程,但在长期高温情况下,FBP表达会趋于稳定(陈虎等,2016; 曲玲等,2015),与本研究的高温组结果一致。推测贝体处于温度胁迫条件下,机体代谢水平下降,总糖含量处于较低水平,FBP通过参与糖异生过程使马氏珠母贝机体的糖含量处于正常水平。本研究结果证明了Pm-FBP基因可能是马氏珠母贝在适应温度骤变环境过程中的重要基因,为马氏珠母贝抗逆基因筛选以及温度胁迫响应机制的深入研究提供参考资料。

图3 Pm-FBP的多序列比对 Fig.3 Multisequence alignment of Pm-FBP
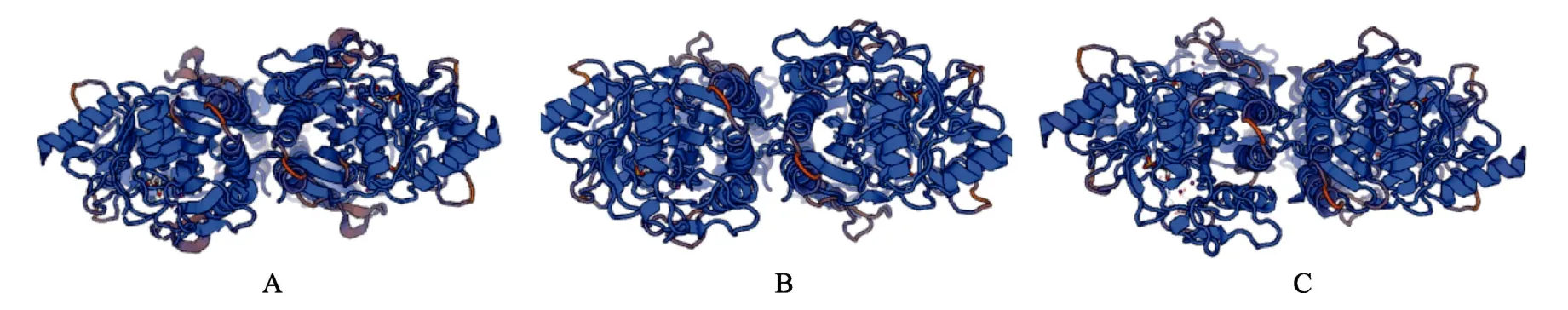
图4 马氏珠母贝(A)、长牡蛎(B)和虾夷扇贝(C) FBP蛋白质分子结构 Fig.4 The spatial structure of FBP Protein molecules in P.fucata martensii (A) ,C.gigas(B) and M.yessoensis(C)
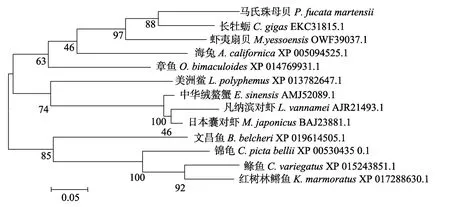
图5 Pm-FBP的系统进化树 Fig.5 The phylogenetic tree of Pm-FBP
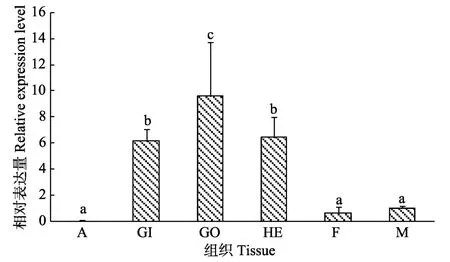
图6 Pm-FBP在马氏珠母贝不同组织中的表达分布 Fig.6 Pm-FBP gene expression profiles in different tissues of P.fucata martensii
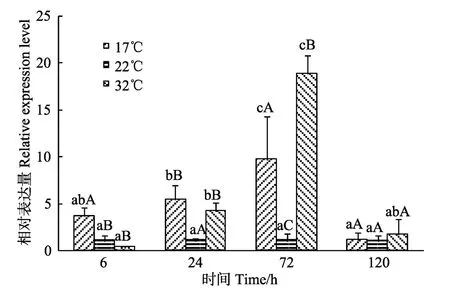
图7 不同温度下马氏珠母贝鳃中Pm-FBP基因的时序表达 Fig.7 Temporal expression of the Pm-FBP gene in the gills of P.fucata martensii at 17℃,22℃,and 32℃

