过表达FCHSD1对细胞增殖以及迁移行为的影响
梁天宇 许雯雯 王国庆 燕 冉 殷晓蕾
(山东第一医科大学生命科学学院,山东 泰安 271016)
FCHSD1是于2004年被发现的蛋白质,其基因定位在人类染色体的5q31.3位置[1]。FCHSD1属于F-BAR蛋白家族中的Fps/Fes亚家族。F-BAR蛋白也被称为Pombe Cdc15 homology(PCH)蛋白家族,在这类蛋白的N端往往有一个Fes/CIP4 homology(FCH)结构域即F-BAR结构域,随后会有一个螺旋(CC)区域,在其C端有一个或多个SH3结构域[2]。其中,F-BRA结构域能够彼此之间发生相互作用形成寡聚体,与细胞质膜结合。位于C端的SH3结构域通过与Wsp、dynamin、Dap160(Dynamin associated protein 160)等肌动蛋白(actin)调节蛋白相互作用,能够调控肌动蛋白丝(F-actin)的聚合[3]。F-BAR蛋白在哺乳动物细胞中发挥桥联作用,一边与细胞骨架相关蛋白相互作用,一边与质膜结合。例如,F-BAR蛋白家族中的PACSIN/syndapin亚家族蛋白在细胞质膜的形状变化和细胞骨架重排中发挥重要作用。Syndapin通过其C末端的SH3结构域与dynamin、synaptojanin以及N-WASP相互作用,从而促进F-actin的聚合,最终引起细胞质膜的弯曲[4-5]。另外,F-BAR结构域能够通过特异性结合某些种类的磷脂,从而与细胞质膜结合。但是F-BAR结构域对不同种类磷脂的亲和能力不同。例如,FBP17蛋白的F-BAR结构域能够与溶血磷脂酸、溶血软磷脂以及1-磷酸鞘氨醇等结合,但对磷脂酰肌醇4,5-双磷酸(PIP2)的亲和力较高,然而与磷脂酰肌醇-3,-4,-5-三磷酸(PIP3)和磷脂酰丝氨酸的亲和力却比较弱[6]。
F-BAR蛋白能够参与细胞骨架重组、细胞内吞等过程中。Syndapin蛋白能够促进F-actin的体外组装,促使细胞质膜的弯曲,在质膜运输和细胞骨架的重组中发挥作用[7-9]。PSTPIP2与肌动蛋白丝结合在一起以形成丝状伪足,并且抑制巨噬细胞产生褶皱[10]。在网格蛋白介导的内吞作用中,PACSIN/syndapin和CIP4亚家族蛋白在网格蛋白介导的内吞作用中发挥重要作用[11]。
某些F-BAR蛋白家族成员与神经性疾病、炎症性疾病以及肿瘤等疾病有关。例如,MEGAP在胎儿和成人的脑组织中过表达,在细胞迁移过程发挥重要作用[12]。如果患者细胞中的MEGAP活性丧失,临床表现为严重的神经发育迟缓[13]。另有研究发现,CIP4能够抑制乳腺癌的发生,而FCHSD2与白血病有关[14]。
虽然FCHSD1早已经被发现,但是对其生物学功能的研究还比较少。经研究发现,FCHSD1在体外能够与质膜结合蛋白SNX9相互作用,并且能够增强SNX9对依赖于WASP-Arp2/3的F-actin聚合过程,即FCHSD1能够间接促进F-actin的组装过程[15]。在细胞中过表达FCHSD1的F-BAR结构域能够促使细胞表面生长出毛刺状突起[16]。这些研究结果表明,FCHSD1很可能参与细胞骨架的调节过程。
本研究利用COS7细胞系构建稳定表达FCHSD1的细胞株,通过检测稳转细胞株的增殖情况以及迁移行为的变化情况,为进一步探讨FCHSD1的生物学功能提供理论依据。
1 材料与方法
1.1 试剂与材料
COS7细胞由山东大学生命科学学院惠赠。DMEM高糖培养基(英国Gbico公司),胎牛血清(天津市灝源生物科技有限公司),胰酶-EDTA(北京索莱宝科技有限公司),G418(上海生工),DMSO(Amresco分装),Anti-MYC抗体(美国sigma公司),anti-FCHSD1抗体(Novus公司),山羊抗小鼠IgG抗体(美国Bio-Rad公司),PVDF膜(美国Millipore公司),蛋白分子量Marker(加拿大Fermentas公司),Triton X-100(北京索莱宝科技有限公司),其他试剂均为国产分析纯。
1.2 方法
1.2.1细胞培养 利用含10% FBS、1×青链霉素的DMEM培养液培养COS7细胞,培养条件为5% CO2、37℃。
1.2.2稳转细胞株的构建 在六孔板中每孔接种约2.5×105个COS7细胞,共接种8个孔;待细胞铺盘率约80%时,向培养基中分别加入终浓度为0、200、400、500、600、700、800、1000 μg/mL的G418(100 mg/mL),每2天换1次培养基,连续培养2个星期,以确定G418的最低工作浓度为500 μg/mL。利用转染试剂lipo2000将质粒pMYC-C2-FCHSD1转染入COS7细胞中。转染48 h后,留取1/4的细胞于原板中,其余的细胞冻存。向细胞中加入含有终浓度为500 μg/mL的G418培养基,连续培养2~3周。将200~300个细胞转接于10 cm细胞培养板中,用含250 μg/mL的G418培养基进行培养。待长出单克隆后,用胰酶-EDTA消化后接于24孔板中继续培养并放大培养。在此期间均用含250 μg/mL的G418培养基进行培养。细胞生长正常后,再利用500 μg/mL的G418培养基进行压力筛选,以得到稳定表达MYC-FCHSD1的COS7细胞。
1.2.3Western blot 丢弃培养皿中的培养基,用1×PBS缓冲液清洗细胞表面,重复操作1次。向培养皿中加入适量体积的细胞裂解液。将培养皿放于4℃水平摇床上孵育20 min,在冰上用移液枪将细胞裂解液转移至无菌的1.5 mL EP管中。最高转速,4℃离心20 min,使蛋白液与细胞碎片分离,将上清转移至新的1.5 mL EP管中。加5×上样缓冲液,混匀后沸水浴煮10 min,瞬时高速离心后取上清,用Western blot检测。配制分离胶浓度为10%、浓缩胶浓度为5%的SDS-PAGE蛋白变性胶。上样后电泳。将PVDF膜浸入无水甲醇中活化5 min后,与滤纸一起浸入膜转移缓冲液中浸润5 min。加入适量膜转移缓冲液使PVDF膜处于半干状态。用10~15 V恒压电转60 min。将转有蛋白的PVDF膜用封闭液(PBS溶液配制的5%的脱脂奶粉)进行封闭,室温封闭1 h。PBS洗涤PVDF膜2次,每次10 min。用含3% BSA的PBS溶液稀释一抗至适宜的浓度,与含有目标蛋白的PVDF膜在4℃孵育过夜。PBS洗涤PVDF膜两次,每次10 min。用含3%脱脂奶粉的PBS溶液稀释二抗至适宜的浓度,室温孵育1 h。PBS洗涤PVDF膜4次,每次15min。在暗室里进行ECL显影。
1.2.4MTT实验 在96孔板中分别接种大约5000个稳定表达MYC-FCHSD1的COS7单克隆细胞,以不表达MYC-FCHSD1的单克隆细胞作为对照组,每种细胞样品分别做8个平行。在终止细胞培养的4 h前更换含终浓度为500 μg/mL的MTT溶液的低血清细胞培养基。然后向样品中加入DMSO溶液溶解产生的甲臜结晶,测定波长为570 nm处的吸光值。按上述操作分别测定细胞生长24、48、72 h的数值,然后进行统计学分析。
1.2.5划痕实验 在六孔板中接种适宜数量的稳定表达MYC-FCHSD1的COS7单克隆细胞,以不表达MYC-FCHSD1的单克隆细胞作为对照组。用200 μL的枪头沿直尺在每孔中划痕,用PBS清洗后无血清培养。拍照记录0 h的细胞状态,然后于24 h拍照观察。
1.2.6统计学方法 MTT实验数据使用Origi软件对OD值进行数据分析,计算细胞的增殖速率。使用Image J软件统计分析细胞划痕实验结果。在细胞划痕实验结果的图片中随机划取8条水平线,然后计算细胞的迁移速率。
2 结 果
2.1 过表达FCHSD1稳转细胞株的构建与检测
通过检测,确定G418的工作浓度为500 μg/mL。通过利用500 μg/mL的G418进行压力筛选得到稳定表达MYC-FCHSD1的COS7细胞株。分别利用anti-FCHSD1抗体和anti-Myc抗体进行Western blot检测,结果显示该细胞株能够稳定表达MYC-FCHSD1,但是对照组并没有表达MYC-FCHSD1,如图1。
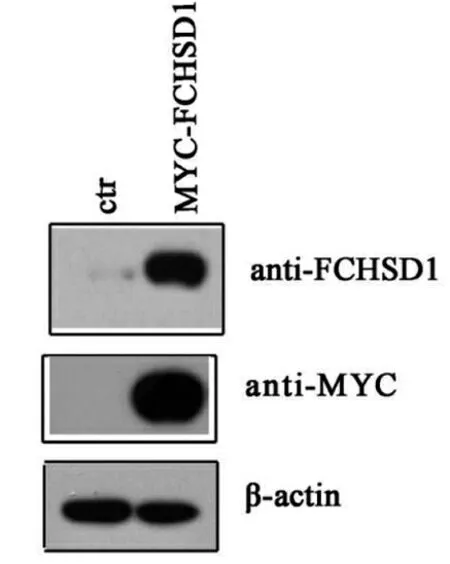
图1 稳定表达MYC-FCHSD1的COS7细胞株的检测
分别用anti-FCHSD1和anti-MYC的抗体检测筛选到的稳定表达MYC-FCHSD1的COS7细胞株的FCHSD1的表达情况,与对照组相比,阳性克隆稳定表达MYC-FCHSD1,蛋白上样量均为20 μg。
2.2 过表达FCHSD1稳转细胞增殖情况检测
MTT实验检测稳定表达MYC-FCHSD1的COS7单克隆细胞的增殖情况,结果如图2,与对照组相比,稳定表达MYC-FCHSD1的COS7细胞在24 h开始出现明显的生长抑制现象,48 h和72 h实验组的细胞增殖速率明显小于对照组。
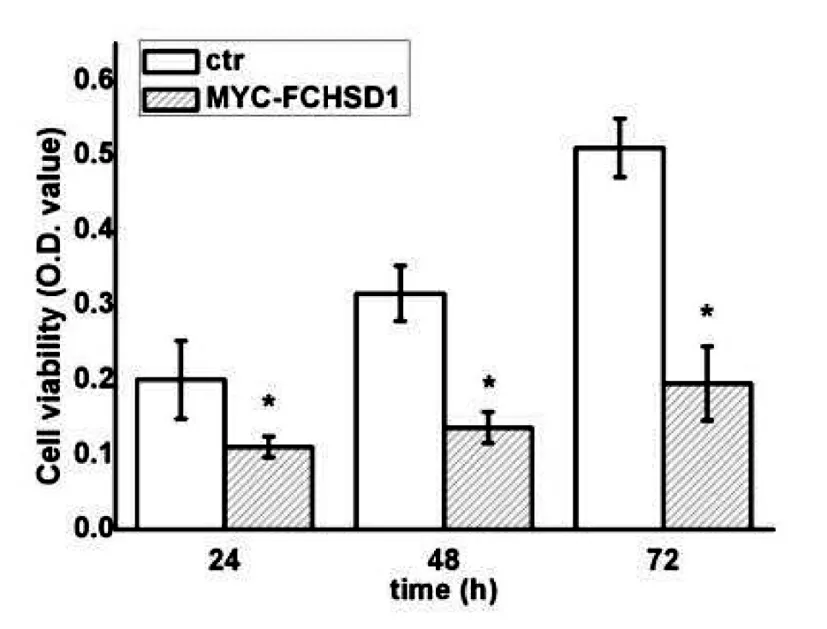
(*P<0.05,n=8)
图2 MTT法检测稳转细胞株的细胞增殖情况
2.3 过表达FCHSD1抑制COS7细胞中Akt的磷酸化
Western blot实验结果显示,过表达FCHSD1能够降低细胞中Akt的表达水平,并且下调p-Akt的表达量。在对照组细胞中,Akt和p-Akt的表达量均较高。
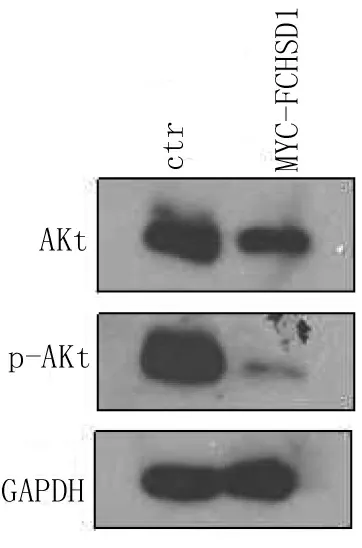
图3 Western blot检测稳转细胞株中Akt、pAkt的表达
2.4 过表达FCHSD1稳转细胞迁移能力的检测
细胞划痕实验结果(图4)显示,与对照组比较,过表达FCHSD1的COS7细胞的迁移速度没有明显改变。统计学分析结果显示,对照组和实验组的细胞迁移速率没有显著性差异。
3 讨 论
FCHSD1的N端有F-BAR结构域,然后是两个SH3结构域,在C末端有脯氨酸富集区。在哺乳动物细胞中,FCHSD1的同源蛋白是FCHSD2。在果蝇中,Nwk是FCHSD1和FCHSD2的同源蛋白。经过序列比对发现,小鼠FCHSD2与Nwk的同源性要高于小鼠FCHSD1[15]。经过前期的研究发现,FCHSD2在体外能够直接促进F-actin的组装过程,但是不与SNX9相互作用[15]。这说明,FCHSD1和FCHSD2存在功能差异。目前,对于Nwk生物学功能的研究比较明确[17-18],但是FCHSD1的生物学功能还不清楚。本研究预通过构建稳定表达FCHSD1细胞株来检测FCHSD1对细胞功能的影响。
Akt(蛋白激酶B)信号途径是细胞内重要的信号通路之一,在细胞周期、细胞凋亡等过程中具有重要的调节作用。Akt是恶性肿瘤相关的下游效应靶基因,其磷酸化水平能够直接影响细胞的增殖、细胞生存等生命活动。目前已经发现,Akt在乳腺癌、胃癌等多种恶性肿瘤中表达量升高,并且其活化状态也明显增强[19-20]。本研究实验结果发现,过表达FCHSD1能够抑制细胞中Akt的磷酸化水平。由此可以推测,过表达FCHSD1可能通过调控Akt信号途径来抑制细胞增殖。由此,FCHSD1在肿瘤细胞中的作用可以被进一步检测。
虽然,过表达FCHSD1能够影响细胞的增殖速率,但是不能明显改变细胞的迁移能力。结合前期的研究结果发现,FCHSD1是不能直接明显促进WASP-Arp2/3的F-actin组装的,但是能够通过与另一个细胞骨架相关蛋白SNX9的相互作用来促进F-actin的组装[15]。这说明,FCHSD1很可能不是直接参与微丝的组装,因此对细胞的运动能力没有明显的影响。
本实验初步检测了FCHSD1对细胞增殖、细胞迁移的作用,为进一步探讨FCHSD1的生物学功能提供依据。然而,目前对FCHSD1的研究还比较少,与FCHSD1相互作用蛋白还有待于被发现,基因敲除小鼠的构建能够为进一步研究FCHSD1的生物学功能提供有效途径。
利用G418成功筛选出稳定表达FCHSD1的细胞株。FCHSD1能够明显抑制细胞增殖速率,这可能是与FCHSD1参与Akt信号途径有关。但是FCHSD1对细胞的迁移行为没有明显的作用。
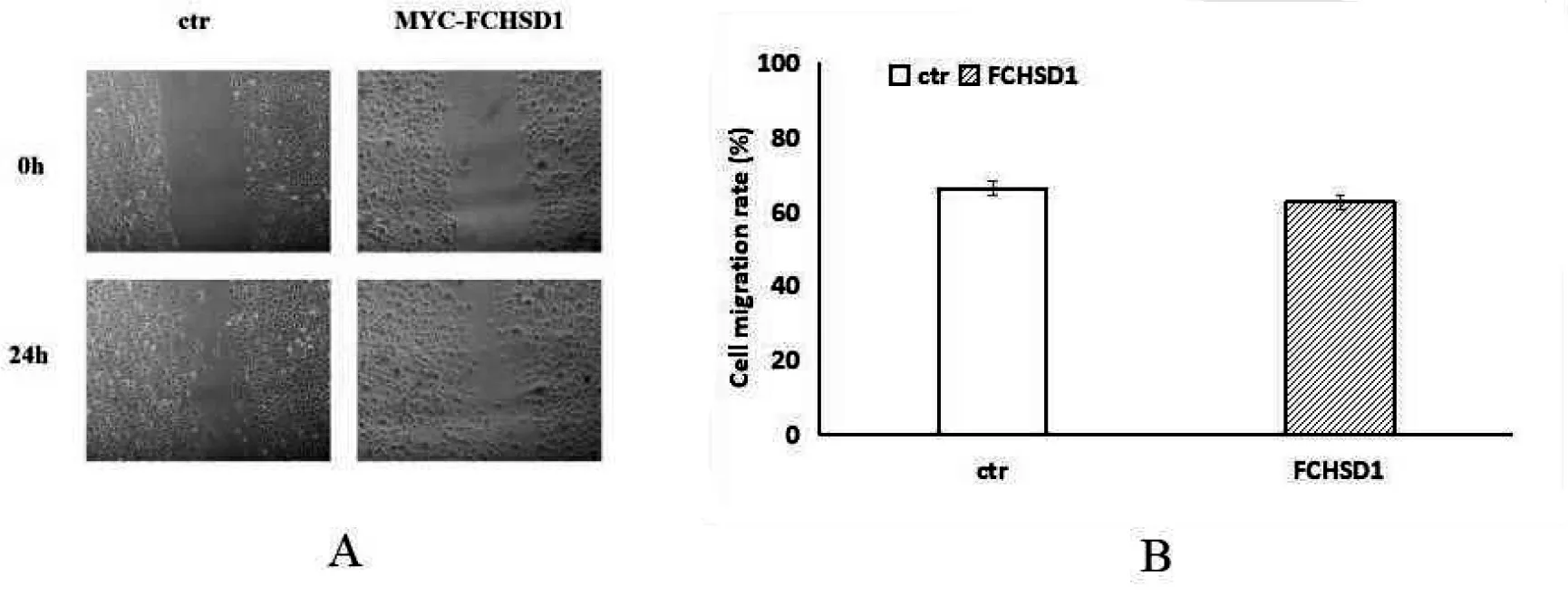
A:与对照组比较,过表达MYC-FCHSD1的COS7细胞迁移速度没有明显变化(×100);B:细胞划痕24 h后,细胞迁移速率的统计结果

