肿瘤干细胞标志物LGR5、Nanog在结肠腺癌组织中的表达及其临床意义
常戈鋆, 陈利娟, 陈慧莉
肿瘤的发生是多种基因的突变积累和交叉作用[1]。肿瘤干细胞标志物LGR5、Nanog及相关信号通路P13K、Wnt构成复杂的调控网络[2-3]。Nanog基因首次在囊胚期的内细胞团、原始生殖细胞以及胚胎干细胞中发现,后发现其与多种肿瘤相关,同时发现了普遍存在LGR5高度活化现象,二者均被认为参与了细胞因子调节作用并产生肿瘤免疫应答的抑制效应[4-5]。但目前,关于Nanog、LGR5与恶性肿瘤的研究主要集中于宫颈癌[6]、胃癌[7]等,其与结肠腺癌的关系研究很少。本研究收集132例结肠腺癌患者为研究对象,分析Nanog、LGR5在结肠腺癌中表达及其临床意义,以期为结肠腺癌的分子研究、预后判断提供更多依据。
1 对象与方法
1.1 临床资料 收集2011年10月至2014年6月航空总医院收治的行手术治疗的结肠腺癌患者为研究对象。纳入标准:① 病理学确诊为结肠腺癌;② 首次确诊;③ 患者均行手术治疗,手术切除标本保存于本院病理科或实验室。排除标准:① 围术期死亡;② 合并有其他恶性肿瘤;③ 临床资料或随访信息不全。132例纳入研究。其中,男70例,女62例;年龄38~88岁,中位年龄56岁。同时,收集同期60例结肠腺瘤患者临床资料,男35例,女25例;年龄32~81岁,中位年龄52岁。72例因其他良性疾病(其中结肠慢运输型便秘30例,乙状结肠冗长症20例,溃疡性结肠病13例,脾曲综合征9例)而行结肠切除的患者资料,男42例,女30例;年龄30~79岁,中位年龄54岁。本研究通过医院伦理委员会审查,患者知情同意。患者一般资料相比,差异无统计学意义,有可比性。
1.2 主要试剂 LGR5多克隆抗体(Abcam公司,美国),Nanog 多克隆抗体(Abcam公司,美国),免疫组化SP试剂盒购(Zymed 公司,美国),一抗工作液浓度为1∶100。DAB显色试剂(武汉博士德生物工程有限公司)。RIPA裂解液、30%聚丙烯酰胺凝胶、蛋白电泳上样缓冲液(5xSDS)均购自上海生工生物工程技术有限公司。
1.3 免疫组化 检测及结果判定组织均经甲醛固定后,石蜡包埋,厚切片,厚度4 μm。对组织切片进行常规脱蜡、水化,H2O2去离子水孵育,阻断内源性过氧化物酶的干扰。EDTA 液高温修复抗原,自然冷却后PBS冲洗,滴加50 μl LGR5多克隆抗体、Nanog 多克隆抗体(浓度1∶100),4 ℃冰箱孵育过夜。PBS冲洗3次,每次2 min。滴加二抗,37 ℃孵育20~30 min。PBS冲洗3次,每次2 min。DAB显色,苏木素复染,脱水,二甲苯透明,中性树胶封片。采用半定量积分法判断阳性结果,以出现棕色颗粒作为阳性标准。
1.4 Western blotting检测 制备12%分离胶、5%浓缩胶,配制SDS-PAGE缓冲液。调节电泳参数:浓缩胶80 V,0.5 h;分离胶120 V,1.5 h。从阳极到阴极,依次放置海绵、3M滤纸、PVDF膜、凝胶、3M滤纸、海绵。加入转膜液,恒压90 V,90 min,在室温下,用封闭缓冲液封闭60 min。严格按照试剂盒说明进行免疫反应。暗室中,在保鲜膜上等体积混合ECL试剂盒中试剂A和试剂B,将混合液与朝下膜蛋白面充分接触1 min后,将PVDF膜移至另一保鲜膜,移去残液。转移至凝胶成像系统机中进行曝光,以β-tubline为内参,进行图像分析,采用Image J软件对条带灰度值的比值进行对比分析。
1.5 统计学方法 采用SPSS 20.0软件进行统计分析。计数资料用率(%)描述,组间比较采用χ2检验;多因素分析采用Logistic风险模型进行;生存曲线采用Kaplan-Meier法统计,Log-rank 检验比较生存曲线的差异。P<0.05认为差异具有统计学意义。
表1 结肠腺癌、腺瘤及正常组织中LGR5、Nanog的表达

分组LGR5阳性阴性χ2值P值Nanog阳性阴性χ2值P值正常组织(n=72)12601.958a0.162a14583.301a0.069a结肠腺瘤(n=60)164422.591b<0.001b204024.537b<0.001b结肠腺癌(n=132)844841.255c<0.001c943850.114c<0.001c
注:a:结肠正常组织与结肠腺瘤组织相比;b:结肠腺癌组织与结肠腺瘤组织相比;c:结肠腺癌组织与结肠正常组织相比
2 结果
2.1 免疫组化检测LGR5、Nanog在腺瘤组织、结肠腺癌组织中表达 LGR5主要定位于细胞质,在细胞膜也有少量表达。LGR5在正常组织、腺瘤组织中不表达,在结肠腺癌组织中阴性、阳性表达均有,见图1;Nanog则主要定位于细胞核,Nanog在正常组织、腺瘤组织中不表达,在结肠腺癌组织中阴性、阳性表达均有,见图2。LGR5在正常组织、结肠腺瘤、结肠腺癌组织中的阳性率分别为16.7%(12/72)、26.7%(16/60)、63.6%(84/132)。Nanog的阳性率分别为19.4%(14/72)、33.3%(20/60)、71.2%(94/132)。LGR5、Nanog在腺癌组织中的阳性率高于腺瘤及正常组织,但腺瘤与正常组织之间的阳性率无明显差异(P>0.05)。见表1。

图1 LGR5在结肠腺癌组织中的表达1A:LGR5在结肠腺癌组织中阴性表达(×100);1B:LGR5在结肠腺癌组织中阳性表达(×100);1C:LGR5在结肠腺癌组织中阳性表达(×400)

图2 Nanog在结肠腺癌组织中的表达2A:Nanog在结肠腺癌组织中阴性表达(×100);2B:Nanog在结肠腺癌组织中阳性表达(×100);2C:Nanog在结肠腺癌组织中阳性表达(×400)
2.2 Western-blot检测结果 Western Blot检测结果显示, LGR5、Nanog在正常组织和结肠腺瘤组织中的表达差异无统计学意义(P>0.05);LGR5、Nanog在结肠腺癌组织中表达高于正常组织、结肠腺瘤组织,差异均有统计学意义(均P<0.05),见图3。
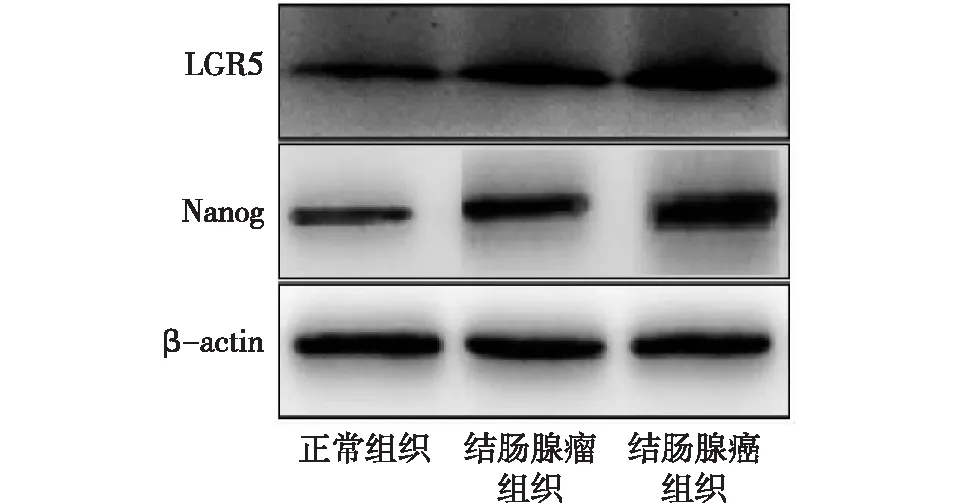
图3 Western-blot检测LGR5、Nanog表达结果
2.3 LGR5表达与临床病理参数的关系 单因素方差分析显示:结肠腺癌患者Dukes分期、分化程度、淋巴结转移是LGR5表达的影响因素,差异有统计学意义(P<0.05),见表2。多因素方差分析显示:结肠腺癌患者Dukes分期、分化程度、淋巴结转移是影响患者LGR5阳性表达的独立危险因素,有淋巴结转移、分化程度越低、Dukes分期越晚,LGR5的阳性率越高,差异有统计学意义(P<0.05),见表3。
表2 LGR5表达与临床病理特征的关系[例(%)]

临床参数例数(n)LGR5阳性(n=84)阴性(n=48)χ2值P值年龄(岁)0.3630.547 ≤605436(66.67)18(33.33) >607848(61.54)30(38.45)性别1.5690.21 男7048(68.57)22(31.43) 女6236(58.06)26(54.17)Dukes分期31.392<0.001 A+B6224(38.71)38(61.29) C+D7060(85.71)10(14.29)分化程度12.576<0.001 中-高7840(51.28)38(48.72) 低5444(81.48)10(18.52)淋巴结转移11.3190.001 有9250(54.35)42(45.65) 无4034(85.00)6(15.00)
2.4 Nanog表达与临床病理参数的关系 单因素方差分析显示:结肠腺癌患者Dukes分期、分化程度、淋巴结转移是Nanog表达的影响因素,差异有统计学意义(P<0.05),见表4。多因素方差分析显示:结肠腺癌患者Dukes分期、分化程度、淋巴结转移是影响患者LGR5阳性表达的独立危险因素,有淋巴结转移、分化程度越低、Dukes分期越晚,Nanog的阳性率越高,差异有统计学意义(P<0.05),见表5。
表3 LGR5表达与临床病理参数关系的多因素分析
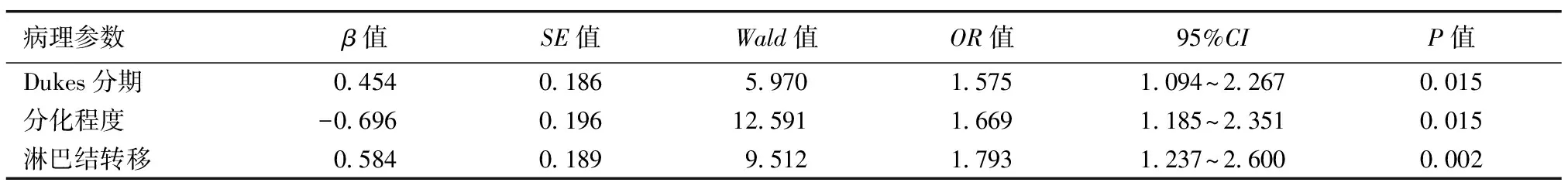
病理参数β值SE值Wald值OR值95%CIP值Dukes分期0.4540.1865.9701.5751.094~2.2670.015分化程度-0.6960.19612.5911.6691.185~2.3510.015淋巴结转移0.5840.1899.5121.7931.237~2.6000.002
表5 LGR5表达与临床病理参数关系的多因素分析

病理参数β值SE值Wald值OR值95%CIP值Dukes分期0.0320.00723.1521.0331.019~1.047<0.001分化程度0.5420.1769.5381.7201.219~2.4260.037淋巴结转移0.0050.0096.5681.0241.214~1.6330.008
2.5 生存率 随访截至2018年5月,132例结肠腺癌患者失访27例,成功随访105例,有效随访率为79.5%,中位随访时间56个月。LGR5(+)与LGR5(-)患者的中位生存时间分别为9.5个月、17.8个月,Nanog(+)与Nanog(-)患者的中位生存时间分别为7.8个月、16.6个月。Log-rank检验示,LGR5(-)组患者生存率高于LGR5(+)组(χ2=4.603,P=0.031),Nanog(-)组患者生存率高于Nanog(+)组(χ2=13.870,P<0. 001)。见图4。
表4 Nanog表达与临床病理参数的关系[例(%)]

临床参数例数(n)LGR5阳性(n=94)阴性(n=38)χ2值P值年龄(岁)0.0450.831 ≤605439(54.35)15(45.65) >607855(85.00)23(15.00)性别2.1970.138 男7046(65.71)24(34.29) 女6248(77.42)14(22.58)Dukes分期9.8580.002 A+B6236(58.06)26(41.94) C+D7058(82.86)12(17.14)分化程度13.929<0.001 中-高7846(58.97)32(41.03) 低5448(88.89)6(11.11)淋巴结转移15.841<0.001 有9256(60.87)36(39.13) 无4038(95.00)2(5.00)
3 讨论

图4 结肠腺癌患者的5年生存率曲线4A:LGR5(-)组与LGR5(+)组患者患者5年生存率曲线;4B:Nanog(-)与Nanog(+)组患者患者5年生存率曲线
在我国,随着人们生活习惯、食谱的变化,结肠腺癌发病率呈明显的上升趋势,每年新发病例40万[8]。结肠腺癌早期缺乏特异性症状或体征,很多患者在首次确诊时就处于中晚期,失去了最佳手术时机。如能在分子或基因层面,找到关键部位的基因、蛋白或其他环节,了解结肠腺癌发生发展机制,则有望确定新的诊断及治疗方法,为结肠腺癌早发现、有效治疗提供依据。肿瘤干细胞理论认为恶性肿瘤中存在一小部分具有干细胞特性的细胞,具有多向分化、自我复制、更新能力强等特点,可长期有效维持肿瘤生长与衰退的动态平衡[9]。LGR5、 Nanog是胚胎干细胞中表达的转录因子,参与了ESCs的自我更新和多向分化,二者被认为可能处于干细胞全能性调控机制的顶端,对下游基因介导的分化、更新能力密切相关[10]。Azhdarinia等[11]发现LGR5的高表达与肿瘤血管生成相关;Nanog则能与层黏蛋白等组织纤维结合,参与细胞与细胞间非特异性粘连。Tang等[12]发现LGR5、 Nanog在前列腺癌、精原细胞瘤等多种恶性肿瘤中的表达均上升。本研究发现,结肠腺癌分化程度、淋巴结转移、Dukes分期是影响患者LGR5、Nanog阳性表达的独立性危险因素。LGR5、 Nanog表达阳性的肿瘤细胞有着更高的生长活性,使结肠腺癌分化更差、更易发生淋巴结转移。同时,LGR5、Nanog在结肠腺癌组织中的表达高于正常结肠组织、结肠腺瘤组织(P<0.05),提示结肠腺癌生物学行为的优劣与LGR5、Nanog蛋白的表达水平呈负相关,即LGR5、Nanog蛋白表达水平越高,细胞的恶性转化可能性就越大。
目前,手术、化疗、放疗等综合治疗手段可明显减轻结肠腺癌患者肿瘤负荷,但并未能十分有效地防止肿瘤复发,患者的总体生存率仍不够高。肿瘤干细胞理论认为,肿瘤组织中存在数量极少的肿瘤干细胞,且多处于静止期,常规化疗药物无法有效杀灭,这就部分解释了许多患者在术后及化疗后易出现复发转移的现象。结肠干细胞一般位于结肠黏膜的隐窝基底部,可起源于正常结肠干细胞,也可起源于已分化成熟的结肠细胞,并通过转化获得自我更新能力,其表面常存在三磷酸腺苷结合盒转运体的异常高表达,被认为是结肠腺癌患者出现化疗效果不佳甚至化疗抵抗的根源。本研究132例结肠腺癌患者中,免疫组化结果显示LGR5、Nanog在癌组织中的阳性率均显著高于癌旁组织,Western-blot实验也得出了相同结论。此外,我们通过随访发现,LGR5(+)与LGR5(-)患者的中位生存时间分别为9.5个月、17.8个月,Nanog(+)与Nanog(-)患者的中位生存时间分别为7.8个月、16.6个月,LGR5(-)组患者生存率高于LGR5(+)组(P<0.05),Nanog(-)组患者生存率高于Nanog(+)组(P<0.05)。这可能与正常结肠细胞发生癌变后,肿瘤干细胞大量增殖,肿瘤组织中LGR5、Nanog表达上调,继而促进肿瘤分期提高、分化程度变差、淋巴转移增加。
综上所述, LGR5、Nanog可作为判断患者预后的潜在因子,未来可针对结肠腺癌中高表达LGR5、Nanog等具有干细胞特性的肿瘤细胞进行靶向治疗,提高疗效、降低复发率。但本研究样本量尚小,且为单中心研究,未来在更大样本量,更长随访时间的基础上进行多中心研究,或能得到更有价值的临床结论。

