冬季凤眼莲对盐胁迫的盐害表现及生理响应
周丁阳,徐娜娜,朱旭辉,徐嘉俊,盛建龙,王子豪
(浙江海洋大学水产学院,浙江舟山 316022)
凤眼莲Eichhornia crassipes (Mart.) Solms,是一种大型漂浮水生植物,喜高温湿润环境,是世界上生长繁殖速率极快,产量极高的水生植物之一。虽然被列为世界十大恶性杂草之一[1],但因其对水体污染物较强的吸收积累与分解转化能力,被成功应用于处理各类废水并在世界范围内得到了广泛的认可[2-3]。在25~35℃温度中,8 个月内能从10 株增长到80 万株,繁殖能力极强[4]。凤眼莲自1911年引入浙江省杭嘉湖平原后,现已广泛分布于我国19 个省(自治区、直辖市),在长三角、珠三角地区河流湖泊等淡水水域泛滥成灾[5-6],环境适应力惊人,但是对于凤眼莲在咸水或半咸水中自然生长的案例目前还未有报道。有研究发现,凤眼莲在盐度为10 的滩涂养殖废水中能较好的生长并吸收大量营养盐[7],说明其具有一定的耐盐力。然而,目前对凤眼莲的研究多集中在探讨其对水体氮、磷、重金属、有机污染物等的去除效果以及在污染水体中的响应机制[8-11],未见有关盐胁迫的报道。此外,凤眼莲为多年生水生植物,性喜温暖,在高温环境中生命力旺盛,但抗寒能力较弱[12],一般可耐低温5℃,当气温13℃或水温10℃以上才开始生长[13]。它在低温胁迫下叶片细胞内的电解质大量外渗,质膜透性增加[12],会造成生理干旱和有毒物质积累[14],因而有学者关注不同温度下凤眼莲的污水净化能力[15]。所以本试验在冬季研究凤眼莲对盐胁迫的盐害表现及生理响应将有更实际的应用意义。
试验在冬季开展,模拟不同盐胁迫环境,以凤眼莲叶的盐害表现,细胞膜膜脂过氧化反应、抗氧化酶活性以及渗透调节的生理响应来探讨凤眼莲的适应性情况,以期获得植物在舟山冬季的温度条件下最高耐受的盐度范围,为凤眼莲修复河口、内陆咸水湖等污染水体的工程应用提供参考。
1 材料与方法
1.1 供试材料
凤眼莲在舟山市温度条件(季风明显,年平均气温16.7℃,冬季平均7.0℃)自然生长,植物于2017年11月19 日采回,通过除杂清洗挑选,在室外PVC 大棚(透光率为85%~93%)内保持自然光照(午间光强为904.5~12 400 lx),于PP 材质48 L 方形透明储物箱(长55 cm×宽39 cm×高31 cm) 中使用标准配比的Hoagland 完全营养液(北京溪青青农业科技有限公司)中驯化2 周,驯化时气温为8.8~18.3℃,湿度为46%~96%,植株均长势良好。
1.2 试验设计
试验于2017年12月3 日在标准配比的Hoagland 完全营养液中添加海盐(广州益尔生物工程有限公司),设置5、10、14、18、21 的盐度梯度,以不添加海盐为对照(实测培养液盐度为1‰),每个盐度梯度设3个重复,共18 个培养单元。每个培养单元挑选株型相近、健壮、鲜重185.12±9.28 g 的凤眼莲用于盐胁迫试验,培养11 d,试验时气温为4~16.5℃,湿度为45%~94%。每天使用便携式pH 计电导率仪溶氧仪(AZ8603)测量培养水的水温、pH、DO 和盐度,并补充蒸发水分保证盐度条件,观察测量记录凤眼莲叶的盐害表现。11 d 后,各个培养单元称取0.3 g 左右的叶片用于生理生化指标测定。
1.3 盐害表现观察
根据凤眼莲叶的盐害表现,将盐害分级[16]划分为5 级,包括0 级,生长正常,叶片无伤斑无卷曲,且叶柄无盐害症状(图1A);1 级,轻度盐害,叶片伤斑或卷曲枯黄面积<25%(图1B);2 级,中度盐害,叶片伤斑或卷曲枯黄面积在25%~50%之间(图1C),或叶柄有膨压降低,稍变软保持直立;3 级,重度盐害,叶片伤斑或卷曲枯黄面积在50%~75%之间(图1D);4 级,极重度盐害,叶片伤斑或卷曲枯黄面积>75%(图1E),或叶柄严重膨压降低软化并且倒伏(图1F)。最后,根据如下公式[16]计算盐害指数(salt injury index,SI)。


图1 5 个盐害等级凤眼莲叶的形态特征Fig.1 Leaf morphological characteristics of E.crassipes on five salt injury levels respectively
1.4 相对生长速率计算
用电子天平(精度0.01 g)在试验开始及试验结束分别测得各组凤眼莲植株的鲜重,根据如下公式[17]计算相对生长速率(relative growth rate,RGR)。

1.5 生理生化指标测定
使用南京建成生物研究所的试剂盒,丙二醛(MDA)采用硫代巴比妥酸法、脯氨酸(Pro)采用酸性茚三酮比色法、超氧化物歧化酶(SOD)采用羟胺法、过氧化物酶(POD)采用愈创木酚法,测定凤眼莲叶片中氧化逆境产物和渗透调节物质的含量以及抗氧化酶活性。
1.6 数据处理
应用SPSS19.0 对数据进行相关性分析、单因素方差分析(one-way ANOVA)和LSD 多重比较,方差不齐时用非参数的kruskal-wallis H 检验。
2 结果
2.1 不同盐胁迫下凤眼莲的生长变化
2.1.1 盐害指数(SI)
对照组在5~7 d 出现盐害表现(表1),之后平缓,结束时的SI 为21.5%±2.2%,显著低于各盐处理组(P<0.05),有轻度盐害特征;5 的SI 在第4~6 天上升较快,结束时各个盐害级别特征的叶均有出现,SI 为45.0%±4.9%,显著低于高盐度组(P<0.05);10 的SI 逐步升高,在试验最后一天有平缓的趋势,达到72.4%±4.7%,有半数以上叶达到3 或4 级盐害特征,实验结束时对照组、5 和10 的SI 呈显著线性递增(R2=0.974,P<0.01);14、18 和21 的SI 在试验1 d 时迅速上升到52.0%±6.3%、79.2%±2.1%和80.7%±6.6%,培养11 d 后盐害表现明显,SI 均达到90%以上,且三者第10 d 开始无显著性差异。
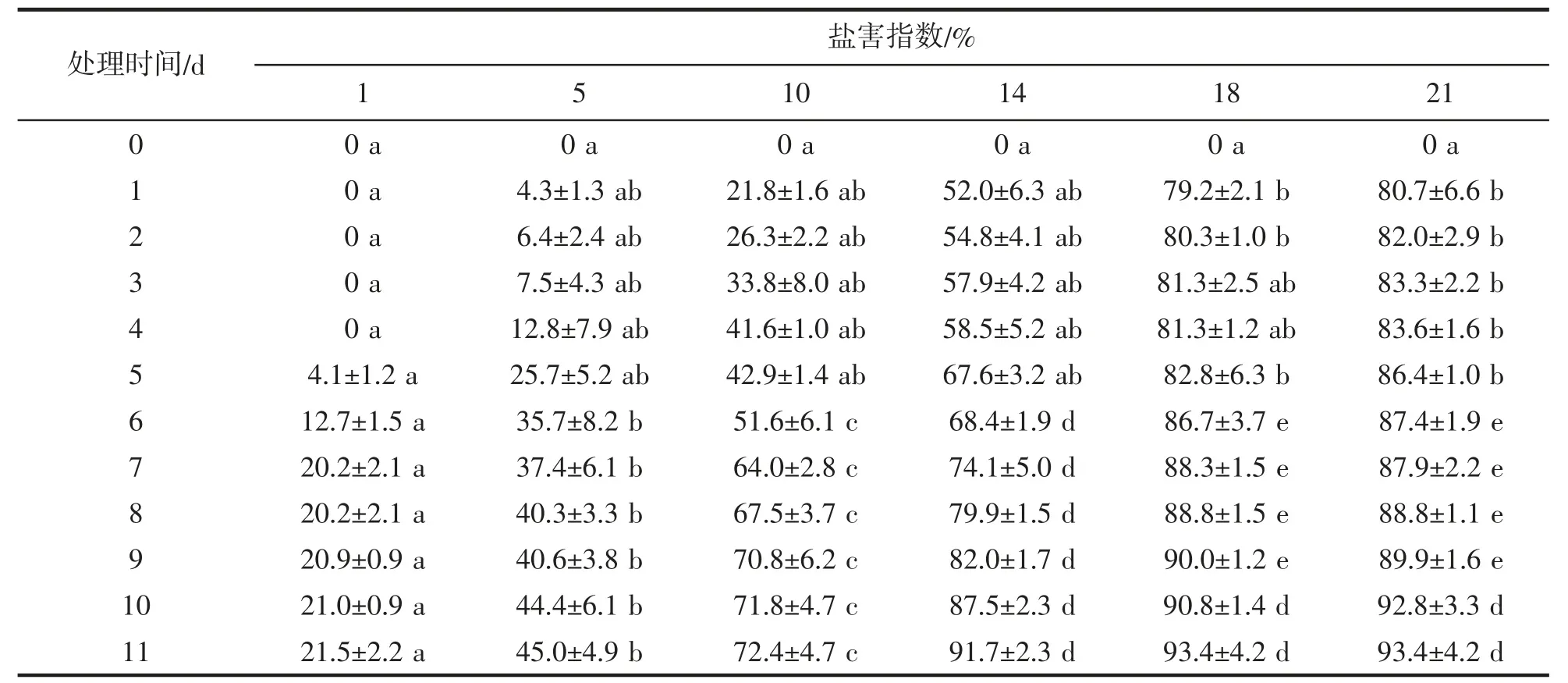
表1 不同盐胁迫下盐害指数随时间的变化Tab.1 Changes of SI with time under different salt stress
2.1.2 鲜重及株数
试验开始时各组鲜重及株数均无显著性差异(表2)。培养11 d 后,RGR 除对照组为0.52%±0.27%,盐胁迫处理组均为负值,10 及更高盐度与对照均存在差异性(P<0.05),其中10 的RGR 最低,为-0.90%±0.20%。对照组、5、10 的RGR 呈现显著的线性递减(R2=0.779,P=0.002)。
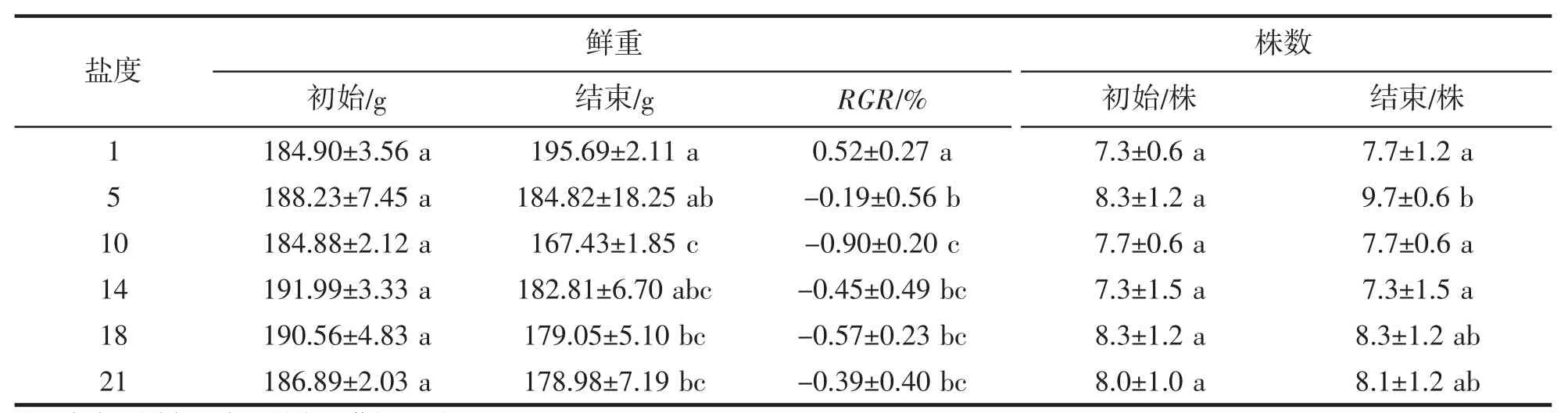
表2 不同盐胁迫下鲜重及株数变化Tab.2 Changes of fresh weight and the number of plants under different salt stress
2.2 不同盐胁迫下凤眼莲的生理响应
2.2.1 SOD 与POD 活性以及MDA 含量
凤眼莲叶片的SOD 活性表现出随盐度增加而增加的趋势(图3A),并且均显著高于对照组(P<0.05)。对照组SOD 为1 156.46±21.20 U·g-1,在14 下SOD 活性最高,为1 245.76±0.97 U·g-1。
随着盐度的升高,凤眼莲叶片的POD 活性表现出先升高再降低的趋势(图3B),在盐度14 下POD 活性达到最高,为340.33±11.24 U·g-1,是对照组的1.27 倍;而21 的POD 活性最低,下降至244.33±21.08 U·g-1,为对照组的0.91 倍。非参数kruskal-wallis H 检验结果显示,盐处理组凤眼莲叶片的POD 活性与对照组不存在显著性差异。
在不同盐胁迫下,凤眼莲叶片的MDA 含量积累不同(图3C),其中10 的MDA 含量最高,达到41.4±3.87 nmol·g-1,为对照组的1.44 倍,显著高于对照组以及5、14 和18(P<0.05)。对照组、5 和10 下叶片MDA含量随盐度增高呈显著线性增加(R2=0.615,P=0.012)。
2.2.2 Pro 含量
盐度从对照组逐级到10,盐胁迫逐渐加大,凤眼莲叶片中的Pro 含量也随之逐级升高(图3D),并且3个盐度之间存在显著性差异(P<0.05),叶片Pro 含量沿盐度增加而线性递增(R2=0.884,P<0.01)。Pro 含量在10 达到最高的57.07±9.20 μg·g-1,为对照组的2.63 倍,但当盐度继续升高反而有下降趋势,21 的含量为46.76±6.22 μg·g-1。
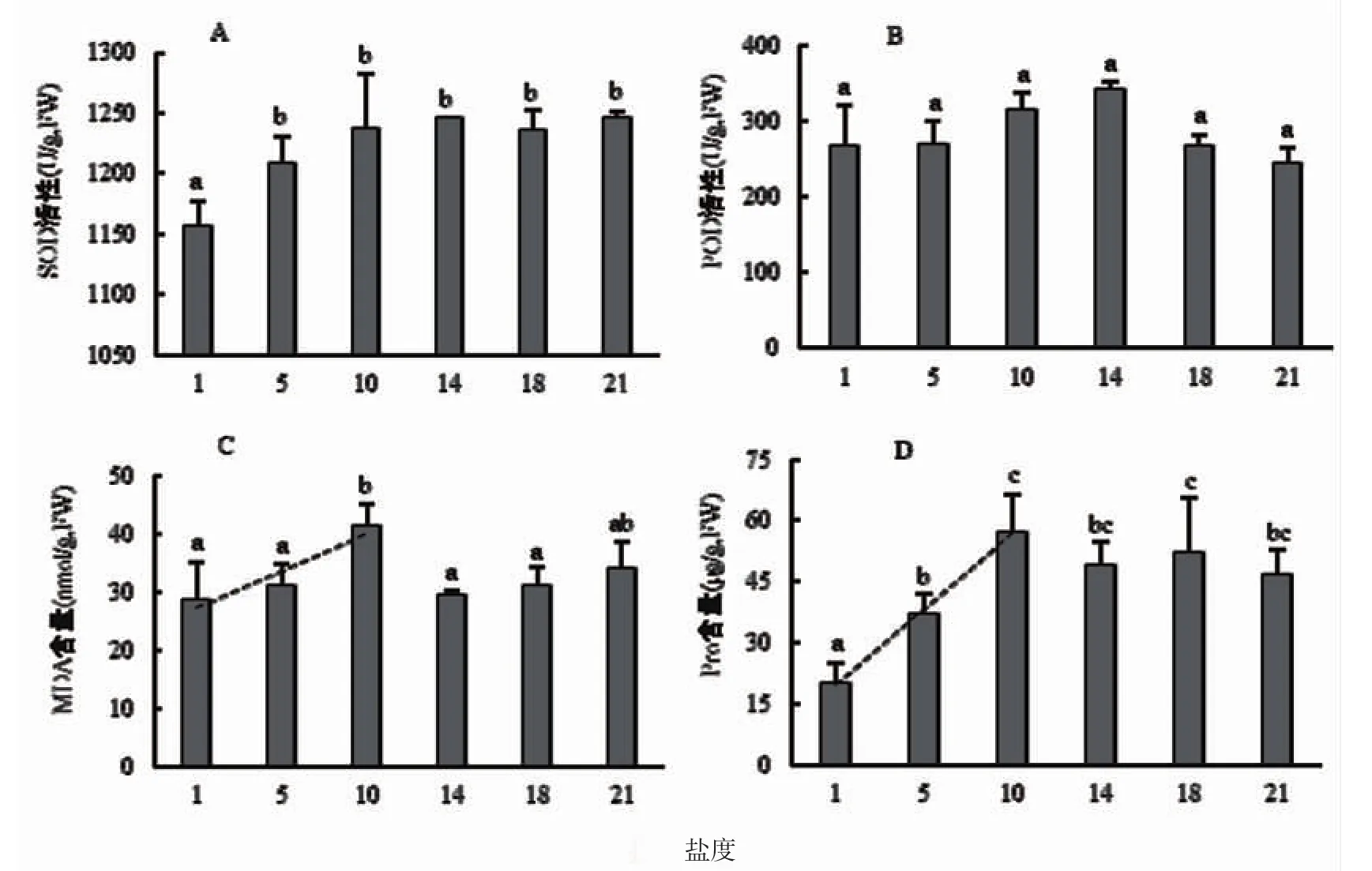
图3 不同盐胁迫下SOD 和POD 的活性以及MDA 和Pro 的含量Fig.3 Activities of SOD,POD and content of MDA,Pro under different salt stress
3 讨论
3.1 盐胁迫对凤眼莲叶的形态损害
试验期间多次受到冷空气影响[18],对照组凤眼莲因低温胁迫,部分叶片表现为外缘枯黄的特征[19]。盐胁迫引起植物的水分亏缺以及离子毒害,处理组均出现不同程度的盐害特征。5 的植株在胁迫开始后部分叶片外缘略微卷曲,出现水渍状斑点,受损部分之后逐渐枯黄,顶生幼叶始终保持健康状态。其SI 在4~7 d也快速升高,说明同期也受到了低温的影响。最后数据趋于稳定表明凤眼莲通过自我调节已经适应了5 的盐度环境。10 的凤眼莲在胁迫开始后大量叶片脱水卷曲,之后外缘逐渐枯黄,试验8 d 后植株无健康叶片,而叶柄的盐害表现不明显。叶片的非正常衰老说明凤眼莲在10 的盐胁迫下表现出牺牲局部来维系生命的被动适应策略[20]。叶片的脱水使得植株鲜重大量减少,只有当其通过自我调整,水势下降到与环境相同或更低时,才能从外界环境吸收水分以维持生命活动[21],其SI 在最后2 天趋向平缓可能是这个原因。
而在14、18 和21 的严重胁迫环境中,胁迫开始后凤眼莲叶柄与高盐水体接触,巨大的水势可能造成了其严重的伤害,引起膨压下降无法支撑叶片重量而倒伏[22],SI 快速升高,在后续的观察中发现,这种叶柄的损伤是不可逆的。叶缘出现大量伤斑,表现为失绿,泛白的特征,之后枯黄且伤害面积逐渐增大。相比之下,前期10 叶片失水卷曲得更厉害,可能是由于凤眼莲需要叶片通过通气组织向下传输氧气,供根系呼吸和根区的脱毒作用[23],而根系又处在水分胁迫中无法向上供水,由于蒸腾作用失水卷曲。在14 及以上的胁迫中叶柄的损伤阻断了气体通道,蒸腾作用相对较弱,但气体代谢不畅会致使植株衰退[23],叶片与根系失去了根冠通讯[24],后期会更快地衰老死亡,这与之后的观察相符。SI 在14 下的不断升高表明了冬季凤眼莲无法在该盐度的水环境中生存。
3.2 盐胁迫对凤眼莲生理的影响
植物在逆境下遭受伤害会发生膜脂过氧化作用,MDA 是膜脂过氧化的最终产物[25-26]。随着盐度的升高,凤眼莲受到的胁迫压力增大,其逆境氧化产物积累增多,但是到14 的水环境中MDA 含量却有一个显著的降低,结合凤眼莲的形态变化,其14、18、21 下的植株在试验1 d 后就出现大量叶柄膨压降低,软化倒伏的现象,加速叶片的衰老死亡,导致MDA 含量反而降低,有研究也发现在胁迫超过植物耐受极限时MDA含量下降的结果[27]。表明到盐度14 时,凤眼莲的叶柄就无法耐受盐胁迫而引起大量死亡。
植物在逆境条件下,体内抗氧化防御系统的启动以清除过多的ROS,减缓植物所受伤害[20,28]。凤眼莲在5 时即受到了胁迫压力,SOD 活性显著增强以加快清除体内产生的ROS,维持细胞的正常生命活动[25,29]。说明在冬季的环境下,凤眼莲叶片的SOD 活性对水体盐度比较敏感。而到10‰以后,SOD 活性保持在一个较高水平不再升高,这可能是因为SOD 已经达到了其最高的酶活性。POD 也是植物抵抗外界胁迫重要保护酶之一[30]。凤眼莲叶片的POD 活性在6 个盐度条件下不存在显著差异,这可能是由于低温胁迫抑制了酶活性[12],POD 对盐度的升高不再敏感。
凤眼莲在高盐环境下处于生理干旱状态会大量合成渗透调节物质来保持自身较低的水势[21,31],在盐浓度未达到损伤植物生长的前提下其叶组织Pro 的响应能反映植株受盐胁迫的相对程度[32]。当水环境从对照组到10 的变化中,凤眼莲叶片中的Pro 含量也随之逐级显著升高,并且存在较好的线性关系,这说明植株受到盐胁迫的相对程度在逐渐提高。有研究认为Pro 不仅能提高植物的渗透压,还能提升植物抗氧化剂的活性[33]。而当盐度继续升高时,Pro 含量反而有些降低,这表明到10 条件时凤眼莲可能已经达到了Pro含量积累的最高值,并且当盐度继续升高,胁迫强度超过了植株的耐受范围,细胞无法维持Pro 的合成工作,最终也会导致凤眼莲的死亡[34]。Pro 含量的结果也表明凤眼莲无法适应盐度14 的水环境。
通过Pearson 相关性分析(表3),植物体内SOD 酶活性、Pro 含量变化与水体盐度三者之间均呈极显著正相关变化(P<0.01),这表明冬季凤眼莲对盐胁迫的生理相应中,SOD 酶活性的提高以及Pro 的合成积累对植物的抗逆性起着重要作用。
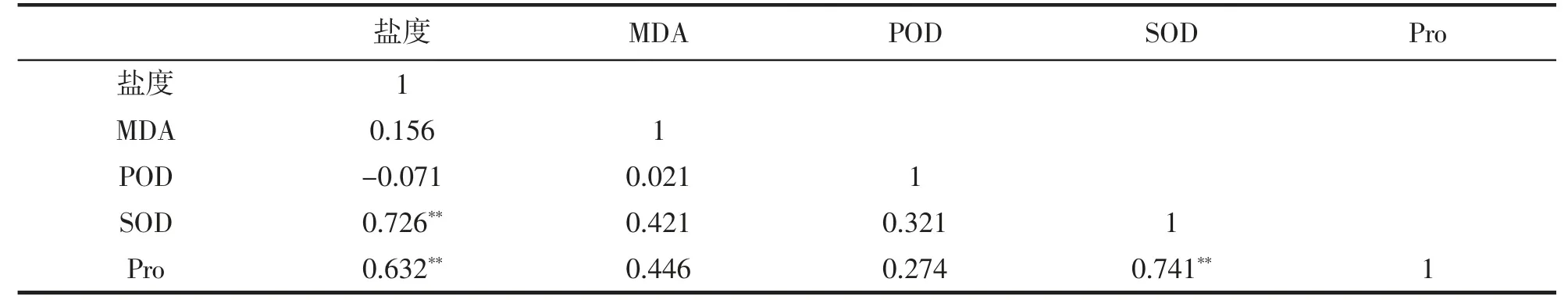
表3 盐度和植物生理生化指标的Pearson 相关性分析Tab.3 Pearson conclusion of the physiological indexes and salinity
综上所述,在舟山冬季温度条件下,凤眼莲在5 和10 的盐胁迫中以叶片的形态损伤为主,当盐度达到14 及更高其叶柄会失水倒伏。叶片中MDA 含量增多,植物表现出SOD 活性显著提高,积累Pro 等的应对策略,其中Pro 含量对SOD 活性呈正相关性,但当盐胁迫超过植物耐受极限(本试验中为14)时MDA 含量下降。而POD 活性受到低温抑制,对盐胁迫不敏感。凤眼莲自我调节能力有限,冬季可耐受的最高盐度可能在10~14 之间。

