一种制备高存活性肠膜明串珠菌冻干制剂的方法
韩瑨,冯华峰,乔祯逸,吴正钧
(光明乳业股份有限公司乳业研究院,上海乳业生物工程技术研究中心,乳业生物技术国家重点实验室,上海200436)
冻干粉是采用真空冷冻干燥技术将待冻干样品中水分先行预冻,然后在真空无菌的环境下逐渐提高环境温度,将样品中的被冻结的水分升华而最终得到的干燥粉状物。由于冻干粉的制备工艺可以极大限度的保留样品原有的生物活性,因此,较多应用于中草药、乳酸菌等领域。以乳酸菌为例,植物乳杆菌(Lactobacillus plantarum)[1]、干酪乳杆菌(Lactobacillus casei)[2]、嗜酸乳杆菌[3](Lactobacillus acidophilus)、动物双歧杆菌[4](Bifidobacterium animalis)、乳酸乳球菌[5](Streptococcus lactis)等常规乳酸菌的冻干保护技术已有大量研究和报道,而这些技术大多采用先发酵后收集菌体,再重悬于保护剂中冷冻干燥的传统方法,尽管技术相对成熟,但在菌体收集和重悬过程中,往往伴有菌体损失、杂菌污染等不利因素或风险,因此,新型、高效且安全的冻干技术亟待解决。
明串珠菌属细菌(Leuconostoc)是一类乳品生产中重要的商业化菌株,在分类学上隶属于细菌界(Bacteria)—厚壁菌门(Firmicutes)—杆菌纲(Bacilli)—乳杆菌目(Lactobacillales)—明串珠菌科(Leuconostocaceae),广泛分布于植物表面及发酵制品(泡菜、果酒等)中的肠膜明串珠菌(Leuconostoc mesenteroides)[6]、柠檬明串珠菌(Leuconostoc citreum)[7]等均为典型的明串珠菌。根据生物学特性的差异,肠膜明串珠菌又可分为4个亚种:右旋糖酐亚种(L.m.subsp.dextranicum)、乳脂亚种(L.m.subsp.cremoris)、肠膜亚种(L.m.subsp.mesenteroides)[8]以及苏木亚种(L.m.subsp.suionicum)[9]。2012年5月8日,肠膜明串珠菌肠膜亚种经过长期的论证,最终被《中华人民共和国食品安全法》和《新资源食品管理办法》正式列入《可用于食品的菌种名单》,然而该菌株仅有的冻干技术[10]与上述常规乳酸菌基本类似,因此其冻干工艺面临着与后者相同的问题与风险。
前期研究发现,L.mesenteroides BD1710(CGMCC NO.6432)可在预调pH值和添加蔗糖的番茄汁蔗糖培养基中发酵产糖[11],并经预试验证实上述发酵液的冻干粉中BD1710的存活率较高,因此,本文在前期优化数据的基础上,采用响应面法继续考察培养温度、蔗糖浓度、培养时间、初始pH值4个因素对BD1710冻干存活率的影响,并对预测的优选条件进行验证和比较,最后评价冻干制剂的稳定性以及该冻干技术的通用性。
1 材料与方法
1.1 菌种与试验材料
L.mesenteroides BD1710(CGMCC 0847):光明乳业股份有限公司;L.mesenteroides LM57、LM79:丹尼斯科公司;L.mesenteroides ATCC10830a:美国菌种保藏中心。
M17琼脂/液体培养基:英国奥克塞德公司;成熟番茄:市售;脱脂乳粉:光明乳业股份有限公司;蔗糖、海藻糖、NaOH、MnSO4(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
SQ2130Z型榨汁机:上海帅佳电子科技有限公司;HVE-50型高压灭菌锅:日本HIRAYAMA公司;SG-402TX型超净工作台:美国THE BAKER COMPANY公司;AVANTI J30I型高速冷冻离心机:美国BECKMAN COULTER公司;HZQ-F160型摇床:苏州培英实验设备有限公司;GNP-9270型隔水式恒温培养箱:上海精宏实验设备有限公司;PHS-25型pH计:美国奥立龙公司;XW-80A型漩涡混合仪:上海青浦沪西仪器厂。
1.3 试验方法
1.3.1 发酵种子的制备
从 L.mesenteroides BD1710(CGMCC NO.6432)、LM57、LM79、ATCC10830a的冻存管中以接种环挑取少量菌粉划线于M17蔗糖琼脂培养(以2.0%蔗糖取代M17培养基中0.5%的乳糖,在120℃下灭菌20 min即得)上,置于恒温培养箱中28℃好氧培养24 h后取出,用接种环挑取单菌落接入1 mL M17蔗糖液体培养基中,采用涡旋混合仪将细胞均匀分散后,28℃、180 r/min摇床培养24 h后取出,再按2%接种量接种于50 mL上述M17蔗糖液体培养基中,于28℃、180 r/min摇床培养24 h,培养液经15 000 r/min离心10 min后取沉淀,并以相同体积的无菌蒸馏水清洗3次后重悬,即得发酵用的种子。
1.3.2 培养基和传统冻干保护剂的制备
番茄汁的制备:成熟番茄清洗、去皮,榨汁,果汁部分经多层纱布过滤后,经15 000 r/min离心10 min,取清液即得。
番茄汁蔗糖培养基的制备:向100%的番茄汁中加入10%、15%、20%的蔗糖,加热溶解并冷却后,用5.0 mol/L食品级NaOH调节pH值至6.0、7.0和8.0,在120℃下灭菌20 min即得相应蔗糖浓度及初始pH值的无菌番茄汁蔗糖培养基。
传统冻干保护剂的制备:将脱脂乳粉、海藻糖、蔗糖、MnSO4分别装于透明包装袋内,进行辐照灭菌后,在无菌条件下以无菌水溶解混合制成如下浓度的冻干保护剂:脱脂乳粉(10%)、海藻糖(3%)、MnSO4(0.25%)、蔗糖(4%),备用。
1.3.3 BD1710番茄汁蔗糖发酵液的制备及冷冻干燥
将1.3.1方法制备的L.mesenteroides BD1710发酵种子以2.0%接种量无菌操作接入1.3.2方法制备的番茄汁蔗糖培养基中,分别于15、25、35℃摇床(180 r/min)恒温培养12、24、36 h即得发酵液。将上述方法制备的发酵液置于超低温冷冻冰箱中预冻12 h后,置于冷阱温度为-50℃的真空冷冻干燥机内冻干24 h。
1.3.4 传统方法制备BD1710冻干制剂
将1.3.1方法制备的L.mesenteroides BD1710发酵种子以2.0%接种量无菌操作接种于pH7.0,蔗糖浓度为15%的番茄汁蔗糖培养基中,28℃、180 r/min摇床培养24 h得发酵液,加入4倍无菌蒸馏水后8 000 r/min离心10 min,弃上清,向菌泥中加入1.3.2方法制备的传统冻干保护剂(菌泥∶保护剂=1∶3,质量比),用漩涡混合仪振荡使菌均匀悬浮于保护剂中[10]。将上述方法制备的菌体重悬液置于超低温冷冻冰箱中预冻12 h后,置于冷阱温度为-50℃的真空冷冻干燥机内冻干24 h。
1.3.5 冻干存活率的测定
利用M17平板计数法检测样品冻干前(发酵液/菌体重悬液)和后(冻干粉)中的BD1710活菌总数,两者的比值即为冻干存活率,计算公式如下:
冻干存活率/%=冻干后活菌总数(CFU)/冻干前活菌数(CFU)×100
1.3.6 响应面试验优化因素的最佳水平
为了确定最佳的冻干工艺,参考前期BD1710产糖的优选条件[11],选取培养时间(A)、培养温度(B)、初始pH(C)、蔗糖浓度(D)4个主要因素为自变量,冻干存活率为响应值,采用Box-Behnken响应面法(response surface methodology,RSM)设计中心组合试验,因素与水平见表1。
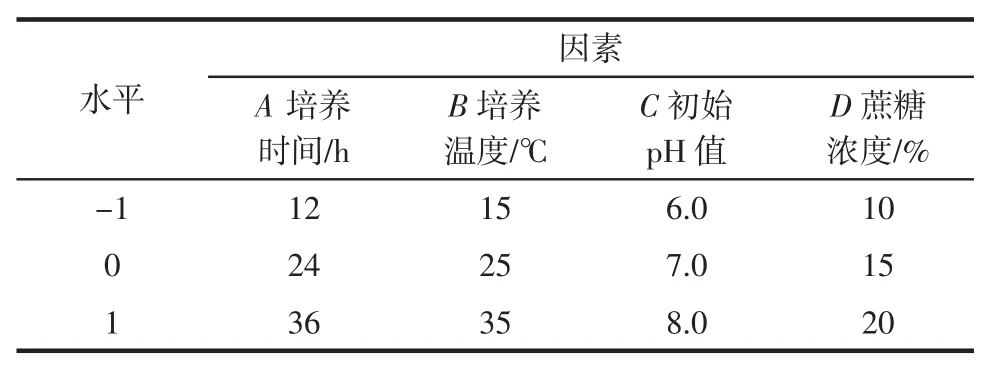
表1 响应面因素与水平表Table 1 Factors and levels of RSM
1.3.7 验证与比较试验
根据1.3.6方法得到的优选条件以及1.3.4所述的传统冻干方法[10]制备冻干制剂,对响应面预测值进行验证并比较不同冻干技术的存活率差异。
1.3.8 冻干制备的稳定性
将优选发酵条件下制备的冻干制剂装入无菌的铝箔袋内,分别置于常温(25℃)和冷藏(4℃)条件下保存 12 个月,其中每隔 3 个月,即 0、3、6、9、12 个月取样测定活菌总数。
1.3.9 冻干技术的适用性
参照优化后的制备方法,分别发酵制备获得L.mesenteroides BD1710(CGMCCNO.6432)、LM57、LM79、ATCC10830a的冻干制剂(n=3),测定各菌株的冻干存活率。
1.3.10 数据统计分析
采用Design Expert 8.0.6软件进行响应面设计、数据分析及回归模型建立,运用Origin Pro 2016、Excel 2013进行作图。
2 结果与分析
2.1 Box-Behnken响应面试验及回归分析
本研究选用Box-Behnken响应面试验对多变量发酵体系中的研究因素(培养时间、培养温度、初始pH值、蔗糖浓度)和评价因素(冻干存活率)的相关性和及其相互影响进行分析,通过软件(Design Expert 8.0.6)推算建立二次回归数学模型,进而获得优选的发酵因素组合。
根据Box-Benhnken中心组合试验的原理,设计N=29的四因素三水平的响应面分析试验,其中析因点24个,区域中心零点的重复试验5个。试验设计与结果如表2所示。
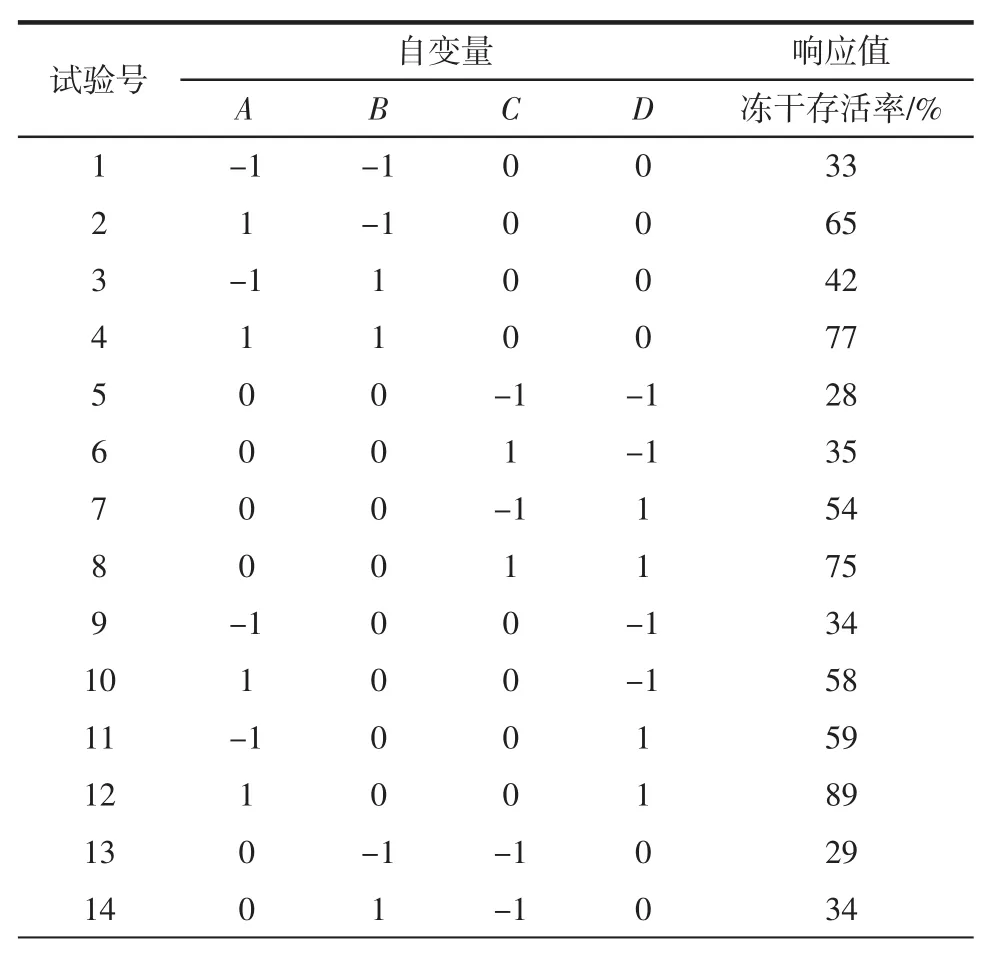
表2 响应面设计与结果Table 2 Design and results of RSM
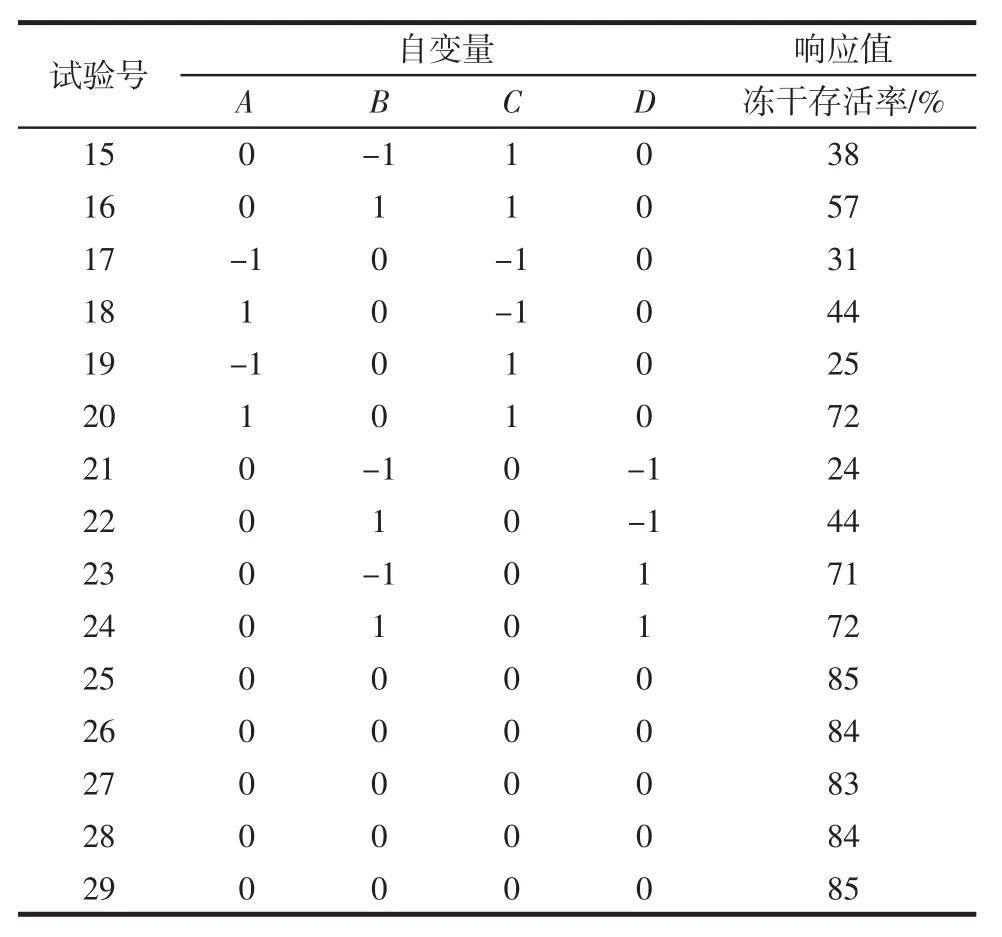
续表2 响应面设计与结果Continue table 2 Design and results of RSM
进一步利用Design Expert 8.0.6对表2中的数据进行回归分析,得到如下多元二次响应面回归模型:冻干存活率(%)=88.20+15.08A+4.67B+7.67C+16.42D+0.75AB+8.50AC+1.50AD+6.00BC-4.75BD+3.50CD-14.64A2-21.27B2-29.27C2-12.89D2。该模型的 R2=0.9874,调整R2=0.974 8,说明回归方程与数据的拟合度较高,可解释97.48%试验所得结果。
二次响应面回归模型的方差分析结果见表3。
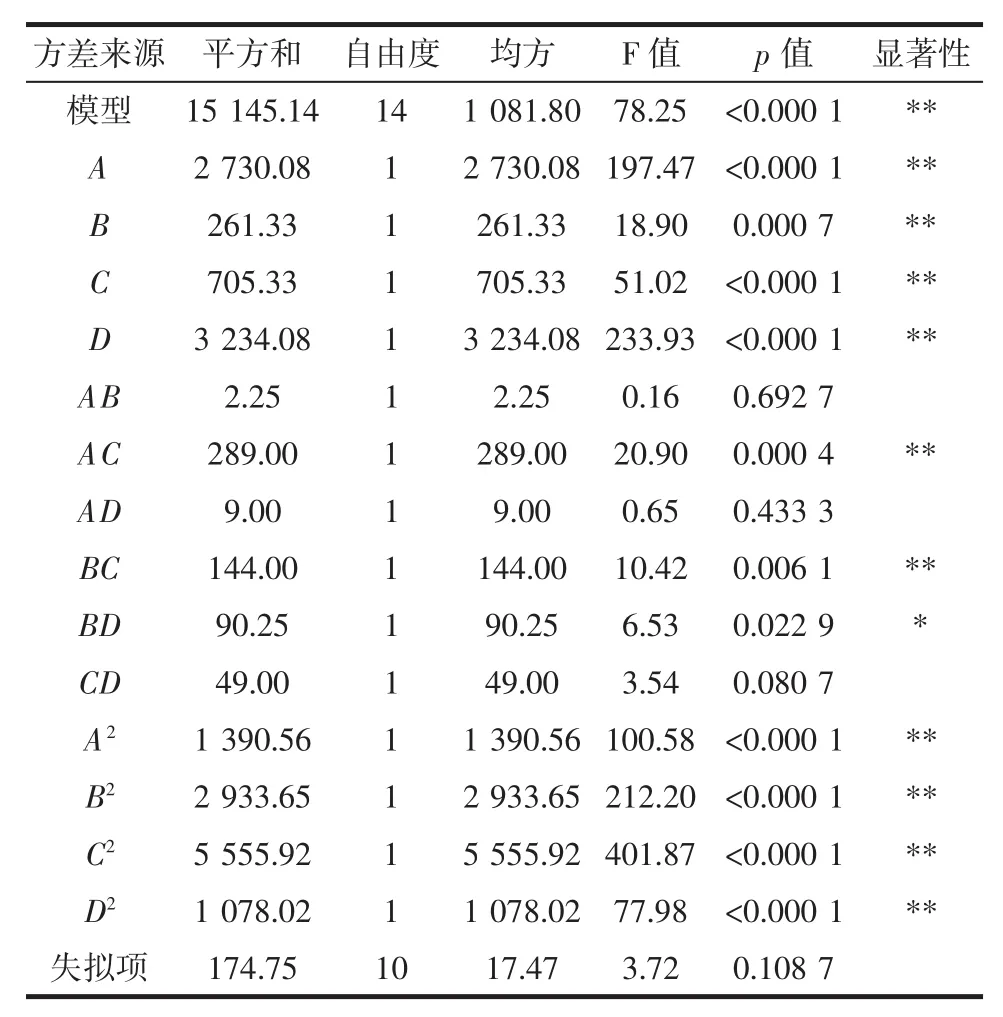
表3 二次响应面回归模型的方差分析结果Table 3 Variance analysis results of the quadratic response surface regression model
该模型显著(p<0.000 1),且无失拟因素存在(失拟项p值为0.108 7>0.05)。各因素的交互作用对菌体冻干存活率的影响顺序为:AC(p,0.000 4)>BC(0.006 1)>BD(0.022 9)>CD(0.080 7)>AD(0.433 3)>AB(0.692 7),其中,部分因素的交互作用(A和D、B和C)对冻干存活率的影响如图1所示。
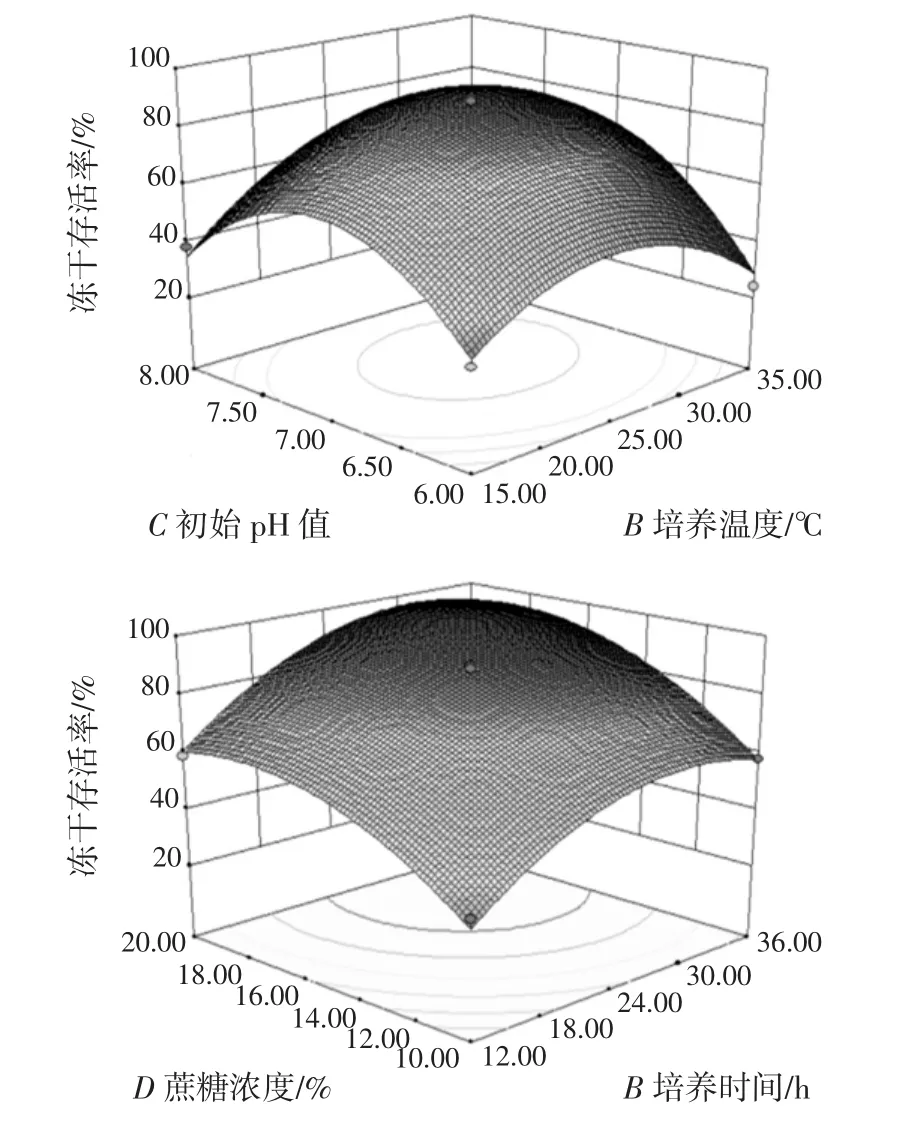
图1 初始pH值和培养温度、蔗糖浓度和培养时间的交互作用对冻干存活率的影响Fig.1 The effect of the interactions of initial pH and cultivation temperature,sucrose concentration and cultivation time on the survival rate of freeze-drying
由图1可知,各因素在所选范围均存在响应最高点,这与表3中模型的显著性结果一致。根据二次回归模型的预测,当培养时间为29.61 h,培养温度为29.49℃,初始pH值为7.34,蔗糖浓度为16.74%时,菌株BD710的最高冻干存活率可达95.57%。综合考虑了后续验证试验的可操作性,对上述优化条件进行修正:培养时间为29.5 h,培养温度为29.5℃,初始pH值为7.3,蔗糖浓度为16.8%。
2.2 验证与比较试验
为验证预测值的可靠性,在优选条件下制备冻干制剂(n=3),检测菌株的冻干存活性能。同时,参照传统工艺[10](1.3.4所述方法)制备冻干制剂(n=3),继而与前述优化条件下获得的冻干制剂进行存活率的比较,结果如图2所示。
经验证,在优化条件下,BD1710的冻干存活率均值为92.44%,基本与模型预测值(95.57%)处于同一水平,试验数据与预测值较佳的拟合度表明响应面法对BD1710冻干工艺的优化是有效的。

图2 验证与比较试验结果Fig.2 Results of the validation and comparison experiments
另一方面,采用传统的菌体收集、保护剂重悬等方法制备BD1710冻干制剂,结果发现,冻干存活率(76.81%)与文献报道持平,却远低于本文优化后的菌体保护效果,其原因可能是:一、BD1710代谢蔗糖产生了大量的高分子聚合物[11];二、发酵底物中的蔗糖本身具有一定的冻干保护作用[12],而番茄汁中的番茄红素、VC等则是协助微生物有效规避氧毒害的天然抗氧化剂[13-14];三、传统工艺离心收集菌体时产生的剪切力,对菌体造成了物理伤害,使沉降菌体中的活菌数下降,进而导致离心存活率的降低[15],上述因素引起了两种制备方法在终产品菌株存活性能方面的显著性差异。
2.3 冻干制剂的稳定性
将BD1710在优选条件下制备的冻干制剂分别置于5℃和25℃(室温)进行12个月的保藏试验,保藏不同时间后活菌数的测定结果如图3所示。

图3 BD1710冻干制剂在5℃和25℃保藏条件下的活菌数变化Fig.3 Viable counts changes in freeze-dried BD1710 preparation during stored in 5℃and 25℃
5℃冷藏条件下,BD1710冻干制剂中活菌数的对数值为 9.83~8.54(即活菌数为 6.80×109CFU/g~3.50×108CFU/g),而室温25℃条件下,单位质量冻干制剂中BD1710的活菌数对数值为9.83~5.15(即活菌数为6.80×109CFU/g~1.40×105CFU/g)。该保藏试验结果表明,BD1710在低温条件下的存活效果显著优于室温的效果,前者的活菌数量可在长达一年的保藏期内稳定维持在每克1亿个(1.00×108CFU/g)以上,而后者的活菌数却在保藏期内严重下滑。这可能是由于低温条件延缓了BD1710的代谢速率,有助于其冻干制剂具备至少12个月的活菌数保障能力,这种现象普遍存在于其他乳酸菌冻干制剂的保藏研究中,例如保藏在室温的双歧杆菌冻干制剂的存活能力下降幅最大,而随着贮藏温度的降低,存活性能逐渐提高,当贮藏温度为-18℃时,菌株的存活效果最佳[16]。
2.4 方法的通用性
在优化条件下,分别发酵制备获得L.mesenteroides BD1710 (CGMCC NO.6432)、LM57、LM79、ATCC10830a的冻干制剂(n=3),不同菌株的冻干存活率如图4所示。

图4 不同肠膜明串珠菌的冻干存活率Fig.4 Freeze-dried survival rates of different Leuconostoc mesenteroides
不同肠膜明串珠菌在相同条件下制备的冻干制剂的存活率差异很大。在各菌株的冻干制剂中,BD1710的存活率最高(92.44%),ATCC 10830(82.90%)次之,LM57(74.50%)最低,可能是菌株间生长特性的差异决定了各自存活性能的不同,或与培养基中天然保护剂(蔗糖、VC)的消耗量有关,或受到冻干保护相关代谢产物产量的影响,或兼而有之。尽管各菌株冻干制剂的存活性能的高低不一、各不相同,但所有测试菌株的冻干存活率均达70%以上,表明经肠膜明串珠菌发酵后番茄汁蔗糖培养基,直接冷冻干燥来制备冻干制剂的加工工艺具有一定的通用性,适用于其他的肠膜明串珠菌。
3 结论与讨论
随着当代乳业技术的飞速发展,明串珠菌的重要性逐渐得到普遍的认同,尽管它们的生理学和遗传学的研究程度还不如其他乳球菌,却随处可见于各种乳制品发酵剂或乳品环境中,因此,被称为非发酵剂乳酸菌(non-starter lactic acid bacteria,NSLAB)。研究显示,明串珠菌具有调节肠道紊乱[17]、代谢果糖生成甘露醇[18]、合成 K 族维生素[19]、水解 α-半乳糖苷[20]、产细菌素[21]等益生功能,同时有助于形成干酪孔眼[22]、产生风味物质[23]。此外,肠膜明串珠菌还可在蔗糖的诱导下产生糖基转移酶,后者将蔗糖酶解并键合成右旋葡聚糖(dextran,大分子葡聚糖聚合物的一种)[24],具备增粘、稳定、乳化水体系以及持水性等加工性能[25],可作为天然来源的稳定剂或增稠剂来替代现有的合成添加剂应用于食品工业,然而与潜力巨大的应用市场形成鲜明反差的是,目前所使用冻干保护技术依然相对传统,这些技术的基本步骤为发酵、菌体收集、重悬、冷冻干燥,尽管工艺路线比较成熟,然而在菌体收集和重悬过程中,往往伴有菌体损失、杂菌污染等不利因素或风险,因此,研究与开发肠新型的膜明串珠菌冻干制剂的生产工艺是满足工业化生产需求的必要前提。
本文采用响应面法考察了培养温度、蔗糖浓度、培养时间、初始pH值4个因素对BD1710冻干存活率的影响,结果发现,当培养时间为29.5 h,培养温度为29.5℃,初始pH值为7.3,蔗糖浓度为16.8%时,菌株BD710冻干存活率的理论值可达95.57%。进一步的验证与比较试验显示,实际值(92.44%)与理论值基本一致,并显著优于传统工艺的冻干保护效果(76.81%)。另一方面,与传统工艺相比,尽管由于冻干工艺的简易性致使所得的冻干粉纯度有所欠缺,然而在菌株存活性能方法优势巨大。此外,该法制备的冻干制剂在低温保藏条件下具有一定的稳定性,保藏于4℃的冻干制剂其活菌数量可在12个月内稳定维持在每克1亿个(1.00×108CFU/g)以上,并且此工艺通用性强,适用于其他肠膜明串珠菌冻干制剂的生产。

