响应面法优化窖泥中一株产酯酵母的扩培条件
刘梅,黄治国,卫春会,邓杰,谢军
(四川理工学院酿酒生物技术及应用四川省重点实验室,四川自贡643000)
中国白酒具有酒体透明、清澈纯净、口感协调、芳香四溢、入口爽净、饮后回味悠久等特点[1]。中国浓香型白酒的发酵设备为全泥窖池,窖泥是其发酵设备的核心“部件”,通过长期的驯化,窖泥逐渐形成一个稳定的生态系统,都是有利于酿酒的微生物,其中包括多种霉菌、酵母菌、细菌、放线菌等,是一个“群微共酵”的完整微生物体系[2]。因此窖泥是包括酵母、己酸菌、甲烷菌等酿酒功能菌株的良好来源[3-5]。
浓香型白酒生产中,酵母自溶可为发酵微生物提供营养及香味的前体物,提高己酸活菌数及代谢产物的产量[6-8]。庄名扬等曾在酱香型酒高温堆积糟里分离出几株具有一定发酵能力的酵母,其发酵液呈现出不同香味,同时,在意大利酵母的作用下产生浓郁的芝麻香[9]。庞博于白酒酒醅中筛选出的酵母(Pichia ku-driavzevii)表现出较强香味物质生产能力[10]。唐洁等通过麸皮汁培养基利用酿酒酵母(Saccharomyces cerevisiae)和异常毕赤酵母(Pichia anomala)进行混菌发酵,表明混菌发酵能够形成更多的酯类物质[11]。
响应面优化法广泛应用于食品,生物,环境等各方面[12-16],为此本试验通过筛选白酒窖泥中产酯性能较好的菌株,利用响应面法优化其增殖培养条件,为酿造优质白酒提供产酯酵母来源和一定的技术参考。
1 材料与方法
1.1 材料、培养基与试剂
窖泥样品来自川南某白酒厂生产老窖池,所取样品用塑封袋密封后,迅速置于低温取样盒中,冷藏运回,于4℃保存待用。
酵母菌分离培养基(yeast extract peptone dextrose medium,YEPD):葡萄糖 20 g,酵母膏 10 g,蛋白胨20 g,琼脂20 g,蒸馏水1 000 mL,121℃高压蒸汽灭菌20 min[17]。
酵母菌液体培养基:葡萄糖20 g,磷酸氢二钾1 g,硫酸镁0.5g,硫酸铵0.5g,酵母膏1g,蒸馏水1000mL,121℃高压蒸汽灭菌20 min[17]。
乙酸丁酯(色谱纯)、葡萄糖、磷酸氢二钾、硫酸镁、硫酸铵、酵母膏(分析纯):成都艾科达化学试剂有限公司。
1.2 试验仪器与设备
SW-CJ-2D超净工作台:江苏苏净集团有限公司;ZWYR-D2403恒温培养振荡器:上海智城分析仪器制造有限公司;GC7890-5975MSD气相色谱-质谱联用仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 产酯酵母菌株的初筛
称取0.5 g窖泥加入到装有49.5 mL灭菌生理盐水的三角烧瓶中,振荡培养2 h,吸取培养液1 mL,进行不同浓度梯度稀释,分别取0.2 mL涂布于酵母菌分离培养基上,28℃倒置培养48 h,选择具有酵母菌菌落特征的单菌落进行划线[18],并纯化3次。由10位身体健康,无不良嗜好、偏食和变态性反应[19]的同学组成评价小组,对发酵后的酵母菌培养液进行外观及气味的评价,综合评价,挑选出产酯能力较好的酵母菌。
1.3.2 产酯酵母菌株的复筛
酵母液体培养基于37℃培养箱中培养,转速为120 r/min摇床振荡培养3 d,发酵结束后,取5 mL发酵样品进行顶空液相微萃取,利用气相-质谱联用仪(gas chromatographic-mass spectrometry,GC-MS)对发酵产物进行分析。
顶空固相微萃取:移液枪准确吸取5 mL液态发酵样品及60 μL 20 mg/100 mL的乙酸丁酯内标于顶空瓶中,振荡摇匀,将顶空瓶放入全自动固相微萃取仪中,55℃平衡15 min,将已老化的萃取头插入样品瓶的顶空部分,萃取30 min,解吸6 min。
色谱条件:色谱柱(DB-WAX,60 m×0.25 mm×0.25 μm);载气:氦气,进样口温度 250℃,分流比为20∶1,升温程序:初始温度45℃,保持1min,以6℃/min升至180℃,保持2 min,再以20℃/min升至230℃,保留5 min。
质谱条件:接口温度240℃,离子源温度200℃,离子化方式EI,电子能量70 eV,全扫描。
内标法[20](假定各组分的响应因子为1)计算公式为:mi=(ms/As)×Ai
式中:mi为组分的质量;ms为内标物的质量;Ai为组分的峰面积;As为内标物的峰面积。
1.3.3 酵母菌生长性能检测
生物量检测法:采用恒重法[21-22]。
1.3.4 菌株鉴定
采用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法和酶解法相结合提取菌株DNA,对5.8S ITS区段进行序列扩增,测序委托擎科生物有限公司完成,得到序列结果提交NCBI数据库,进行同源序列检索,将目标菌株与较高同源性菌株作同源性比较分析[23]。
1.3.5 酵母增殖培养条件优化1.3.5.1 单因素试验
初始培养条件为:温度为28℃、pH值为6.5、培养时间为3 d、接种量为3%、锥形瓶规格为100 mL(50%)、种子液为培养4 d的菌悬液,转速为120 r/min。分别对温度、pH值、培养时间、接种量、装液量、接种种龄、转速进行单因素试验,其中温度分别为28、31、34、37℃和 40 ℃;pH 值分别为 4.0、5.0、6.0、7.0、8.0;生长时间分别为 2、3、4、5 d和 6 d;接种量分别为 1%、2%、3%、4%、5%和6%;装液量分别为10%、20%、30%、40%、50%;接种种龄为 2、3、4、5 d 和 6 d;培养转速梯度为60、90、120、150、180 r/min。每组试验做 3 个平行,通过恒重法反映菌体生长情况。
1.3.5.2 Plackett-Burman设计
Plackett-Burman试验设计可以通过较少的试验从众多影响因素中筛选出具有显著影响的因素[24-26]。以前期单因素试验为基础,本试验选用 N=12的Plackett-Burman设计对7个因素(装液量、培养时间、接种量、培养温度、转速、pH值、接种种龄)进行考查,每个因素取+1和-1两个水平[27],因此本试验取相邻两个梯度的值作为+1和-1两个水平,响应值为酵母菌细胞干重Y(g/L),得到的编码水平如表1所示,用软件Minitab17处理试验数据,比较各因素的t值和可信度。
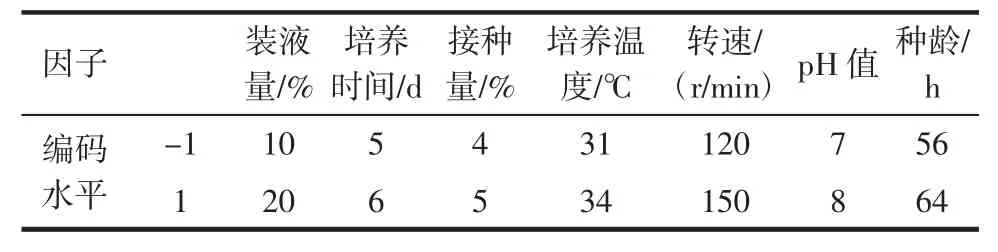
表1 部分因子试验设计的因子和水平Table 1 Experimental factors and their levels of the 2-level factorial design
1.3.5.3 最陡爬坡试验
根据Plackett-Burman试验结果,对达到显著水平的影响因素设定步长及变化方向,逼近最佳区域。其他因素根据其对应的效应系数的正负和大小确定,找到响应值最高的条件,作为下一步响应面分析的中心点。
1.3.5.4 响应面分析试验方法
根据1.3.5.3的试验结果,确定装液量、培养温度和接种种龄3个因素取值的中心点,中心点作为零水平。利用Design-Expert.V8.0.6软件进行Box-Behnken试验及数据分析。以装液量、培养温度和接种种龄3个影响因素为自变量得到的编码水平如表2所示。

表2 Box-Behnken试验因素编码水平Table 2 Box-Behnken test factor coding level
1.3.5.5 酵母菌增殖结果验证
将预测的最佳响应值按所得条件重复3次试验进行验证[28]。
2 结果与分析
2.1 初筛结果
从浓香型白酒窖泥中分离出9株酵母菌,编号为NJ-1至NJ-9,分别划线于固体培养基上,28℃培养3 d,对其结果进行闻评见表3。
试验筛选到的酵母菌产酯情况各异,其中NJ-1、NJ-2、NJ-8号菌株产酯能力相对较强,并且无明显异味出现,可作为本次试验初筛所得菌株,进行复筛。
2.2 复筛结果
本试验研究初筛所得3株酵母菌株发酵产酯能力的差异见图1。

表3 酵母菌感官风味评定Table 3 Sensory flavor assessment of yeast
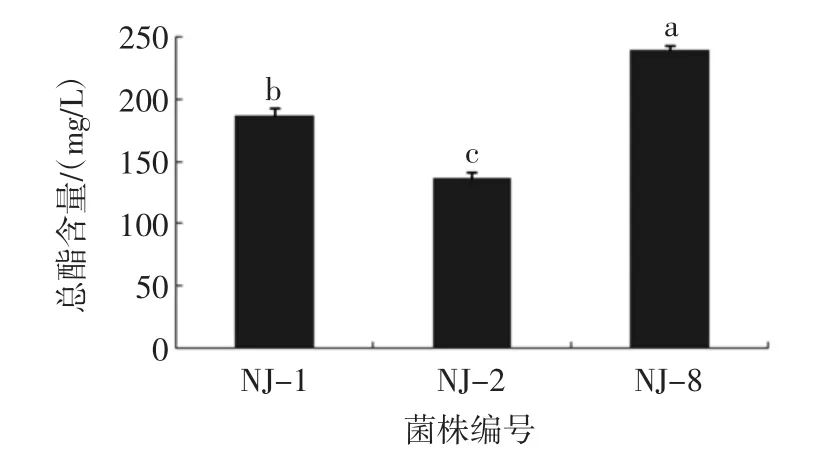
图1 NJ-1、NJ-2、NJ-8号菌株总酯含量图Fig.1 Total ester content of strain NJ-1,NJ-2,NJ-8
由图1可知:菌株NJ-8产酯量为239.7 mg/L,显著高于其他两株菌(P<0.05),酯类产物有乙酸乙酯、己酸乙酯、乙酸异戊酯、乙酸苯乙酯,其中乙酸乙酯作为主要酯类,含量为148.052 5 mg/L,由于该菌株的产酯能力较强,种类丰富,具有较高的研究价值。因此对其培养条件进行优化,以得到更高的产酯量。
2.3 菌株分子生物学鉴定结果
DNA采用CTAB法和酶解法相结合提取,并进行聚合酶链式反应(polymerase chain readion,PCR)扩增,提取和扩增效果见图2。

图2 菌株NJ-8的DNA电泳图、PCR产物电泳图Fig.2 The DNA electrophoresis of strain NJ-8,the PCR product electrophoresis of the strain NJ-8
将提取DNA产物进行电泳后,于紫外灯下照射,出现目的条带,则DNA提取成功,由图2A可知该试验DNA提取成功。5.8S rDNA的PCR扩增:采用50μL反应体系,用ITSl和ITS4对5.8S ITS区段进行扩增。反应条件:95 ℃ 4 min,95 ℃ 60 s,54 ℃ 60 s,72 ℃ 90 s,32个循环;72℃末端延伸5 min。由图2B可知菌株NJ-8的PCR扩增条带为589 bp,位于500 bp~750 bp之间,可知该试验5.8S rDNA的PCR扩增成功。
将测序获得的序列提交NCBI数据库进行Blast序列比对,采用MEGA6.0中Neighbor-Joining法构建系统发育树,进行亲缘关系和系统发育分析。结果见图3。

图3 菌株NJ-8的系统发育树Fig.3 Phylogenetic tree of strain NJ-8
由图3可知其与Wickerhamomyces anomalus同源性为100%,初步确定菌株NJ-8为异常毕赤酵母。
2.4 培养条件优化
2.4.1 单因素试验结果
外部发酵条件对细胞的生长和繁殖息息相关,如培养时间的长短直接影响菌株的生长繁殖,与其培养液营养成分的高低存在直接联系;培养温度过高通常会引起细胞膜流动性的变化,对于酵母菌而言,通常通过改变它的脂肪酸组成来适应这一变化,对其生长繁殖产生直接或间接的影响[3];种龄代表菌株初始出发菌的状态,是否是其最佳增殖的生长时期;转速、装液量等影响菌株生长环境中的含氧量,与营养物的接触面积及其对营养成分的吸收等,因此装液量、培养时间、接种量、培养温度、转速、pH值以及接种种龄均是酵母菌生长的重要条件,对其增殖生长有及其重要的影响。外部发酵条件对细胞生长的影响情况见图4~图10。
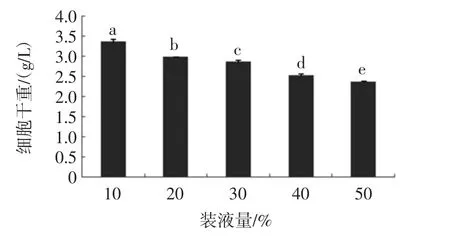
图4 装液量对细胞干重的影响Fig.4 Effect of liquid loading on dry weight of cell

图5 培养时间对细胞干重的影响Fig.5 Effect of culture time on dry weight of cells

图6 接种量对细胞干重的影响Fig.6 Effect of inoculation amount on dry weight of cells
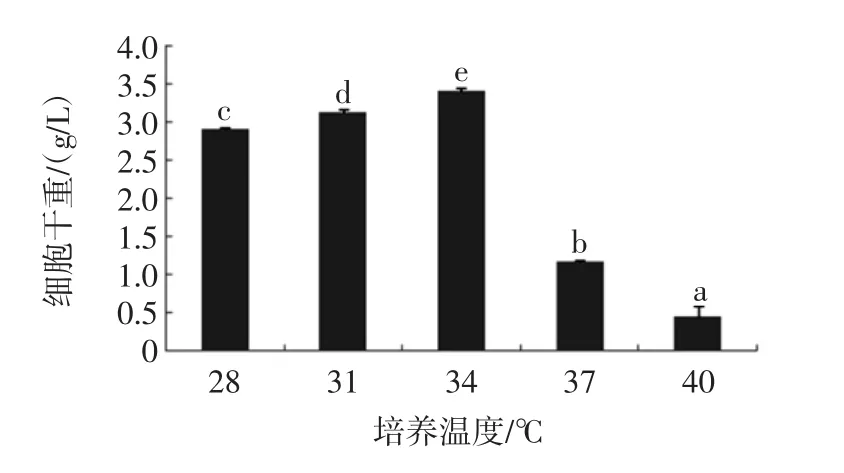
图7 培养温度对细胞干重的影响Fig.7 Effect of temperature on dry weight of cells weight of cells

图8 发酵转速对细胞干重的影响Fig.8 Effect of fermentation speed on cell dry weight
由图4~图10可知,本试验通过单因素试验得出酵母扩培的培养条件为:装液量10%,培养时间5 d,接种量5%,培养温度34℃,培养转速为150 r/min,pH 8.0,接种种龄 2 d。
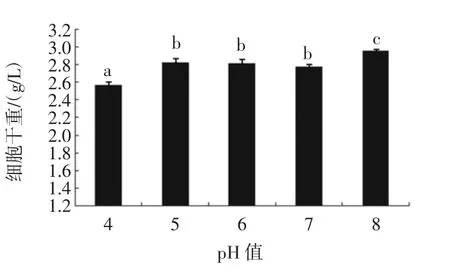
图9 pH值对细胞干重的影响Fig.9 Effect of pH on dry weight of cells

图10 种龄对细胞干重的影响Fig.10 Effect of seed age on dry weight of cells
2.4.2 Plackett-Burman设计试验结果
本研究选用N=12的Plackett-Burman试验设计,针对7个发酵条件进行优选,以单因素结果作为出发点,Plackett-Burman试验设计及结果见表4,试验各因素效应系数见表5。

表4 Plackett-Burman试验设计及结果Table 4 Design and result of Plackett-Burman
对试验结果产生正效应的因素为接种量、pH值、转速、种龄,产生负效应的因素为装液量、培养时间和培养温度。
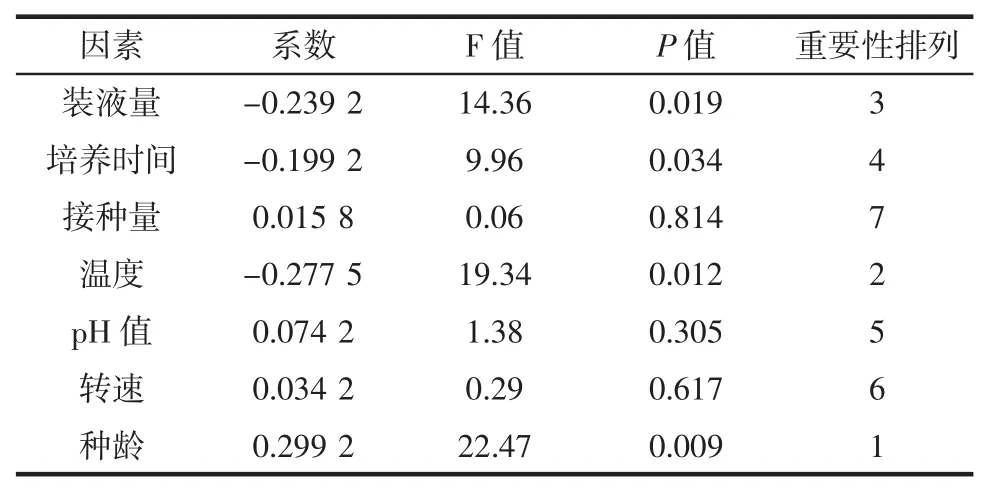
表5 Plackett-Burman方差分析结果Table 5 Result of Plackett-Burman variance analysis
由表5可知,接种种龄、培养温度和装液量对酵母菌细胞干重的影响最大,可作为最陡爬坡试验对象。
2.4.3 最陡爬坡试验设计及结果
由表5中各因素的效应系数合理的确定最陡爬坡试验的方向和步长,试验设计及结果见表6。

表6 最陡爬坡试验设计及结果Table 6 Design and result of steepest climbing test
由表6可知,第2组试验中酵母菌细胞干重最高,即装液量为10%,培养温度为32℃,接种的种龄为60 h时,酵母菌细胞干重为6.29 g/L。因此,依据第2组的试验条件作为后续试验的中心点进行响应面分析。
2.4.4 Box-Behnken试验设计及分析结果
响应面试验法在多变量体系优化和因素交互作用对响应值的影响方面明显优于正交试验,通过构建数学模型,经过回归分析和方差分析,可用于寻找最优参数组合,其中Box-Behnken试验设计是最有效的响应面优化法之一[29-31]。
Y作为响应值,利用Design-Expert.V8.0.6软件进行Box-Behnken试验设计,其中析因部分试验12次,中心点重复试验次数为5次。试验设计及结果如表7所示。
利用Design-Expert软件对BBD试验设计的试验结果数据进行多元二次回归拟合,建立以Y值为响应值的全变量编码水平的二次回归方程如下:Y=6.12-0.26A-0.047B-0.11C-0.12AB+0.063AC-0.12BC+0.21A2+0.09B2-0.21C2,该模型极显著(P<0.01)。由回归方程的决定系数R2=0.958 3可知,该二阶回归方程对试验拟合情况好,试验误差小。由表8可知,本试验精密度达到15.672,大于4.0,即试验设计及结果完全合理,说明试验方法的可信度和精确度较好。
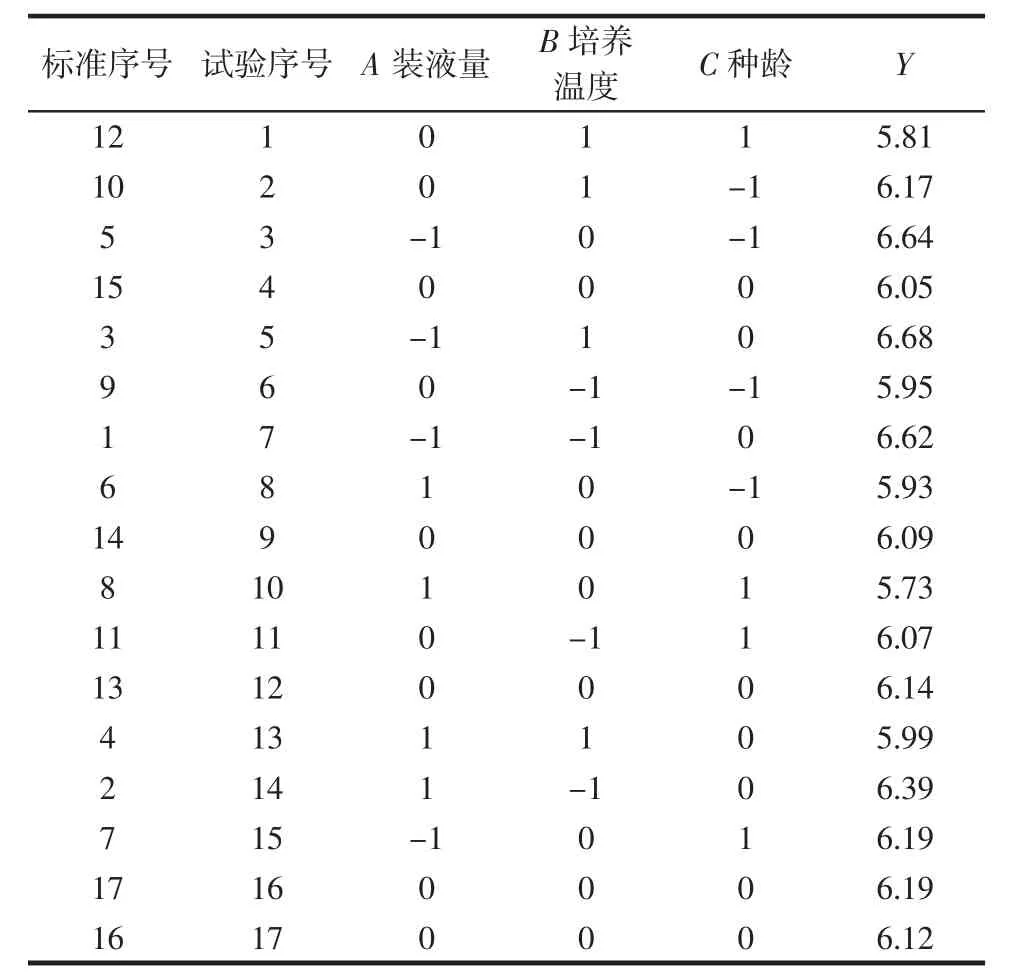
表7 Box-Behnken试验设计及结果Table 7 Design and result of Box-Behnken test
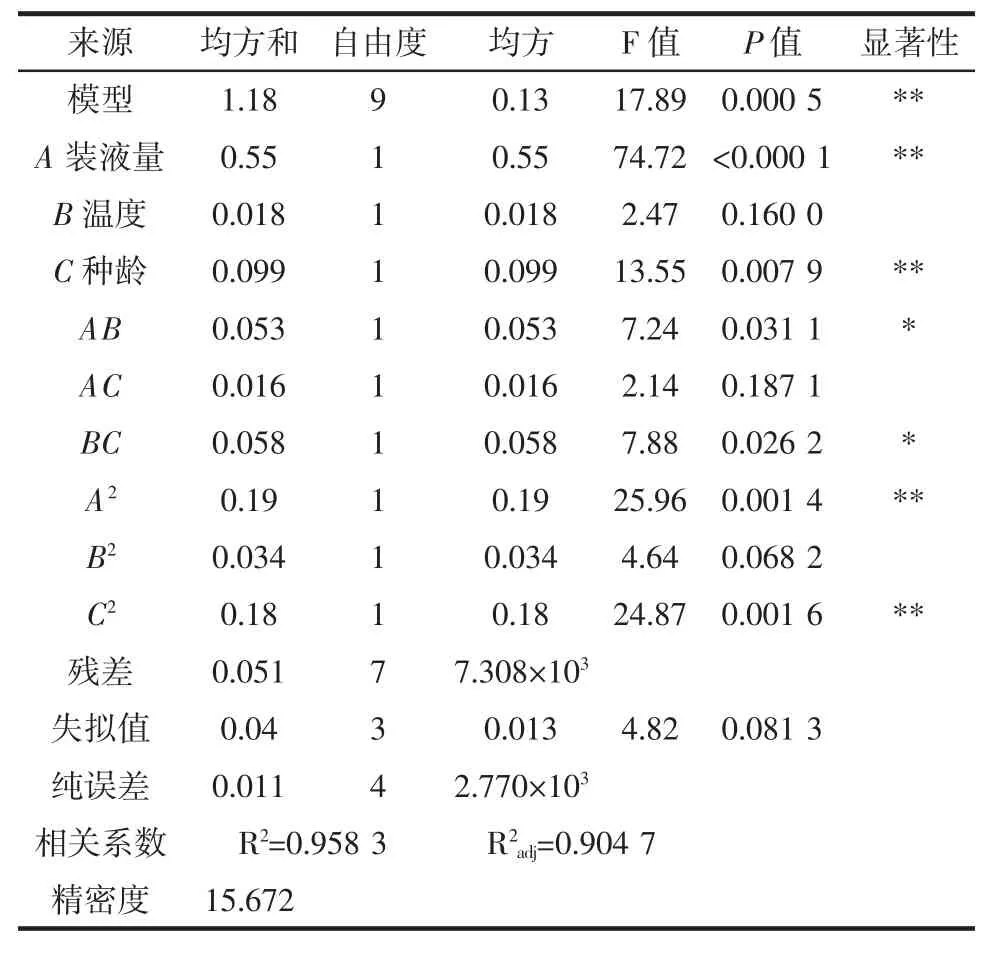
表8 BBD试验方差分析结果Table 8 Result of BBD test variance analysis
2.4.5 显著因素水平的优化
响应面是中心组合设计中的响应值为纵坐标,其他重要因素分别为水平面上的两垂直横坐标构成的三维模型[32]。三维响应面图可以更为直观的反映其中两因素的交互作用,影响显著的模型曲面,其等高线呈椭圆形;反之,则等高线呈圆形[33]。
为了更直观反映装液量、培养温度和接种种龄之间的交互作用对细胞干重的影响,利用Design-Expert软件绘制出响应面见图11。
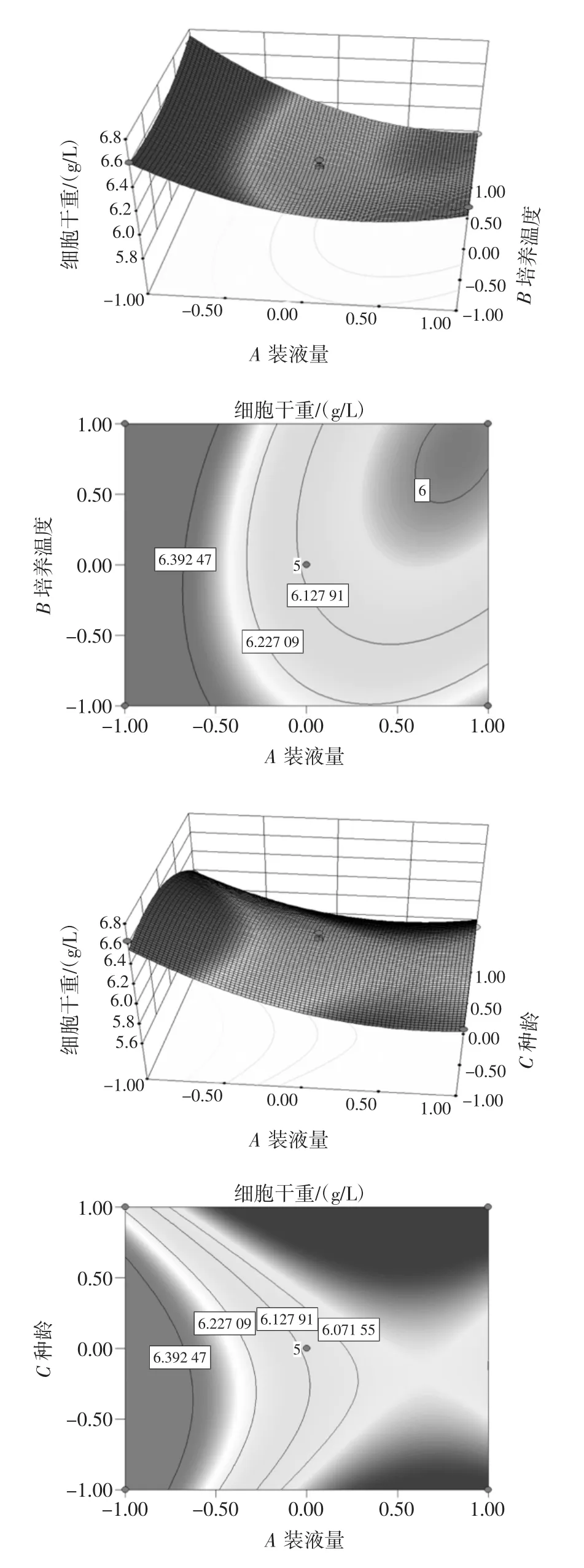
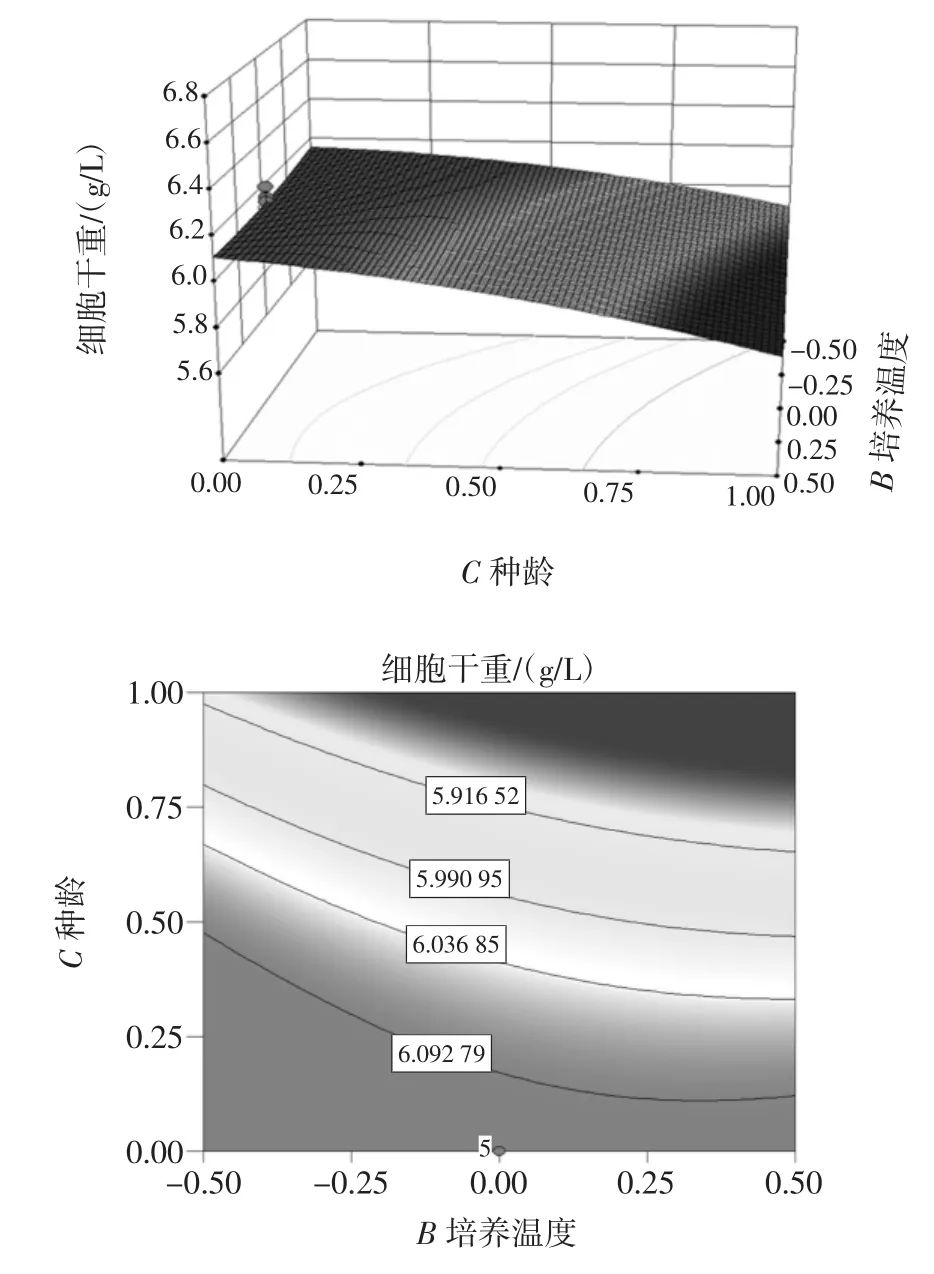
图11 装液量、培养温度和接种种龄三因素交互作用对细胞干重的影响Fig.11 Effect of interaction of three factors on dry weight of cells:liquid content,culture temperature and inoculation age
回归模型存在稳定点(A装液量、B培养温度、C接种种龄)的编码值为(1、-1、0.18),自变量和编码变量之间的变换公式为xi=(Xi-X0)/△,公式中:△为自变量步长;xi为自变量编码值;Xi为自变量实际值;X0为自变量在中心处实际值。即装液量为11%,培养温度为31℃及接种种龄为60.72 h时Y综合值的最大估计值为6.33 g/L。
2.4.6 优化结果的验证试验及结果
为了验证优化后的培养条件对酵母细胞干重的效果,以原培养条件作为对照进行验证试验。发现用优化条件培养的细胞干重达(6.37±0.06)g/L,与该模型的预测值6.33 g/L接近,而未优化培养的酵母菌细胞干重为(2.86±0.07)g/L,优化后的细胞干重提高了约1.2倍,有明显的提高效果,证明该模型有效。
3 讨论与结论
中国白酒发酵是多种微生物同时进行生物转化的一个复杂过程,酵母起着重要作用,协同酿酒酵母发酵可以明显增酯[34]。异常毕赤酵母能耐受较为极端的环境,如低pH值、高渗透压、厌氧等,能够诱导酒精发酵,激活发酵途径中的关键酶,能增加乙醇和乙酸乙酯等代谢物含量[35-36];胡沂淮等从大曲中筛得一株生香异常毕赤酵母,采用GC-MS技术检测葡萄糖发酵液的香气成分,表明其风味组分多达27种,分析这些香气的组分,对生产具有重要的指导意义[37];蒲春从大曲中筛选到8株产酯酵母,其中酶活最高的菌株为异常毕赤酵母,其酵母麸曲的酯化力可达到19.36 mg/100 mL[38],可见异常毕赤酵母具有很高的研究价值。
本试验以浓香型白酒酿造的窖泥为分离材料,采用平板涂布,挑取单菌落的传统方法分离出一株产酯能力较好的酵母菌,经分子生物学鉴定,为异常毕赤酵母。结合单因素和响应面优化法优化该酵母扩培的条件,了解到该菌株在装液量为11%,培养温度为31℃,培养时间5 d,接种量5%,培养转速为150 r/min,pH值8.0,接种种龄60.72 h的培养条件下,细胞干重达6.37 g/L,是初始培养条件的222.7%,其培养条件的优化达到了显著的增殖效果,为酿造优质白酒提供产酯酵母来源和一定的技术参考。

