LaeA调控黑曲霉形态发展、赭曲霉毒素合成和氧化耐受
徐瑞涛,陈浩宇,陈美榕,张梦薇,张健
(天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,省部共建食品营养与安全国家重点实验室,天津300457)
黑曲霉(Aspergillus niger)对人类活动既有有利的影响,也有不利影响。一方面它是公认的安全发酵菌株,被广泛应用于柠檬酸发酵生产,同时它也是30多种酶制剂制备及重要蛋白的异源表达[1]。但是另一方面,它作为一种植物和人类病原体出现,前者与各种植物疾病有关,会造成巨大的经济损失,后者与人类曲霉菌病等一些过敏性问题有关[2]。此外,近年来还陆续发现了可以产生赭曲霉毒素A(ochratoxin A,OTA)、伏马毒素B2和黄曲霉毒素的黑曲霉[3-4],其安全性非常令人担忧。因此迫切需要制定有效的防治措施,以限制黑曲霉侵染与毒素合成,减少经济损失,保护人和动物的健康。
黑曲霉通常以无性生殖的方式进行繁殖,目前尚未发现其有性生殖方式[5-6]。黑曲霉的侵染过程如下:分生孢子附着到宿主表面并产生附着胞,附着胞生长到宿主细胞中形成胚芽管,胚芽管通过有丝分裂来分化、生长和发育以产生菌丝体。在黑曲霉的侵染过程中,宿主会采取各种防御策略来保护自身免受其侵染,比如:在受攻击部位迅速积累活性氧(reaetive oxygen speeies,ROS)。这会导致宿主细胞局部死亡,从而阻止黑曲霉的进一步扩散[7]。为了减少宿主产生的ROS的不利影响,黑曲霉已经进化出ROS清除系统,以去除过量的ROS,帮助自身存活。因此,黑曲霉的侵染过程是其与宿主斗争的结果,而分生孢子是其侵染的工具。
黑曲霉可以产生多种真菌毒素,其中OTA是国际癌症研究机构认定的“2B”类致癌物,严重影响人类健康[8]。自OTA发现以来,已有大量研究致力于解析其生物合成途径和分子调控机制。然而,时至今日OTA的生物合成途径和调控机制还远未阐明,尚未发现OTA合成基因簇内的特异性调控因子[9],因此我们无法针对特异性调控因子对OTA合成进行调控。尽管如此,位于基因簇外还有一些全局调控因子,可调控多种次级代谢产物的合成,并且影响真菌的生长发育[10]。深入研究全局调控因子对黑曲霉侵染和OTA合成的影响,有可能建立以这些全局调控因子为靶标的,能有效的限制黑曲霉侵染和OTA合成的控制策略。
研究者于2004年首次在构巢曲霉发现了全局性调控因子LaeA[11],随后在黄曲霉、里氏木霉、产黄青霉、轮状镰刀霉菌等丝状真菌中相继发现了LaeA同源蛋白。大量研究表明LaeA可调控多种次级代谢基因簇的表达和次级代谢产物的产生,影响丝状真菌的形态分化,它的发现对丝状真菌的生长发育[12]和次级代谢产物[13-14]的研究具有极其重要的意义。在黑曲霉中,Niu等已经证实LaeA对合成柠檬酸至关重要[15],同时代谢谱研究表明LaeA可影响黑曲霉多种次级代谢产物的合成。目前,鲜见LaeA对黑曲霉侵染和OTA合成影响的报道。
本研究以产OTA黑曲霉A14作为出发菌株,利用农杆菌介导的同源重组方法,构建黑曲霉laeA基因敲除菌株,比较野生株和敲除菌株在形态发展、OTA合成和氧化耐受性的差异。揭示黑曲霉laeA基因在黑曲霉侵染和OTA合成中的作用,为有效地控制黑曲霉污染提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株和质粒
野生型(wild type,WT)OTA产生菌株黑曲霉A14、E.coli DH5α、Agrobacterium tumefaciens AGL1、 质 粒p44[16]、pMD18-T均由天津科技大学生化过程与技术实验室保存。laeA基因缺失黑曲霉菌株ΔlaeA、质粒p44-laeA为本研究构建。
1.1.2 试剂
TaqDNA聚合酶(5U/μL)、T4DNA连接酶(10U/μL)、DL5000 DNA Maker、DL10 000 DNA Maker,限制性内切酶 EcoRI(15 U/μL)、PstI(15 U/μL)、KpnI(15 U/μL)、Hind III(10 U/μL):TaKaRa 公司;潮霉素 B、乙酰丁香酮、质粒提取试剂盒、琼脂糖凝胶回收试剂盒:Solarbio公司;其他生物化学类试剂:天津市北方天医化学试剂厂。
1.1.3 仪器与设备
OLYMPUS 719068光学显微镜:OLYMPUS公司;LDZX-50FB立式压力蒸汽灭菌锅、SPX-250B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;FA2004N电子天平:上海精密科学仪器有限公司;DELTA320 pH计:梅特勒-托利多仪器(上海)有限公司;TGL台式高速离心机:上海医药分析仪器厂;HDL超净工作台:北京东联哈尔滨仪器制造有限公司;NEXUS-GSX1 PCR扩增仪:德国eppendorf公司;HZQ-QX恒温振荡器:中国哈尔滨市东联电子技术开发有限公司。
1.1.4 引物
所使用的引物如表1所示。

表1 引物Table 1 Primers
1.1.5 培养基
细菌培养基(lysogeny broth,LB)用于培养大肠杆菌和农杆菌,完全培养基(complete medium,CM)和查氏培养基(czapek yeast exatract,CYA)用于培养黑曲霉,配制方法均参照文献[17]。诱导培养基(induction medium,IM),农杆菌侵染所需培养基及试剂参照文献[18]配制。
1.2 laeA基因的扩增
参考美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)公布的黑曲霉CBS513.88中 laeA的基因序列 (Accession:XP-001389674.2),使用引物 laeA-f/laeA-r,以提取的黑曲霉A14基因组为模板,进行PCR扩增以获得laeA基因。PCR程序如下:95℃5min;95℃30 s,60℃30 s,72℃10 min,30个循环;72℃10 min。PCR产物使用1%凝胶电泳进行检测,结果送至华大基因进行测序比对。并进行蛋白分子量及等电点的预测。
1.3 敲除菌株ΔlaeA的构建
以黑曲霉A14基因组为模板,利用引物laeAz-f/laeAz-r及laeAy-f/laeAy-r分别扩增laeA基因的同源左右臂,并将其命名为laeA-H1和laeA-H2;分别将纯化后所得laeA-H1和laeA-H2通过酶切连接的方法连接至载体p44上,由于laeA-H1中含有PstI酶切位点,所以先使用PstI和HindIII双酶切将laeA-H2连接到质粒p44中,同样的方法,使用KpnI和EcoRI将laeA-H1片段双酶切连接到过程质粒p44-laeA-H2中,从而完成敲除质粒p44-laeA的构建(见图1)。将构建好的质粒p44-laeA通过电转化的方法,导入根癌农杆菌AGL1中,将农杆菌与黑曲霉A14共培养,筛选黑曲霉转化子,具体参见曹张磊等的方法进行[19]。提取转化子基因组进行聚合酶链式反应(polymerase chain reaction,PCR)验证,对验证正确的转化子,送至上海派森诺公司进行重测序,以验证潮霉素B抗性基因是否为单拷贝插入。

图1 p44-laeA质粒图谱Fig.1 Vector map of p44-laeA
1.4 黑曲霉WT和ΔlaeA菌株形态观测
挑取黑曲霉WT及ΔlaeA单菌落于平板中央,分别置于光照和黑暗的条件下25℃培养7 d,观察菌落形态并测菌落直径。采用直径20 mm的打孔器从菌落中心打孔采样,将孢子用1 mL无菌水洗下,血球计数板计数,进行产孢量分析。将孢悬稀释到105个/mL,分别吸取孢悬液5 μL至载玻片与培养基接触的缝隙中,25℃培养24 h,将载玻片取出置于光学显微镜下观察菌丝状态;取 2 μL 分别于含 0、5、10 mmol/L H2O2的CYA固体培养基上,25℃黑暗条件下培养7 d,观察菌落生长情况;分别取50 μL于50 mL CYA液体培养基中,25℃于黑暗和光照条件下培养7 d,考察液体培养的生物量变化。
1.5 黑曲霉WT和ΔlaeA产赭曲霉毒素的测定
分别取100μL105个/mL的孢子悬液接种于100mL CYA培养基中,分别置于光照与黑暗条件下25℃培养7 d,取适量3 d~7 d CYA培养液,经0.22 μm滤器过滤并使用高效液相色谱荧光检测器(high performance liquidchromatography-fluorescencedetector,HPLC-FLD)进行次级代谢谱检测。检测条件为:采用KromstarTM C18色谱柱(250 mm×4.6 mm,5 μm);激发波长:333 nm,发射波长:460 nm;流动相为乙腈∶水∶醋酸=99∶99 ∶2(体积比);流速:1.0 mL/min,进样量 20 μL。
1.6 氧化胁迫对黑曲霉WT及ΔlaeA突变株胞内抗氧化酶活性影响
测定5 mmol/L H2O2胁迫下黑曲霉WT及ΔlaeA菌株胞内过氧化氢酶(catalase,CAT)、超氧化物岐化酶(superoxide dismutase,SOD)以及谷胱甘肽过氧化物酶(glutlthione perolidlse,GPX)酶活,具体参见陈浩宇等的方法进行[20]。
2 结果与分析
2.1 laeA基因的克隆及分析
以提取的黑曲霉WT基因组为模板,laeA-F/laeAR为引物,扩增laeA同源基因,电泳后条带大小符合预期1 763 bp。将其连接到pMD18-T载体上,送至华大测序。将测序结果与NCBI上黑曲霉CBS513.88已公布的laeA基因进行比对,结果是二者序列完全相同,因此黑曲霉A14中含有与CBS513.88中完全相同的laeA基因,该基因全长1 763 bp,含有1个内含子(144 bp),编码375个氨基酸。预测的LaeA蛋白的分子量为43 361.48,等电点为5.76。
2.2 laeA基因敲除菌株的构建
将所得质粒p44-laeA经E.coliDH5α和AGL1转入黑曲霉WT中,通过p44-laeA载体所带的hyg(潮霉素B抗性基因)对转化子进行筛选,获得敲除laeA基因的抗性菌株。敲除菌株同源重组构建及验证如图2所示。

图2 laeA基因同源重组敲除及电泳验证图Fig.2 laeA gene disruption by homologous recombinant and electrophoretic validation
使用引物laeAz-f/laeAy-r进行PCR验证。图2B中1号泳道以p44-laeA质粒为模版为阳性对照,14号泳道以WT菌株基因组为模版为阴性对照,3号~9号、11号~13号泳道同源重组片段随机插入出现两条条带,2和10号泳道转化子扩增出3151bp单一条带,没有原始基因组的2 736 bp(859 bp+981 bp+896 bp)的条带,说明这两个转化子的laeA基因目标敲除片段的981 bp已经被1 396 bp的潮霉素抗性片段同源重组双交换所替代,从而破坏laeA基因,为正确的同源重组双交换敲除菌株。将得到的敲除株进行重测序进一步验证,得到hyg的插入方式为反向插入,拷贝数为1。
2.3 黑曲霉WT及laeA基因缺失菌株表型分析
黑曲霉WT及ΔlaeA菌落形态、菌丝形态、产孢情况及菌体干重如图3所示。
比较黑曲霉WT与ΔlaeA菌株菌落形态(图3A),发现两菌株整体呈棕色,菌落中间有大量棕色孢子,边缘菌丝呈乳黄色,ΔlaeA与WT菌株相比,菌落中间呈现出更多褶皱,有更多凸起,而WT菌株较为平整,黑暗条件下菌株颜色整体较深。ΔlaeA菌株菌丝疏松,枝节较长且直,WT菌株菌丝稠密,枝节较多且短,光照对菌丝生长无显著影响。ΔlaeA与WT菌株相比,光照条件下菌落直径减少3.87%,黑暗条件下,直径减少11.76%(图3B)。孢子计数表明,光照条件下ΔlaeA与WT菌株相比产孢量减少22.81%,黑暗条件下,ΔlaeA与WT菌株相比产孢量减少 23.49%(图3C)。液体培养测量菌体生物量发现,光照条件下ΔlaeA与WT菌株相比菌体干重减少18.49%,黑暗条件下,ΔlaeA与WT菌株相比菌体干重减少20.97%(图3D)。

图3 黑曲霉WT及ΔlaeA菌落形态、菌丝形态、产孢情况及菌体干重Fig.3 Role of laeA in A.niger colony,hyphal,conidiation and biomass
2.4 黑曲霉WT及ΔlaeA菌株产毒分析
典型的黑曲霉WT及ΔlaeA菌株的HPLC检测结果如图4所示(黑暗条件培养4 d),WT菌株可检测到明显的赭曲霉毒素 β(OTβ)、赭曲霉毒素 α(OTα)以及OTA的峰,出峰时间分别为4.122、5.869 min和8.911 min;ΔlaeA 菌株中,OTβ,OTα 以及 OTA 的峰面积显著减少。OTA生物合成见图5。黑曲霉WT菌株在黑暗和光照条件下培养3 d~7 d,OTA含量均持续增加,但黑暗条件更有利于OTA的合成;ΔlaeA菌株在黑暗和光照条件下培养3 d~7 d,OTA含量极低且几乎无变化,培养7 d,相比WT菌株OTA含量分别减少92.45%(光照)和99.03%(黑暗)。
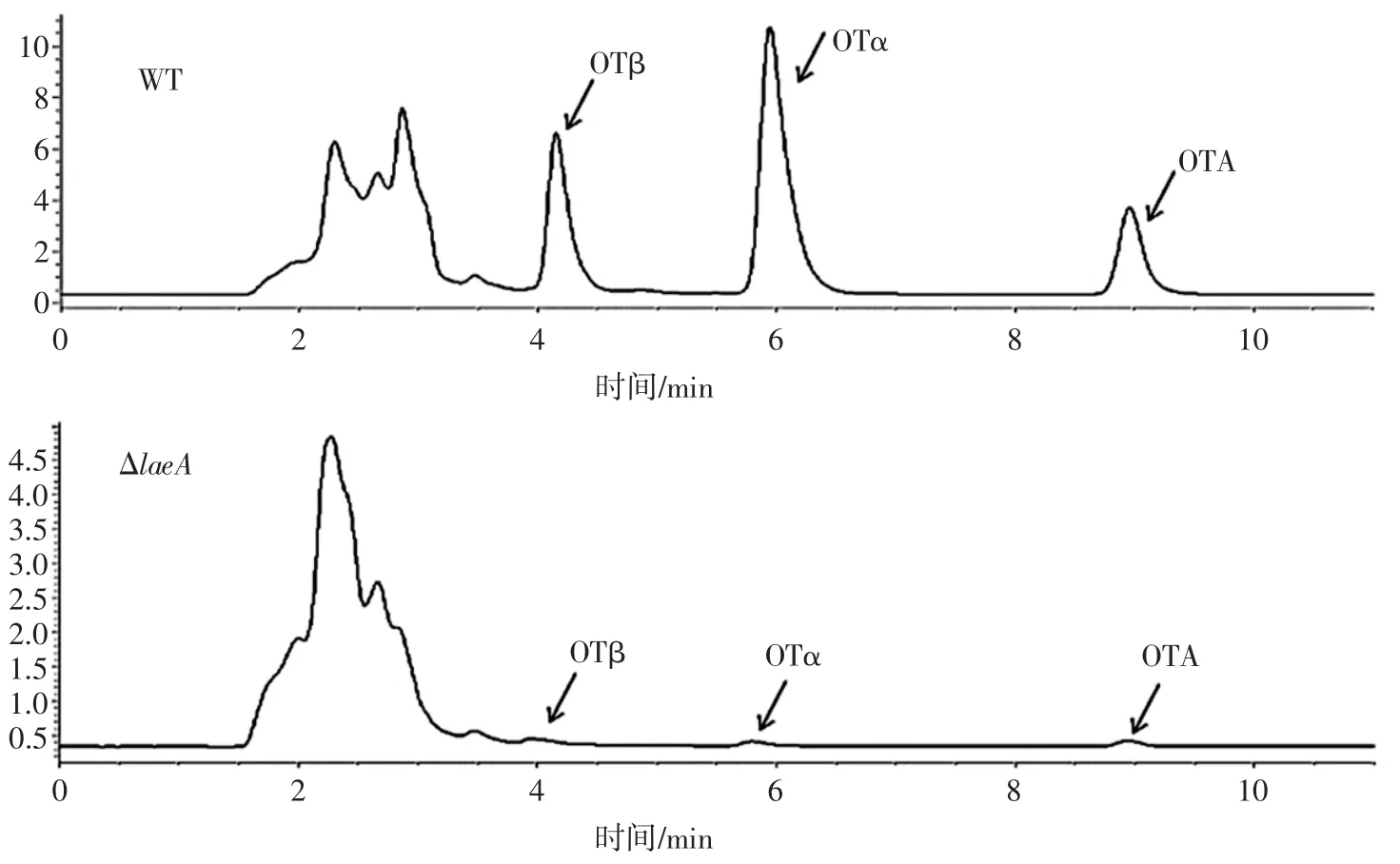
图4 黑曲霉WT及ΔlaeA菌株OTβ,OTα以及OTA的HPLC-FLD检测结果Fig.4 The HPLC-FLD detection results of OTβ,OTα and OTA of A.niger WT and ΔlaeA strains
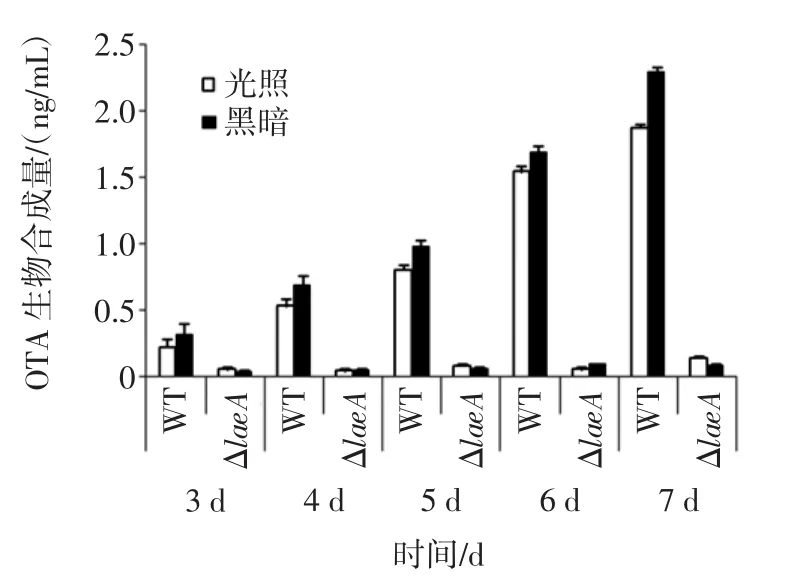
图5 黑曲霉WT及ΔlaeA菌株生长3d~7d过程中OTA生物合成Fig.5 OTA biosynthesis of A.niger WT and ΔlaeA strains during 3 d-7 d culture
2.5 黑曲霉WT及ΔlaeA菌株的H2O2耐受性分析
H2O2对WT及ΔlaeA菌株生长影响见图6。氧化胁迫的产生是由于胞内活性氧含量过高,使得胞内氧化还原的状态失衡,进而引起菌体一系列应激反应,菌体通过激活相关基因的表达来降解活性氧从而修复和维持细胞的动态平衡。为探究laeA基因对黑曲霉氧化耐受的影响,分别测定不同浓度H2O2胁迫下,黑曲霉WT及ΔlaeA菌株的生长情况。如图6所示,随着H2O2浓度的增加,黑曲霉WT和ΔlaeA菌株的生长均受到抑制,但ΔlaeA菌株对H2O2更为敏感,10 mmol/L的H2O2即可完全抑制其生长。

图6 H2O2对WT及ΔlaeA菌株生长影响Fig.6 The effect of the H2O2on the growth of WT and ΔlaeA strains
2.6 H2O2胁迫对菌株胞内抗氧化酶活性的影响
为探究黑曲霉WT和ΔlaeA菌株的对H2O2的不同耐受性,分别测定了3种抗氧化酶活性,结果如图7,可见ΔlaeA胞内CAT、SOD及GXP酶的活性在胁迫生长前期明显低于WT菌株,且均在生长第3天最为显著,与WT菌株相比,ΔlaeA菌株胞内CAT活性降低2.17倍,SOD活性降低1.55倍,GPX活性降低1.44倍。
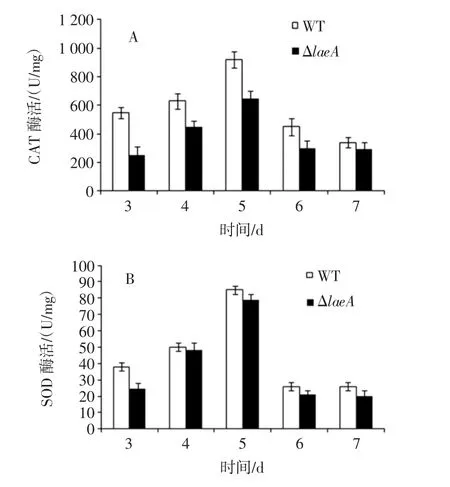

图7 外源H2O2的添加对黑曲霉WT及ΔlaeA菌株抗氧化酶活的影响Fig.7 The effect of exogenous H2O2on antioxidant enzyme activity of A.niger WT and ΔlaeA strains
3 结论
以黑曲霉A14作为出发菌株,全局调控因子laeA基因为研究对象,通过分子改造构建了敲除菌株ΔlaeA,探究该基因对黑曲霉形态发展,赭曲霉毒素合成和氧化耐受的影响。结果显示,ΔlaeA菌株菌落生长直径及产孢量与WT菌株相比均有不同程度的减少,菌丝较长且松散,可见该基因正向调控黑曲霉产孢。Kosalková等将黄青霉菌株laeA基因敲除后亦发现孢子产量减少[21],与本研究相似,而孢子减少意味着侵染的媒介减少,可见敲除该基因可抑制黑曲霉侵染。
Crespo-Sempere等曾敲除炭黑曲霉中laeA基因[22],并与野生菌株分别在光照及黑暗条件下生长4 d比较OTA合成量,laeA基因缺失光照条件下减少68.5%,黑暗条件下减少97%,与本研究中结果相似,ΔlaeA菌株产赭曲霉毒素无论在光照还是黑暗条件下与WT菌株相比均显著减少,本研究首次敲除并证明laeA基因正向调控黑曲霉OTA的产生,为建立以全局调控因子LaeA为靶标的有效限制黑曲霉OTA合成控制提供理论依据。
Wu等的研究表明veA及laeA的缺失会导致异旋孢腔菌菌株对H2O2的耐受性减弱[23],本研究发现laeA的缺失会导致黑曲霉菌株对H2O2的耐受性减弱,抗氧化酶活性减弱因为LaeA的缺失使其对抗氧化酶的正常调节产生紊乱,菌体不能对抗氧化酶起到正常调节,致使黑曲霉胞内抗氧化酶活性低于氧化胁迫时正常活性水平,这说明LaeA蛋白正调控黑曲霉氧化耐受性。但研究只用了H2O2制造氧化胁迫环境,没有排除试剂本身对氧化敏感性的影响。氧化敏感增强意味着其毒力减弱,当侵染植物宿主时,宿主产生的ROS会更容易抑制敲除株的生长,再一次证明敲除laeA基因不但抑制OTA合成,而且抑制黑曲霉侵染。本研究为探究OTA生物合成过程中的调控机制及制定有效的防治措施限制黑曲霉侵染和OTA合成提供了理论依据。

