柠檬叶精油的抗氧化活性及其相关性分析
陈林林,李伟,韩可,吴嘉树
(哈尔滨商业大学 省高校食品科学与工程重点实验室,哈尔滨 150076)
柠檬叶是黎檬或者洋柠檬的叶,作为独特香辛料被使用在东南亚菜品中,清香味道十分强烈,用于海鲜、肉类和沙拉类菜品中,使菜肴更加鲜美。柠檬叶中含有黄酮类、有机酸、香豆精类等成分,其中主要包括槲皮素、根皮素、阿魏酸、香荚兰酸、p-香豆酸、水杨酸、伞形花内酯、龙胆酸和o-香豆酸等,大部分以结合形式存在,少部分物质以游离形式存在,例如伞形花内酯、阿魏酸和水杨酸等。此外,柠檬叶中还含大量的挥发油、维生素和叶绿素等[1]。柠檬精油的气味清新、强烈,淡黄绿色,水质粘性,挥发性好。柠檬叶精油含有多种活性成分,主要为单萜烯类、醇类、醛类化合物。由目前研究可知,柠檬挥发性成分的开发利用主要在鲜果果皮精油的提取,柠檬叶中芳香性成分的研究较少,主要集中在提取方法和优化提取工艺等方面,例如超临界 CO2、流体萃取[2]、微波辅助提取[3]、超声波辅助 提取[4]、超声波协同微波提取等[5];并采用气相色谱-质谱(GC-MS)法分析、鉴定柠檬挥发油成分[6-8]。但是对柠檬叶精油成分的功能特性研究却非常少。这些实验大部分是针对柠檬果皮的精油提取的而开展的,对柠檬叶精油的提取的研究少之又少,除了木里柠檬叶精油外,其他鲜有报道。因此,若能合理开发利用柠檬叶中所含的有效成分,使大批量的柠檬叶不被当成废弃物扔掉,不仅促进柠檬产业链的延伸和发展,而且能增加柠檬树的经济附加值[9]。
本文采用水蒸气蒸馏法提取柠檬叶精油,分别对从鲜柠檬叶和干柠檬叶中提取的精油进行对比,以Vc(抗坏血酸)和BHT(2,6-二叔丁基对甲酚)作为对照,对柠檬叶精油和萃取物清除自由基能力、清除亚硝基能力、总还原能力、抑制黄嘌呤氧化酶活性的能力进行测定。对比评价精油与残渣萃取物的功能性,旨在为柠檬叶的综合利用提供依据。
1 实验部分
1.1 材料与仪器
鲜柠檬叶、干柠檬叶:购自广州聚鲜林贸易有限公司,产地广西;1,1-二苯基-2-三硝基苯肼(DPPH):日本东京化成株式会社;黄嘌呤氧化酶:上海源叶生物科技有限公司;黄嘌呤:北京恒业中远化工有限公司;抗坏血酸:天津市博迪化工有限公司;2,6-二叔丁基-4-甲基苯酚(BHT):南京信帆生物技术有限公司;邻苯三酚:天津市科密欧化学试剂有限公司。
W501升降恒温油浴锅 上海申胜生物技术有限公司;HZS-H恒温水浴振荡箱 上海晶坛仪器制造有限公司;R-1001型旋转蒸发仪 上海道京仪器有限公司;BS210S电子天平 德国Sartorius仪器公司;UV 5100B型紫外可见分光光度计 上海元析仪器有限公司;DHG-9203A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;PHS-260型酸度计 北京普析通用仪器有限责任公司;DC-2006低温恒温槽 宁波市海曙天恒仪器厂。
1.2 柠檬精油的提取
分别将干柠檬叶放入摇摆式高速万能粉碎机中粉碎至粉末状,将鲜柠檬叶剪至约1cm2的小碎块,备用。取200g粉碎的干柠檬叶或300g(包括梗)上述剪碎的鲜柠檬叶放入水蒸气提取装置的2000mL三口烧瓶中,按照物料比1∶8加入蒸馏水1600mL。安装水蒸气蒸馏装置,打开低温恒温槽,将温度设置为-4℃开始制冷,等温度降低至设定温度后,打开循环开关让液体在冷凝管内循环起来,然后加热油浴锅。油浴锅温度设定为由80℃逐渐升高,直至沸腾回流,这时油浴锅温度为120℃。蒸馏时间为3h(以第1滴液体出现开始计时)[10,11]。从收集管中的馏出液中冷却分离出上层精油,装入密闭精油瓶,放入冰箱中冷却1夜,用胶头吸管吸出精油中析出的少量水分,得到无色透明的精油。
1.3 纯化后的柠檬叶精油抗氧化活性研究
1.3.1 清除DPPH自由基活性的测定
取系列浓度为1,2,3,4,5mg/mL的样品乙醇溶液、BHT乙醇溶液和抗坏血酸乙醇溶液0.1mL,加入到3.9mL浓度为6×10-5mol/L的 DPPH 乙醇溶液中,28℃下水浴10min,然后迅速在517nm波长下测定吸光度值。同时测定不加提取物的空白样品的吸光度值,按公式(1)计算 DPPH 自由基的清除率(%)[12,13]:

式中:SC1为DPPH自由基的清除率;A样品为样品的吸光度值;A空白为空白样品的吸光度值。
1.3.2 清除羟自由基活性的测定
精确移取浓度为5mmol/L的邻二氮菲溶液1.5mL,再加入浓度为50mmol/L pH 7.4的磷酸缓冲溶液2mL,充分混匀,滴加1.0mL浓度为7.5mmol/L的硫酸亚铁溶液,立即混匀,分别加入1mL各系列浓度为1,2,3,4,5mg/mL的样品溶液、BHT、抗坏血酸,最后加入1.0mL质量浓度为0.1%的H2O2启动反应。样品管用水补体积至10mL,损伤管中加H2O2不加样品溶液,未损伤管两者都不加,损伤管和未损伤管都用水补充体积至10mL,将各管均置于37℃水浴中1h,拿出后迅速在波长536nm处测定吸光度值[14]。根据公式(2)计算羟自由基的清除率:

式中:SC2为羟基自由基的清除率;A0为未损伤管的吸光度值;A1为损伤管的吸光度值;A2为样品管的吸光度值。
1.3.3 清除超氧阴离子自由基活性的测定
分别取1mL系列浓度为1,2,3,4,5mg/mL的样品溶液、BHT溶液、抗坏血酸溶液,加入6mL浓度为50mmol/L的 Tris-HCl(pH 8.2)缓冲溶液,25℃下水浴20min,取出后立即加入0.1mL 25℃下预热的10mmol/L邻苯三酚溶液,精确反应4min后,立即加入0.1mL浓度为6mol/L的盐酸停止反应,以蒸馏水为参比溶液,在325nm波长下测定吸光度值[15]。用等体积的10mmol/L盐酸代替邻苯三酚调零,每一个样品对应一个空白。根据公式(3)计算超氧阴离子自由基的清除率:

式中:SC3为超氧阴离子自由基的清除率;A0为对照组的吸光度值;A1为样品组的吸光度值。
1.3.4 采用重氮偶合比色法测定清除NO2-活性
分别取0.5mL浓度为1,2,3,4,5mg/mL的样品溶液、BHT、抗坏血酸样品液,分别加入1.0mL柠檬酸缓冲溶液(pH 3.0)和1.0mL 浓度为10μg/mL的亚硝酸钠标准溶液,在37℃恒温水浴中反应1h,取出后加入15mL蒸馏水,再加入1mL浓度为4mg/mL的对氨基苯磺酸溶液,摇匀,静置5min。加入0.5mL浓度为2mg/mL的盐酸萘乙二胺溶液,用蒸馏水定容到刻度线,摇匀,静置15min,在546nm波长下测得吸光度值[16]。通过标准曲线求出对应的亚硝酸钠含量,根据公式(4)计算超氧阴离子自由基的清除率:

式中:SC4为亚硝酸根自由基的清除率;m1为亚硝酸钠的加入量,μg;m2为亚硝酸钠的残留量,μg。
1.3.5 总还原能力的测定
分别取1mL浓度为1,2,3,4,5mg/mL的样品溶液、BHT、抗坏血酸样品液,加入2.5mL磷酸缓冲溶液(200mmol/L,pH 6.6)以及2.5mL 浓度为1g/dL的铁氰化钾溶液,混匀。50℃恒温水浴20min后,迅速冷却,加入2.5mL浓度为10g/dL的三氯乙酸溶液,离心。取2.5mL上清液,加入2.5mL蒸馏水和0.5mL浓度为0.1g/dL的三氯化铁溶液。静置10min后,在700nm波长下测量吸光度。每个样品都做对应的空白背景值测定(实验步骤中用蒸馏水代替铁氰化钾溶液)。还原能力用抗坏血酸当量AEE(ascorbic acid equivalents)表示,单位μg AEE/mL。
1.3.6 抑制黄嘌呤氧化酶活性的测定方法
精确吸取3.75mL浓度为50mmol/L的磷酸盐缓冲液加入50mL锥形瓶中,再加3mL 0.15mmol/mL的黄嘌呤溶液,混匀后立即在290nm下测定吸光度值,记为A0。调节水浴振荡的条件25℃,100r/min,将测完吸光度值的锥形瓶放入其中反应30min,最后加入1.25mL 1mol/L的 HCl终止反应,再次测定吸光度值,记为A30[17];体系中加入1mL 18mU/mL的黄嘌呤氧化酶,测定290nm下的吸光度值,按是否终止反应分别记为AE0和AE30;体系中加入1mL不同浓度梯度的各样品溶液,测定290nm下的吸光度值,按是否终止反应分别记为AS0和 AS30;体系中既加入1mL 18mU/mL黄嘌呤氧化酶,又加入1mL各样品溶液,测定290nm下的吸光度值,按是否终止反应分别记为 A(E+S)0和 A(E+S)30(以甲醇为对照组)。
根据公式(5)计算不同浓度梯度的各样品溶液抑制黄嘌呤氧化酶活性的抑制率:

2 结果与分析
2.1 清除DPPH自由基的能力

图1 各浓度样品清除DPPH自由基能力的变化曲线
由图1可知,柠檬叶精油在浓度2.0~10.0mg/mL的范围内,对DPPH自由基的清除率总体呈上升趋势(P<0.05)。Vc的清除率最大达到90%以上,但趋势较为平缓,BHT的增加幅度由急到缓,逐渐趋近Vc;鲜叶精油和干叶精油清除DPPH自由基的能力相较于同浓度的VC和BHT较弱,其中干叶精油清除DPPH自由基的能力比鲜叶精油的清除能力略强,二者上升趋势一致;萃取物的清除能力相较于同浓度的VC和BHT较弱,与柠檬精油基本相近。

表1 各样品清除DPPH自由基的IC50值
由表1中各实验样品的IC50值可以直观地看出所测试的样品清除DPPH自由基的能力,各样品的IC50值差别不大,可表示为:VC<BHT<干叶精油<鲜叶精油。可以看出BHT和VC的IC50值较小,清除能力较强,鲜叶精油和干叶精油的IC50值较大,清除效果一般,因此,柠檬叶精油在清除自由基方面均有清除作用,但清除作用相较于VC和BHT较弱。
2.2 清除羟基自由基的能力
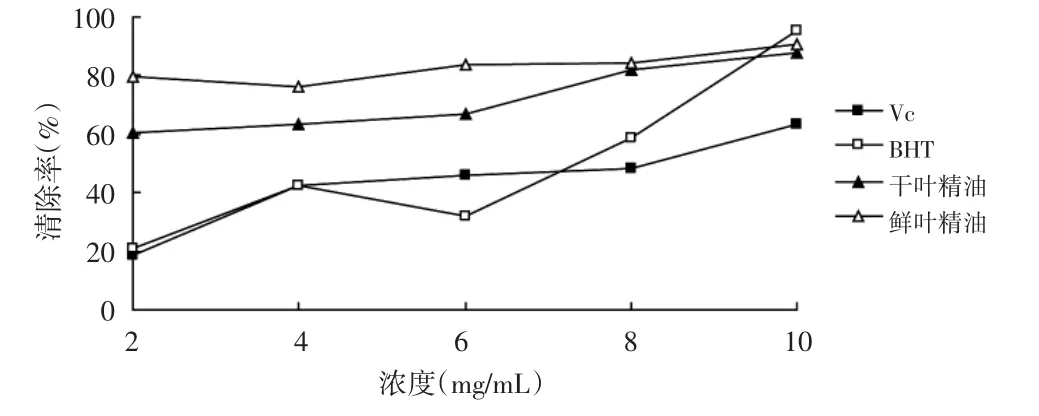
图2 各浓度样品清除羟基自由基能力的变化曲线
由图2可知,各样品在浓度范围2.0~10.0mg/mL内,羟基自由基的清除率大体呈上升趋势(P<0.05)。VC和BHT清除羟基自由基的能力随着浓度的增大而增大,在浓度最大处,BHT清除率达到95.29%;相同条件下,鲜叶精油增加幅度较为平缓,与同浓度的干叶精油相比,清除羟基自由基的能力略强;同浓度梯度的柠檬精油的清除能力超过同浓度下的BHT和VC,其清除能力上升趋势缓慢,但在低浓度时二者就可以明显地清除羟基自由基,随着浓度的不断增加,二者清除率也呈现上升趋势。
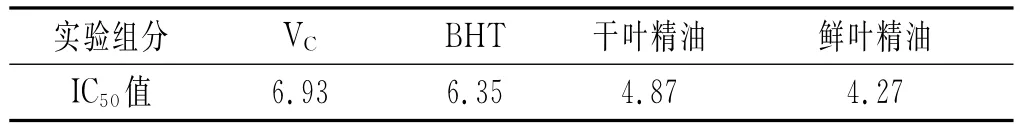
表2 各样品清除羟基自由基的IC50值
表2中各实验样品的IC50值可以直观地看出所测试的样品清除羟基自由基的能力,各样品的IC50值差异较大,鲜叶精油<干叶精油<BHT<VC。可以得出,柠檬精油具有较强的清除羟基自由基能力,清除效果超过VC和BHT。
2.3 清除超氧阴离子自由基的能力
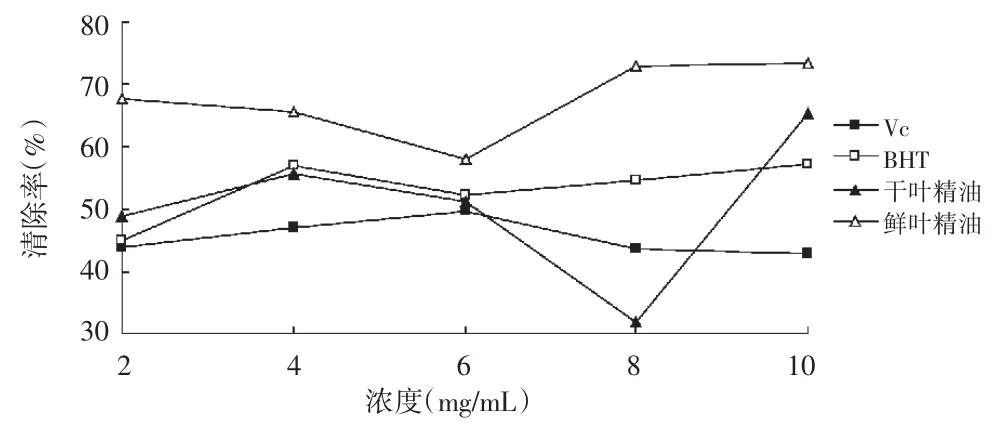
图3 各浓度样品清除超氧阴离子自由基能力的变化曲线
由图3可知,各样品在浓度范围2.0~10.0mg/mL内,超氧阴离子自由基的清除率无规律,多处出现转折点,大部分呈现缓慢下降趋势(P<0.05),VC和BHT清除率在44%~60%之间,清除超氧阴离子自由基的能力一般,但随着浓度的不断增大,清除率缓慢上升;鲜叶精油清除超氧阴离子自由基的能力较好,增加幅度较为平缓,且在中间出现最低点;干叶精油在8~10mg/mL时快速增加,最后超过VC和BHT;干叶精油和鲜叶精油均在较低浓度时就有较好的清除率,均超过同浓度的VC和BHT。

表3 各样品清除超氧阴离子自由基的IC50值
由表3可知,样品对超氧阴离子自由基清除能力的半数抑制浓度,实验样品的IC50值差异不大,鲜叶精油<BHT<干叶精油<VC。
2.4 清除亚硝酸盐活性的能力
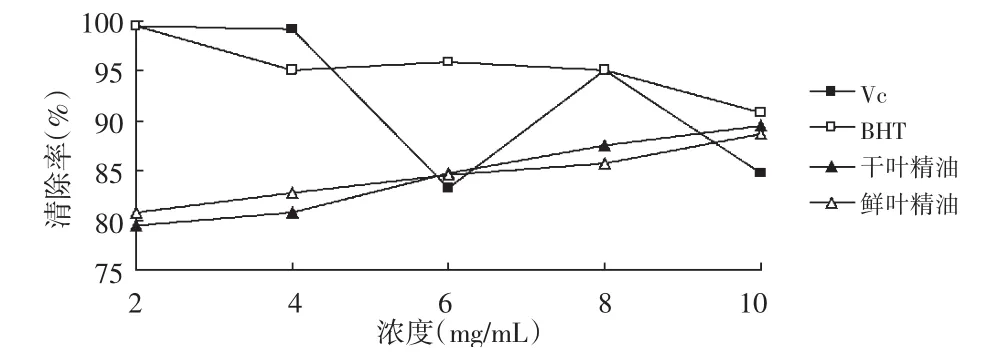
图4 各浓度样品清除亚硝酸盐能力的变化曲线
由图4可知,鲜叶精油和干叶精油对亚硝酸盐的清除能力基本相同,上升趋势一致并且都在较低浓度时就呈现出良好的清除率,但相比VC和BHT,鲜叶精油和干叶精油的清除能力略弱于VC和BHT。
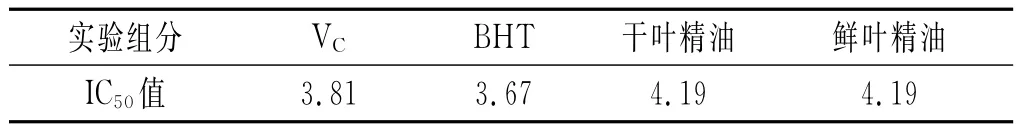
表4 各样品清除亚硝酸盐的IC50值
由表4可知,样品对亚硝酸盐清除能力的半数抑制浓度,实验样品的IC50值差异不大,BHT<VC<干叶精油=鲜叶精油。
2.5 总还原能力的测定
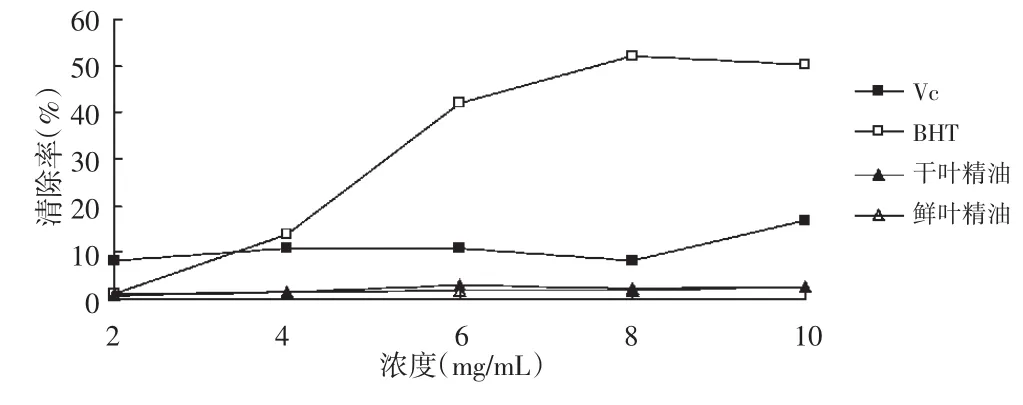
图5 各浓度样品总还原能力的变化曲线
由图5可知,各样品在浓度范围2.0~10.0mg/mL内,总还原能力总体呈上升趋势(P<0.05),个别点出现下降。VC的总还原能力较为平缓,BHT的上升幅度大且快速,浓度最大时达到最高点;干叶精油和鲜叶精油总还原能力较弱,远远低于BHT,二者趋势较为平稳且一致。发现柠檬鲜叶精油的清除能力较弱,其原因是柠檬鲜叶精油受pH值的影响较大,反应环境的pH值限制了其抗氧化活性。
2.6 抑制黄嘌呤氧化酶活性的测定

图6 各浓度样品抑制黄嘌呤氧化酶活性曲线
由图6可知,各样品在浓度范围2.0~10.0mg/mL内,抑制率曲线变化趋势无规律,多个测定点出现转折(P<0.05);VC在较低浓度时具有较好的抑制黄嘌呤氧化酶作用,随着浓度的增加而快速降低;BHT抑制黄嘌呤氧化酶的抑制率随着浓度的增加而增大,浓度越大,上升越缓慢;柠檬鲜叶精油和柠檬干叶精油抑制黄嘌呤氧化酶活性一般,最大抑制率约为45%,二者总体呈上升趋势,但个别点出现异常。因此,柠檬精油具有抑制黄嘌呤氧化酶活性的作用,但活性一般。
2.7 各活性指标的相关性分析
数据采用SPSS 19.0统计软件进行相关性分析,用Pearson进行显著性检验,以P<0.05为显著性检验标准,评价各种测定方法间的相关程度。柠檬叶精油及其萃取物的抗氧化性评价方法的相关性分析见表5和表6。

表5 干叶精油6种抗氧化性评价方法的相关性
由表5可知,干叶精油的6种测定抗氧化活性的评价方法中,羟基的清除能力与NO-2的清除能力的线性相关显著(P<0.05),其他活性指标间相关程度不明显。

表6 鲜叶精油6种抗氧化性评价方法的相关性
由表6可知,鲜叶精油的6种测定抗氧化活性的评价方法中,羟基自由基的清除能力与NO2-的清除能力的线性相关显著(P<0.05),总还原能力与NO2-的清除能力的线性相关非常显著(P<0.01),其他活性指标间相关程度不明显。
3 结论
采用水蒸气蒸馏法提取柠檬鲜叶和柠檬干叶中的精油,通过对柠檬叶精油清除DPPH自由基、羟基自由基、超氧阴离子自由基、亚硝酸钠、总还原能力以及抑制黄嘌呤氧化酶活性能力的测定,发现柠檬叶精油对各种自由基的清除效果有差异,鲜叶精油对羟基自由基和超氧阴离子自由基的清除能力较强,优于BHT和VC。干叶精油和鲜叶精油对羟基自由基的清除能力与NO2-的清除能力之间相关关系显著(P<0.05),且鲜叶精油的总还原能力与NO2-的清除能力之间的相关关系非常显著(P<0.01)。综上,柠檬叶精油具有较好的抗氧化活性,可对其活性加以利用。

