急性镉暴露对斑马鱼早期胚胎发育的毒性效应
杨瑞瑞,王 兰,孙 敏,申 萍
(山西大学生命科学学院,山西太原030006)
镉是环境中具有极强毒性的重金属污染物之一。工农业废弃物和生活污水的排放,使环境中的镉污染日益严重。镉可通过呼吸、吸附和摄入累积于生物体内,从而对生物体产生毒性[1]。少量镉长期积累于生物体内会对呼吸道产生刺激,对肝、肾、生殖等造成损伤,而且对胚胎的发育产生各种不利影响[2-3]。镉诱导生物体自由基和活性氧(reactive oxygen species,ROS)大量生成,造成氧化损伤。大量研究显示,镉的毒性机制与机体受氧化胁迫有关[4-5]。QU等[6]和JANCSÓ等[7]研究表明,镉暴露后会导致鲫鱼(Carassius auratus)和鲤鱼(Cyprinus carpio)的肝脏等组织中MDA含量和SOD,CAT,GPx等抗氧化酶活性发生改变。WANG等[8]将浓度为64.5,129,258,516,1 032 μmol/L 的镉暴露于河南华溪蟹(Sinopotamon henanense)7 d后检测镉对精巢的毒性作用发现,随着镉浓度增加,SOD活性先升高后降低;MDA和H2O2含量随镉浓度的升高而增加。HO等[9]研究发现,浓度为2.5 μmol/L的镉暴露于斑马鱼胚胎10 hpf后,能够显著下调Cu/Zn-SOD基因的表达。JIN等[10]研究表明,镉胁迫斑马鱼胚胎96 hpf后会导致其运动行为发生显著改变,同时,MDA含量增加,SOD等抗氧化酶活性改变。此外,急性镉暴露会使得斑马鱼幼鱼MDA含量显著增加,GPx活性显著下降,造成氧化损伤[11]。
斑马鱼(Danio rerio)已被广泛应用于许多研究领域,如药物毒理学、生态毒理学及环境检测[12]。1998年经济合作与发展组织(OECD)将斑马鱼胚胎毒性试验方法列为测定单一化学品毒性的标准方法之一[13]。目前,斑马鱼胚胎已被广泛应用于有机污染物的监测。与斑马鱼成鱼相比,斑马鱼早期胚胎具有发育快、易获得、易观察、敏感且透明等优点。目前,镉暴露对斑马鱼肝、肾、神经系统的毒性效应已有诸多报道,但镉对斑马鱼早期胚胎的发育毒性机制还不清楚。
本试验以斑马鱼早期胚胎为研究对象,探讨镉对早期胚胎的发育毒性,旨在为进一步研究镉对胚胎原始生殖细胞的毒性效应机制奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 供试动物 试验用斑马鱼品系为AB系,饲养于山西大学生命科学学院动物学实验室斑马鱼养殖水循环体系中,养殖系统循环水是用反渗透净水机制备,水温(28.3±1)℃,电导率为450~550 μS/cm,pH值为 7.0~7.5(利用碳酸氢钠调节),光周期为14 h光照/10 h黑暗,每天饲喂2次活丰年虾。
1.1.2 主要仪器及试剂
1.1.2.1 主要仪器 恒温光照培养箱(MGC-450BP,上海一恒科学仪器有限公司),体视显微镜(SZX16+DP71+IPP,日本),电动匀浆仪(F6/10,德国FLUKO公司),冷冻离心机(5804R,德国Eppendorf公司),多功能酶标仪(SpectraMax M5,美国 MD公司)。
1.1.2.2 主要试剂 氯化镉,纯度为99.0%,购于Sigma公司;丙二醛(MDA)检测试剂盒和超氧化物歧化酶(SOD)检测试剂盒,均购自南京建成生物工程研究所。
1.2 试验方法
1.2.1 镉暴露试验 收集胚胎的前1 d晚上,每个产卵缸放入雌鱼与雄鱼比例为1∶1或1∶2的斑马鱼成鱼,雌雄鱼用隔板分隔开,次日早晨待光照30 min后将隔板移去,于产卵后20 min左右收集受精卵。收集0.5 hpf内健康的斑马鱼胚胎置于玻璃皿中,每皿100颗胚胎,80 mL系统循环水。结合《渔业水质标准(GB 11607—92)》和镉对斑马鱼胚胎发育毒性的报道[14-15],本研究设置 0,4.44,8.90,17.80,26.70,35.60 μmol/L6 个镉浓度。胚胎进行镉暴露后,将其置于28.5℃光照培养箱中使胚胎继续发育。
1.2.2 斑马鱼胚胎畸形表型观察 胚胎经镉暴露后发育至 2,6,10,24 hpf时,每组随机选取 20 颗胚胎,体视显微镜观察胚胎发育情况,并记录其死亡数和畸形数。以卵凝结作为死亡终点。

1.2.3 MDA含量测定 取镉暴露后发育至2,6,10,24 hpf的斑马鱼胚胎,各处理组分别随机选取15颗胚胎,称质量后置于冰上,按质量体积比1∶19加入0.75%的生理盐水,匀浆,将匀浆液于4℃离心机(2 500 r/min,10 min)离心,取上清液。
采用硫代巴比妥酸(TBA)法测定MDA含量,并根据试剂盒说明书依次加入试剂,漩涡混匀,水浴,4 ℃离心机(4 000 r/min ,10 min)离心,取 200 μL上清液,加入96孔酶标板中,酶标仪测定OD值(激发波长532 nm)。
1.2.4 SOD活性测定 采用黄嘌呤氧化酶法测定SOD活性,按1.2.3的方法将胚胎匀浆后,根据试剂盒说明书操作,取200 μL上清液,加入96孔酶标板中,酶标仪测定OD值(激发波长550 nm)。
1.3 数据分析
以上试验均重复5~6次。所得数据使用SPSS 17.0软件进行单因素方差分析,通过LSD进行分析比较显著性(P<0.05,表明差异有统计学意义)。
2 结果与分析
2.1 镉暴露后斑马鱼早期胚胎死亡率分析
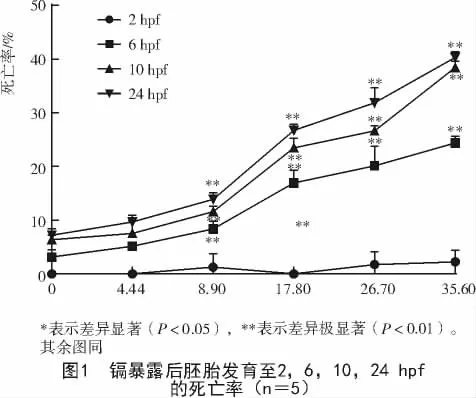
从图1可以看出,镉暴露后斑马鱼胚胎死亡率随着镉浓度的增加均有不同程度的升高。相对于对照组,镉暴露后胚胎发育至2 hpf时死亡率没有明显变化,而胚胎发育至6,10,24 hpf时,其死亡率急剧上升,且 6,10,24 hpf的胚胎在 8.90,17.80,26.70,35.60 μmol/L镉浓度暴露下死亡率极显著升高(P<0.01)。
2.2 镉暴露后斑马鱼早期胚胎畸形率分析
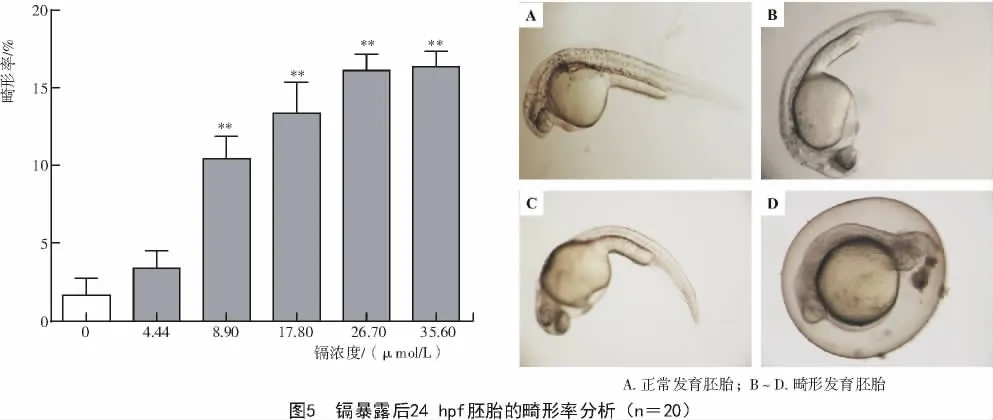
镉暴露后,发育至2,6,10,24 hpf的胚胎畸形率均随镉浓度增加逐渐升高。如图2,3,4,5所示,2,10 hpf的胚胎畸形率在镉浓度为17.80 μmol/L时显著增加(P<0.01),而 6,24 hpf的胚胎畸形率在镉浓度为8.90 μmol/L时极显著升高(P<0.01)。对照组2 hpf的胚胎发育到64细胞期,胚胎动物级均匀快速分裂(图2-A),而镉浓度组胚胎出现包状突起、未分裂、异常分裂、分裂延迟甚至分裂停止等畸形表型(图2-B~F)。
胚胎发育至6,10 hpf时,胚胎分别处于原肠期和体节期,此时可观察到对照组胚胎分别处于50%下包(图3-A)和3-体节时期(图4-A),而镉处理组中部分胚胎表现出发育滞后、外包延迟甚至引起死亡等现象(图3-B~D,图4-B~D)。



胚胎发育至24 hpf,主要的组织器官原基已形成。如图5-A所示,正常胚胎可观察到明显的体节、眼睛以及心脏搏动等,而镉浓度组中出现了卵黄囊水肿、心包水肿、尾部弯曲及发育滞后等多种畸形现象(图5-B~D),且镉浓度越高,胚胎畸形程度越严重,尤其在高浓度镉处理下大部分胚胎出现卵膜被破环,内容物溢出的现象。
2.3 镉对斑马鱼早期胚胎的氧化损伤
2.3.1 镉对斑马鱼早期胚胎MDA含量的影响 由图6可知,镉暴露后,2,24hpf的斑马鱼胚胎MDA含量的变化趋势基本一致,均随着镉浓度的增加逐渐升高。与对照组相比,在较低的镉浓度(8.90μmol/L)暴露下,MDA含量没有明显变化;在镉浓度高于17.80 μmol/L时MDA含量均显著升高(P<0.05)。
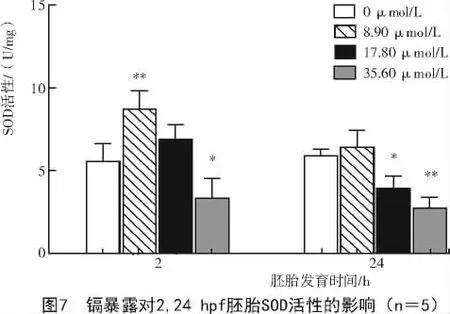
2.3.2 镉对斑马鱼早期胚胎SOD活性的影响 由图7可知,与对照组相比,镉暴露后,2,24 hpf胚胎的SOD活性均发生了显著性变化。8.90μmol/L镉暴露后,2hpf胚胎的SOD活性显著升高(P<0.01),而24 hpf胚胎的SOD活性无显著性变化;17.80 μmol/L镉暴露下24 hpf的胚胎SOD活性被显著抑制(P<0.05);35.60 μmol/L镉暴露下,2,24 hpf的胚胎 SOD活性均被显著抑制。

3 讨论
水生动物对环境污染物的敏感程度在整个生命周期中有所不同。在鱼类早期胚胎发育中,原肠胚阶段和细胞分裂阶段是发育的关键时期[16]。MCKIM等[17]对4种鱼类的完整生命周期进行了毒性试验,结果表明,胚胎、仔鱼和早期幼鱼是鱼类尤为敏感的生命阶段。因此,本试验针对斑马鱼的早期胚胎(2,6,10,24 hpf的胚胎)进行了发育毒性研究。诸多报道指出,重金属不仅会导致胚胎死亡率、孵化率发生变化,还会导致胚胎畸形。CHENG等[18]用浓度为1~1 000 μmol/L的镉暴露5 hpf的斑马鱼胚胎18 h后发现,镉可导致胚胎畸形率增加,引发头部发育不全,色素减退,心脏水肿,卵黄囊异常和尾部畸形。辛琦等[19]研究发现,纳米银和银离子暴露后,96 hpf斑马鱼胚胎的死亡率升高、孵化率下降,并出现体长缩短及卵黄囊肿大的畸形症状。与之相似的是,本研究显示,镉暴露后各个发育阶段的胚胎死亡率和畸形率均升高,证实镉对早期胚胎发育具有较强毒性。此外,镉暴露下6,10,24 hpf的胚胎死亡率显著增加,这可能是由胚胎发育至不同阶段对镉的敏感性不同所导致。如乙草胺对中华大蟾蜍(Bufo bufo gargarizans)早期胚胎的毒性研究中发现,早期胚胎对乙草胺的敏感性和耐受性因发育阶段不同而有所差异,原肠胚阶段是胚胎对乙草胺尤为敏感的时期[20]。与之相似,本研究中,6,24 hpf胚胎畸形率在镉浓度较低时表现出显著性,由此得出,6,24 hpf胚胎对镉的敏感性较强。
抗氧化防御系统在氧化应激过程中发挥重要作用,一旦被破坏,就会导致氧化损伤。抗氧化酶(SOD,CAT)和脂质过氧化物(MDA)是检测各种化学物质和重金属毒性的标志物[21-22]。有关文献表明,膜系统遭受损害与MDA有关,镉进入细胞会破坏膜结构,导致膜功能受损[23]。HSU 等[24]报道,1,3,5,9 μmol/L镉处理斑马鱼胚胎9 h后,MDA含量极显著性增加(P<0.01)。本研究显示,17.80,35.60μmol/L镉暴露胚胎2,24 hpf后,MDA含量发生显著变化。推测可能是较高浓度镉会在生物体内大量积累,诱导产生过量的氧自由基,进一步破坏机体的抗氧化系统,引起内环境失衡,膜系统损伤,从而导致MDA含量呈明显升高趋势。
SOD是生物体内清除氧自由基从而保护机体的第一道防线。本研究SOD活性试验结果显示,镉暴露后,2 hpf胚胎的SOD活性先升高后降低。与文献的报道相似,如JIN等[25]通过镉对鲫鱼的毒性试验发现,随着镉浓度增加,SOD活性发生改变。这可能是由于镉浓度较低时,诱发SOD活性升高,使得机体自身的抗氧化系统防御能力增强,有效去除氧自由基,防止细胞膜系统过氧化,维持机体内环境稳态;镉浓度较高时,可能导致SOD中的金属离子被置换,引起SOD活性下降。24 hpf的胚胎在镉浓度为17.80,35.60 μmol/L时SOD活性均被显著抑制,这可能是由于随着镉暴露时间的延长,使得胚胎镉积累量增多,镉会改变SOD分子构象,使其活性降低,并且使得O2-参与的经多步反应转化为水和氧气的氧化还原反应效率降低,从而造成氧化损伤。
综上所述,镉对分裂期、原肠期、体节期和咽囊期胚胎的发育均具有严重的毒性效应,并导致胚胎氧化损伤。研究结果为进一步探讨镉对鱼类胚胎原始生殖细胞的毒性效应机制提供了理论依据。

