西瓜YUCCA基因家族鉴定及在果实成熟过程中的表达分析
张倩倩田守蔚张 洁王艳萍孙宏贺任 毅郭绍贵宫国义许 勇张海英*
(1北京农学院植物科学技术学院,北京 102206;2北京市农林科学院蔬菜研究中心,农业农村部华北地区园艺作物生物学与种质创制重点实验室,蔬菜种质改良北京重点实验室,北京 100097)
生长素对作物果实成熟的调控具有重要作用,其调控机理研究已有一定进展,且不同物种中生长素作用差异较大。有研究表明,外源生长素处理未成熟的番茄果实,可以延缓果实成熟(Cohen,1996;Jones et al.,2002),但人工合成的生长素处理桃果实,可以加速果实发育、成熟和乙烯的产生(Sugaya et al.,2000)。在番茄、草莓、芒果等果实中,游离态吲哚-3-乙酸(indole-3-acetic acid,IAA)含量在果实成熟前开始下降,推测生长素含量的下降是果实启动成熟的标志(Given et al.,1988;Zaharah et al.,2012;Kumar et al.,2014);然而在桃果实发育后期,乙烯峰值出现的同时,果肉IAA含量较高(Tatsuki et al.,2013),表明生长素可能调节乙烯的生物合成进而调控果实成熟。
IAA是植物体内生长素的主要活性形式。IAA合成主要通过2种途径,色氨酸依赖途径和非色氨酸依赖途径。在色氨酸依赖途径中,最主要的是吲哚丙酮酸(IPA)途径,这是一个两步反应,即色氨酸在氨基转移酶TAA的催化下转化为IPA,接着在黄素单加氧酶YUCCA的催化下转化为IAA(Mano&Nemoto,2012;Zhao,2012)。遗传和生理分析证明YUCCA基因催化的是限速步骤(Zhao et al.,2001),此外这一途径广泛存在于植物界且高度保守(Zhao,2010)。
关于YUCCA基因调控果实成熟机制研究,在桃果实成熟上取得显著进展。研究发现:溶质型桃果实成熟软化依赖于果实成熟期IAA含量的突然增加,并诱导乙烯合成相关PpACS1基因的表达及乙烯释放,硬质型桃不软化则是因为其成熟期IAA合成受阻导致乙烯不能正常释放(Tatsuki et al.,2013)。转录组差异表达分析结果表明,桃果实发育后期IAA合成限速酶基因PpYUCCA11在溶质型桃果肉中上调表达,在硬质型桃果肉中几乎不表达,推测PpYUCCA11是造成溶质型桃与硬质型桃IAA合成差异及果实成熟差异的候选基因(Pan et al.,2015)。进一步的研究证明,硬质型桃PpYUCCA11基因ATG上游约2.1 kb处CACTA型转座子的插入,导致插入位点附近的果实特异性元件不能与果实成熟相关转录因子结合。因此,PpYUCCA11基因在硬质型桃果实中表达受阻,影响了IAA的合成(曾文芳 等,2017;Tatsuki et al.,2018)。但目前在其他作物中有关YUCCA基因调控果实成熟的分子机制还鲜见报道。
西瓜是世界十大水果之一,属于非呼吸跃变型果实,西瓜果实成熟的机理研究尚未取得突破,研究西瓜果实发育阶段生长素含量变化及其对西瓜果实成熟的作用及调控机制具有重要的理论与实践意义。
本试验通过测定栽培西瓜自交系97103果肉及果皮不同发育阶段游离态IAA含量,探索IAA含量与西瓜果实成熟发育之间的关系。进一步对生长素合成色氨酸依赖途径限速酶基因家族YUCCA进行西瓜全基因组鉴定和组织表达量分析,以期明确YUCCA基因家族中与西瓜果实发育相关的候选YUCCA基因,为深入探讨生长素在西瓜果实成熟中的作用机制提供新的线索。
1 材料与方法
1.1 试验材料
以栽培西瓜自交系97103为试验材料,该自交系由北京市农林科学院蔬菜研究中心西瓜课题组提供,2017年春季定植于北京市农林科学院蔬菜研究中心试验大棚,西瓜果肉、根、叶片、生长点、下胚轴和茎分别于授粉后26 d取样,西瓜果肉及果皮分别于授粉后10 d(未成熟白瓤期)、18 d(白粉瓤期)、26 d(红瓤期)、34 d(过熟期)取样,每个时期每个组织部位的样品各取3份。所有样品取样后立即冻于液氮中,储存在-80 ℃冰箱待用。
1.2 试验方法
1.2.1 番茄红素和可溶性固形物含量测定 番茄红素含量测定采用高效液相色谱法(HPLC)(袁平丽 等,2012),色谱柱为Poreshell EC-120(3.0 mm×100 mm),流速1.0 mL· min-1,进样量为10 μL,以502 nm为检测波长。西瓜果肉中心可溶性固形物含量用手持糖度计(ATAGO,日本)测定。
1.2.2 IAA含量的测定 游离态IAA含量采用液相色谱质谱联用法(HPLC-MS)测定,于中国农业大学生物学院质谱(MS)实验室进行。取-80 ℃冰箱保存的97103果实样品,加液氮于研钵中磨成粉末,取0.1 g磨好的样品加入提取液(异丙醇∶水∶盐 酸 =2 V∶1 V∶0.02 V)500 μL和 100 μg·L-1的内标溶液50 μL涡旋10 s混匀,在4 ℃、300 r·min-1条件下于金属浴中振荡30 min,加入氯仿萃取液1 mL涡旋10 s混匀,振荡30 min。4 ℃、14 000 r·min-1条件下离心5 min,转移下层溶液1.2 mL于新的离心管中,氮气吹干后加100 μL甲醇溶液复溶,相同条件下离心5 min,将上清液装入进样小瓶待测。所用液相色谱仪为Waters Acquity UPLC I-Class(Waters Corporation,34 Maple Street Milford,MA,01757 USA), 色 谱 柱 为 Poreshell EC-120(3.0 mm×100 mm,3 μm;Agilent,Santa Clara,CA),流速为 0.3 mL·min-1,进样量为 5 μL;质谱仪为Thermo Q-Exactive high resolution mass spectrometer(Thermo Scientific,Waltham,MA,USA)。每个样本进行3次重复。
1.2.3 西瓜YUCCA基因家族的鉴定和生物信息学分 析 从 TAIR(https://www.arabidopsis.org/index.jsp)中下载11个拟南芥的YUCCA基因的蛋白序列作为比对序列,在葫芦科基因组数据库(http://cucurbitgenomics.org)中通过BLASTP检索,e值小于 10-10, 用 SMART(http://smart.embl-heidelberg.de/)工具进一步验证候选基因的保守结构域,获得10个西瓜YUCCA基因的蛋白序列。
利用 ExPaSy(https://www.expasy.org/)进行蛋白质组成和理化性质分析,用 MEGA 5.0软件采用邻近算法Neighbor-Joining(NJ)构建进化树,外显子和内含子结构、保守结构域分别通过GSDS(http://gsds.cbi.pku.edu.cn/) 和 MEME(http://meme-suite.org/tools/meme)预测,利用DNAMAN软件进行多序列比对。
1.2.4 RNA提取,cDNA合成和qRT-PCR 各组织部位的总RNA用RNA提取试剂盒(北京华越洋生物科技有限公司)提取。使用TURBO DNA-freeTM Kit(Invitrogen)对各样品RNA进行纯化,利用试剂盒PrimerScript 1st Strand cDNA synthesis kit(Takara)合成cDNA,将cDNA链作为模板,西瓜Actin基因(Cla007792)作为内参(Actin是经本实验室前期对不同时期不同组织进行大量分析研究而确定的稳定内参基因),利用LightCycler 480型荧光定量PCR仪(Roche)进行定量PCR分析。特异性引物用软件Primer Premier 6设计(表1),由天一辉远生物科技有限公司合成。各基因的相对表达量用比较C-T法计算。
1.2.5 数据处理 利用Excel 2007软件进行数据处理和图表绘制,利用IBM SPSS 24.0软件进行统计分析。

表1 荧光定量PCR 扩增的引物序列
2 结果与分析
2.1 西瓜不同发育时期果实番茄红素和可溶性固形物含量的变化
西瓜自交系97103属于早熟类型,果实发育时间在30 d左右,随着果实成熟,西瓜含糖量与番茄红素含量也在不断积累,授粉后10 d处于果实的破色期,果肉刚刚开始出现红色,含糖量还很低;授粉后18 d处于果实的转色期,果肉部分积累番茄红素,瓤色中心转为红色,糖分开始积累,食用价值不太高;授粉后26 d处于果实的成熟期,果肉全面积累番茄红素,瓤色中心全部转为红色,糖分积累正常,可以食用;授粉后34 d处于果实的过熟期,果肉积累番茄红素到顶峰,瓤色过红,糖分积累达到高峰后略有下降,可以食用;因此将这4个时期作为取样点(表2、图1)。

表2 西瓜不同发育时期果肉番茄红素和可溶性固形物含量

图1 不同发育时期的西瓜果实
2.2 西瓜不同发育时期果肉与果皮组织IAA含量的变化规律
由图2可以看出,果肉中IAA含量在果实发育后期显著上调,在授粉后34 d达到最高,说明IAA含量与西瓜果肉发育成熟密切相关,而果皮组织中IAA含量一直维持在较低水平。
2.3 西瓜全基因组YUCCA基因家族的鉴定及进化分析
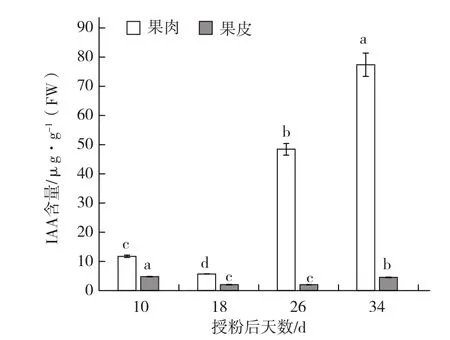
图2 不同发育时期西瓜果肉与果皮组织IAA含量的变化
通过西瓜基因组数据库BLASTP搜索,最终在西瓜基因组鉴定出10个YUCCA基因,这10个YUCCA基因的氨基酸数量由211个到793个不等,分子量大小从23.13 kDa到88.68 kDa(表3)。构建西瓜和拟南芥的系统发育树,并根据与拟南芥YUCCA基因的进化关系命名,ClYUCCA10有3个同源基因,根据其与AtYUCCA10氨基酸序列的相似性,分别命名为ClYUCCA10a(58.70%)、ClYUCCA10b(36.20%)、ClYUCCA10c(26.30%)。拟南芥和西瓜的YUCCA基因可以分为两类,第一类又可以分为两个亚类,AtYUCCA3、AtYUCCA5、AtYUCCA7、AtYUCCA8、AtYUCCA9和ClYUCCA3、ClYUCCA8、ClYUCCA9为一个亚类,AtYUCCA1、AtYUCCA2、AtYUCCA4、AtYUCCA6和 ClYUCCA2、ClYUCCA4、ClYUCCA6为另一个亚类;第二类则由AtYUCCA10、AtYUCCA11和 ClYUCCA10a、ClYUCCA10b、ClYUCCA10c、ClYUCCA11组成,这些聚为一类的YUCCA基因可能在功能上更相近(图3)。
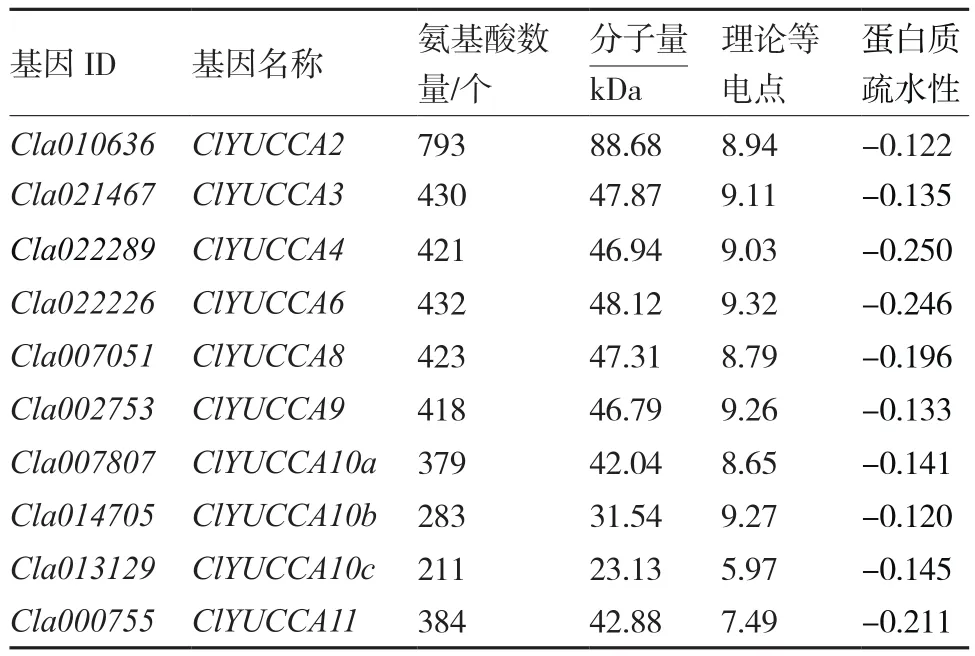
表3 西瓜全基因组YUCCA基因家族的基本信息
2.4 西瓜YUCCA基因家族的结构分析
利用在线工具GSDS对10个ClYUCCAs基因外显子及内含子结构进行分析。ClYUCCA6、ClYUCCA4、ClYUCCA2各 有4个 外 显 子;ClYUCCA10c、ClYUCCA10b均含2个外显子;而ClYUCCA11、ClYUCCA10a分别含4和5个外显子;ClYUCCA3、ClYUCCA8、ClYUCCA9各含3个外显子,且结构和大小十分相似(图4),与进化分析结果这3个基因聚为一类相一致。用DNAMAN软件多序列比对程序对10个ClYUCCAs基因的蛋白序列进行比对,所有基因均含有FMOs保守结构域,即6个相对保守的结构域,FAD结合基序、GC基序、ATG包含基序1、FMO识别序列、NADPH结合基序和ATG包含基序2,其中ClYUCCA10c、ClYUCCA10b不含有ATG包含基序2(图5)。进一步使用MEME在线工具对这6个保守结构域进行分析(图6),更清晰地看到保守位点的变化。在GC基序中,ClYUCCA3的氨基酸残基E变为D,ClYUCCA10c氨基酸残基A变为V,氨基酸残基S变为P;ATG包含基序1中,ClYUCCA2的氨基酸残基A变为G,ClYUCCA10a的氨基酸残基T变为S;在FMO识别序列中,ClYUCCA10b氨基酸残基F变为Y,ClYUCCA10c氨基酸残基Y变为F。由此推测这些基因在西瓜中可能具有不同功能。
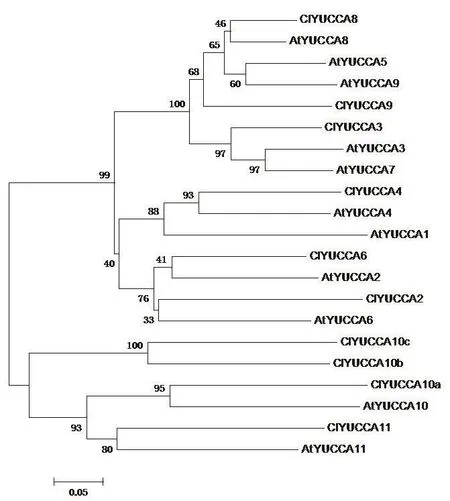
图3 西瓜与拟南芥YUCCA基因家族的系统进化树
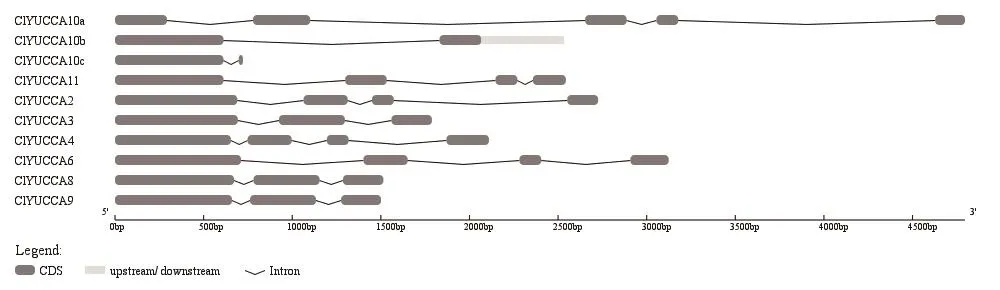
图4 西瓜YUCCA基因家族外显子和内含子结构

图5 西瓜YUCCA基因家族的多序列比对分析
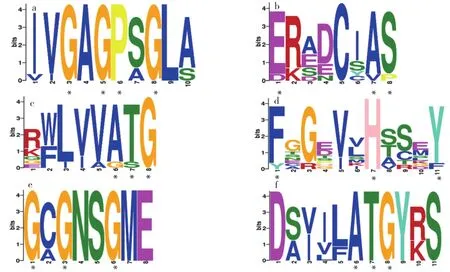
图6 西瓜YUCCA基因家族的保守结构域分析
2.5 西瓜YUCCA基因家族在西瓜不同组织中的表达分析
利用荧光定量PCR(qRT-PCR)检测了10个西瓜YUCCA基因在授粉后26 d果肉、根、叶片、生长点、下胚轴、茎等各个组织部位的表达量(图7),结果显示,ClYUCCA4和ClYUCCA10c在果肉中特异高表达,在其他部位表达量非常低;ClYUCCA6、ClYUCCA10b在果肉中也表达,但表达量很低,且在其他组织中均表达;ClYUCCA2、ClYUCCA6和ClYUCCA11主要在生长点表达,在其他组织表达量很低;ClYUCCA9在根中特异高表达;ClYUCCA3、ClYUCCA8及ClYUCCA10a未检测到表达。由此推断,在果实发育后期,ClYUCCA4和ClYUCCA10c可能在果肉IAA合成过程中起到重要作用。

图7 YUCCA基因家族在西瓜不同组织中的表达
2.6 西瓜YUCCA基因家族在果实不同发育时期的表达分析
为进一步明确YUCCA基因在西瓜果实相关组织中的特异性,分别取授粉后10、18、26 d和34 d的97103果肉和果皮,检测其在果肉和果皮中的表达情况。结果显示(图8),10个YUCCA基因中只有4个基因表达,分别为ClYUCCA4、ClYUCCA6、ClYUCCA10b和 ClYUCCA10c。 其 中ClYUCCA4在果肉组织中表达量相对较高,随着果实发育呈增长趋势,授粉后34 d表达量最高,而在果皮中表达量较低。ClYUCCA10c只在果肉组织中表达,前期不表达,在授粉后26 d时表达量达到最大值,34 d后表达量降低,ClYUCCA6和ClYUCCA10b在果肉中表达量较低。综上所述,ClYUCCA4和ClYUCCA10c在果肉发育后期的高表达可能是果肉IAA含量提高的原因,推测ClYUCCA4和ClYUCCA10c基因与西瓜果实发育成熟密切相关。

图8 YUCCA基因家族在果实不同发育时期的表达
3 结论与讨论
YUCCA基因家族编码黄素单加氧酶,催化植物生长素合成色氨酸依赖途径中IPA途径的限速步骤,该基因家族广泛存在于植物界且高度保守。YUCCA基因家族在拟南芥(Cheng et al.,2006)、水 稻(Yamamoto et al.,2007)、 玉 米(Gallavotti et al.,2008)、 小 麦(Li et al.,2014)、 杨 树(Ye et al.,2009)及黄瓜(Yan et al.,2016)等多种重要作物中得到鉴定。本试验鉴定了10个西瓜YUCCA基因。氨基酸序列分析显示西瓜YUCCA基因具有相似的基序结构,都具有FMOs保守结构域,其中ClYUCCA10c、ClYUCCA10b不含ATG包含基序2。亲缘关系分析显示西瓜YUCCA基因可以被分为两类,第一类又可以分为两个亚类,大部分YUCCA基因归于第一类,其中ClYUCCA2、ClYUCCA4、ClYUCCA6为一个亚类,这和在杨树以及黄瓜研究中的分类相似(Ye et al.,2009;Yan et al.,2016)。
YUCCA基因功能的研究相对较少。在拟南芥的相关研究显示,YUCCA参与的IAA合成途径对拟南芥胚胎发生、花器官发育及幼苗生长等发育过程发挥重要作用(Cheng et al.,2006,2007)。玉米的YUCCA同源基因spi1突变,导致侧枝和小穗数量减少(Gallavotti et al.,2008)。YUCCA基因的功能与基因表达的部位有直接关联。例如,敲除地上部特异表达的YUCCA基因仅会产生维管组织及花的发育缺陷,但对根的发育无不良影响(Cheng et al.,2006),破坏根部特异表达的YUCCA基因严重抑制主根的发育,但对地上部分的生长几乎没有影响(Chen et al.,2014)。因此,局部特异表达的YUCCA基因缺失可以破坏局部生长素的合成,而生长素的局部合成丧失仅会产生局部的生长发育缺陷(Zhao,2018)。果实成熟期,溶质型桃果肉IAA含量的突然增加,诱导乙烯合成相关PpACS1基因的表达及乙烯释放,从而加速了果肉的成熟软化,而硬质型桃不软化则是因为其成熟期PpYUCCA11基因在果肉中表达受阻,影响了IAA的合成导致乙烯不能正常释放(Tatsuki et al.,2013,2018;Pan et al.,2015;曾文芳 等,2017)。
本试验检测了西瓜果实不同发育时期,果肉与果皮中游离态IAA含量变化。结果显示,IAA含量在果实发育后期的果肉中显著上调,在果皮中则一直保持低水平。进一步对西瓜YUCCA家族成员的组织表达特异性检测发现,ClYUCCA4及ClYUCCA10c在果肉组织特异表达且在果肉发育的后期表达量显著提升,推测是西瓜果实发育后期果肉IAA合成显著提高的重要原因。ClYUCCA4及ClYUCCA10c可能通过调控西瓜果肉局部IAA的合成量,调控了西瓜的果实成熟过程。

