墨兰“梦之兰”杂交种子无菌播种繁殖技术
张月娇
(福建省林业科技试验中心,福建 南靖 363600)
我国兰花资源丰富,已知有173属,1 240种,主要分布于云南、台湾和海南等地。我国兰属资源虽然比较丰富,但是开展杂交育种较晚,品种改良进程缓慢。近年来,随着花卉产业的发展,兰花市场也跟着蓬勃发展,但墨兰市场则显得较为冷清,这与墨兰育种工作研究不多,少有新品种发现和推出具有重要的关系[1-2]。墨兰通过杂交育种获得的一个兰花果荚约能产生1.0×104~1.0×106粒种子,但非常细小,呈粉末状,没有胚乳,只有一个弱小的胚,胚内含有很少的营养物质,绝大部分为脂类物质,外面覆盖一层不透水不透气的膜状物质,在自然环境中很不容易发芽。为能获得新品种,开展无菌播种繁殖技术研究是解决兰花种子萌发困难的有效途径。
通过以墨兰良种“梦之兰”(良种编号:闽R-SCCS-038-2014)为母本开展杂交育种,对杂交获得的果荚进行无菌播种繁殖技术研究,为墨兰的杂交育种及自主品种选育提供有利的参考依据。墨兰良种“梦之兰”杂交种子无菌播种繁殖技术还未见报道。
1 试验材料
以“梦之兰”与“大富贵”杂交获得的果荚为试验材料。
2 试验方法
2.1 杂交果荚的获得
选择母本植株花葶中上部花蕾期长势较好的花朵挂牌,每枝花葶保留1~3朵花,其余花朵全部去除,挂牌后每天观察开花情况;选取当天开放的父本花朵,取下父本蕊柱先端的药帽,取出相互粘结的花粉块备用;挑选开放3~7 d的母本花朵,将母本花朵蕊柱的花粉囊盖打开,用镊子轻轻地将花粉块取出剔除;将父本的花粉块放入母本蕊柱顶端下侧的蕊腔中,去掉授粉花朵的唇瓣,随即在授粉花朵的部位悬挂标牌,写明杂交组合父母本名称(按母本在前、父本在后)、授粉日期和操作人。授粉时遮光75%,温度24~28℃。
母本植株授粉成功的花朵子房开始膨大,逐渐发育长成果荚,定期观察果荚的发育情况,待果荚转为黄绿色且未开裂时,即可采收进行无菌播种。
2.2 外植体的消毒处理
采收后的果荚先用软毛刷轻轻刷去附着于表面的灰尘等杂质,用沾有肥皂粉或洗洁精的软毛刷进行表面清洁,清水冲洗干净,晾干后用锋利的刀片切除花梗、残留的柱头等,装进广口瓶中,置无菌超净台上进行消毒处理,首先用75%酒精消毒30~60 s,无菌水冲洗2次后,再用0.1%的HgCl2振荡消毒10~20 min,无菌水冲洗5次以上,沥干水分备用。
2.3 原球茎诱导培养基的选择
在超净工作台上,取出消毒后的果荚,吸干附着于表面的水分,用解剖刀切去果荚上下两端的柱头和果柄,剖开果荚,将种子播撒在诱导培养基中。诱导培养基以因素基本培养基(改良MS、MS、KC)、6-BA(1.0、2.0、3.0 mg·L-1)和NAA(0.5、1.0、1.5 mg·L-1)为试验因子,采用正交表L9(34)安排试验[3](表1),共9个试验号,每个试验号接种30瓶,180 d后调查统计原球茎萌发数和萌发率,筛选最佳诱导培养基配方。
2.4 原球茎增殖培养基的选择
在诱导培养基中,挑选出生长健壮、大小均匀的原球茎,接种于因素基本培养基(改良MS、MS、KC、B5),6-BA(1.0、1.5、2.0、2.5 mg·L-1)、KT(1.0、1.5、2.0、2.5 mg·L-1)、NAA(0.5、1.0、1.5、2.0 mg·L-1),采用正交表L16(45)安排试验(表3),每个试验号接种30瓶,60 d后调查统计其增殖倍数,筛选最佳增殖培养基配方。
2.5 原球茎分化培养基的选择
将生长健壮的原球茎接种于以改良MS为基本培养基,附加不同浓度的因素6-BA(2.0、3.0、4.0 mg·L-1)、KT(2.0、3.0、4.0 mg·L-1)、NAA(0.5、1.0、1.5 mg·L-1),采用正交表L9(34)安排试验(表5),每个试验号接种30瓶,60 d后观察并统计原球茎分化出芽情况,筛选出最佳分化培养基配方。
2.6 生根壮苗培养基的选择
当分化出的芽苗长至3 cm以上时,即可接种于以改良1/2MS为基本培养基,附加不同浓度的因素NAA(0.5、1.0、1.5 mg·L-1)、IBA(1.0、1.5、2.0 mg·L-1)、AC(1.0、1.5、2.0 g·L-1),采用正交表L9(34)安排试验(表7),每个试验号接种10瓶,每瓶接种10株小苗,50 d后调查统计平均生根数,筛选出最佳生根培养基配方。
2.7 培养条件
果荚无菌播种后在诱导培养、继代增殖培养、分化培养和生根培养时,先进行7 d的暗培养后,再在培养室中进行光照培养,光照时间为12 h·d-1、温度为(25±2)℃、光照强度为2 000 lx[4],各阶段的培养基糖用量为30 g·L-1,pH值为5.0~5.5。
3 结果与分析
3.1 不同基本培养基和激素浓度对原球茎诱导影响
种子播种后,为保持培养空间的洁净,7 d后需及时剔除污染的接种瓶。种子在播种3个月后,部分种子开始肿胀萌发,慢慢形成乳白色的球状体,球状体渐渐变大变绿,部分长出白色的绒毛[5-6],播种6个月后,统计原球茎个数和萌发率,结果见表1。
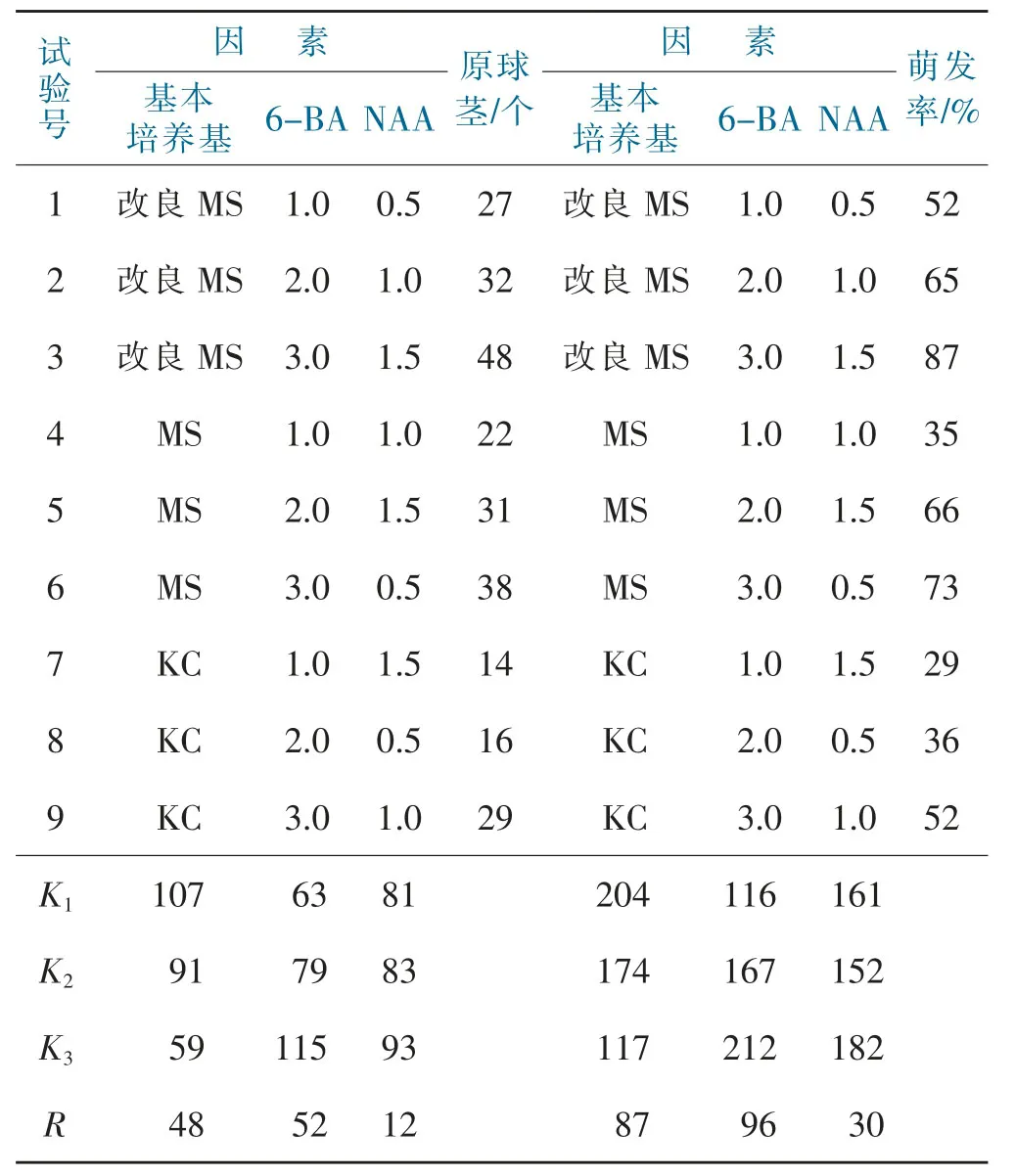
表1 原球茎诱导培养正交试验结果与分析Tab.1 Orthogonal test analysis results of protocorminduction culture
从表1的结果可以看出,各个试验号均能诱导出原球茎,试验3号(改良MS+6-BA 3.0mg·L-1+NAA 1.5 mg·L-1)诱导出的原球茎数最多(48个),从极差可以看出6-BA对试验结果的影响最大,其次是基本培养基,再次是因素NAA;从萌发率可以看出,试验3号(改良MS+6-BA 3.0 mg·L-1+NAA 1.5 mg·L-1)的萌发率最高(87%),从极差可以看出,6-BA对萌发率的影响最大,其次是基本培养基,再次是NAA。从不同激素浓度看,随着6-BA和NAA的浓度升高,原球茎分化数和萌发率逐步增加,从各水平的结果看,当6-BA的浓度为3.0 mg·L-1、NAA的浓度为1.5 mg·L-1时,其原球茎诱导数和萌发率的结果值最高。因此,得出墨兰梦之兰杂交果荚原球茎诱导的最佳培养基为改良MS+6-BA 3.0 mg·L-1+NAA 1.5 mg·L-1。
各因素对试验结果的影响进行方差分析,结果见表2。
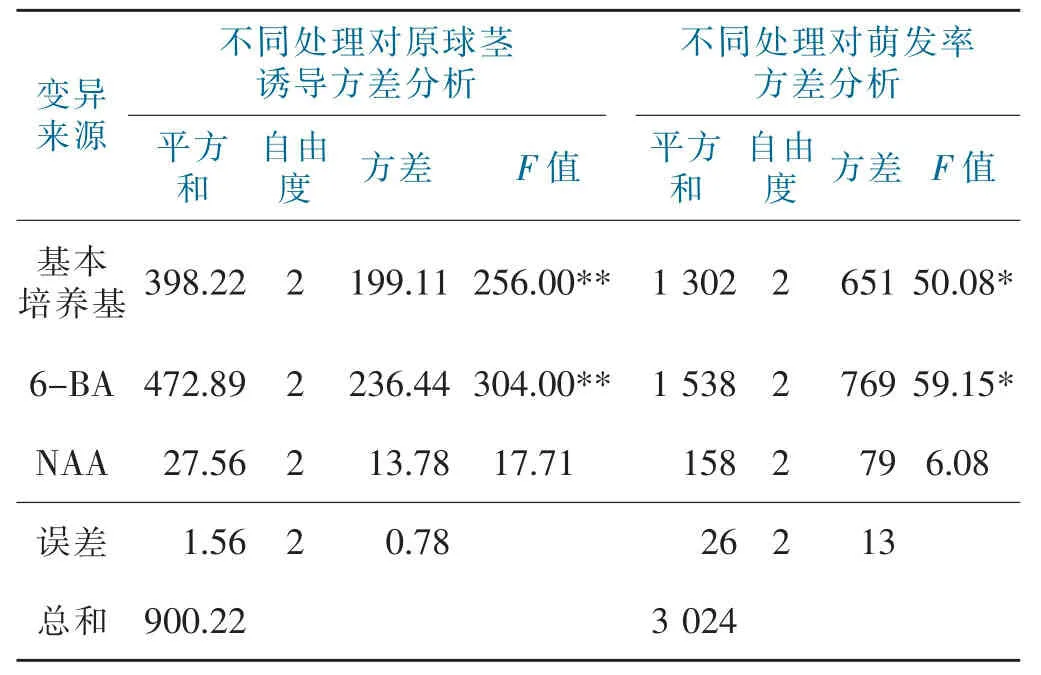
表2 原球茎诱导培养正交试验方差分析表Tab.2 Protocorm induced culture orthogonal test ANOVA
从表2的方差分析可以看出,基本培养基在原球茎诱导中的F值为256.00,大于F0.01,达到极显著水平,6-BA在原球茎诱导中的F值为304.00,大于F0.01,达到了极显著水平;在萌发率方差分析中,基本培养基的F值为50.08,大于F0.05小于F0.01,达到了显著水平,6-BA的F值为59.15,大于F0.05小于F0.01,达到了显著水平;NAA在原球茎诱导的F值为17.71,在萌发率的F值为6.08,均小于F0.05,表明NAA对原球茎的诱导和萌发率的影响不显著。
3.2 不同基本培养基和激素浓度对原球茎增殖影响
原球茎在增殖培养基中继续膨大,30 d后开始分裂出一些白色球状物;随着培养时间的增长,白色球状物渐渐变大变绿[7],接种60 d后统计原球茎增殖倍数,结果见表3。
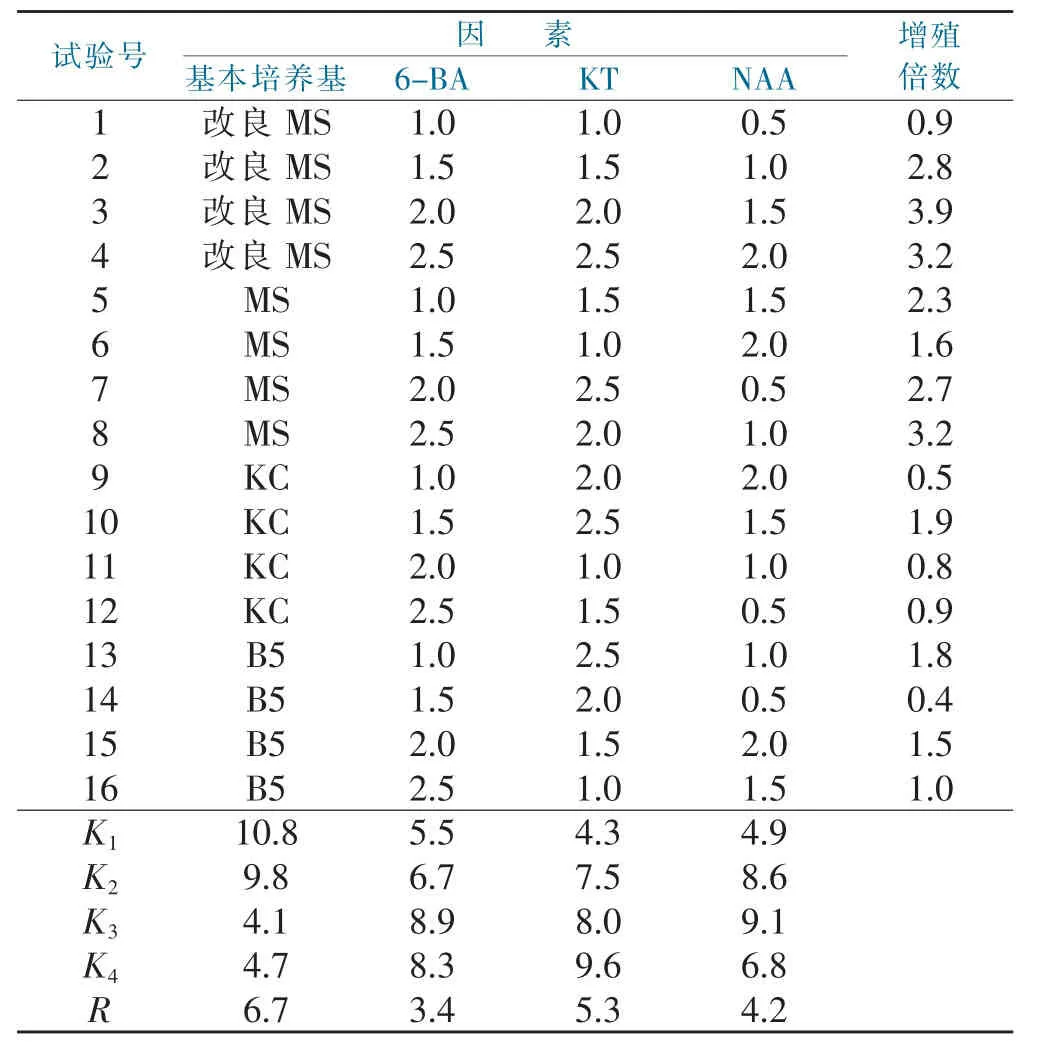
表3 原球茎增殖培养正交试验结果与分析Tab.3 Protocorm proliferation culture orthogonal test results
从表3中可以看出,各处理对原球茎的增殖均有一定的影响,从各试验号来看,以试验3号的增殖倍数最高(3.9);其次为试验4号和试验8号,增殖倍数均为3.2。从R值可以看出,基本培养基对增殖倍数的影响最大,其次是KT,再次是NAA。从K值可以看出,基本培养基的第1水平最好,6-BA的第3水平最好,KT的第4水平最好,NAA的第3水平最好,由此,原球茎增殖的最佳培养基为改良MS+6-BA 2.0 mg·L-1+KT 2.5 mg·L-1+NAA 1.5 mg·L-1。
对原球茎增殖的试验结果进行方差分析,结果见表4。

表4 原球茎增殖培养正交试验方差分析表Tab.4 Protocorm proliferation culture orthogonal test ANOVA table
由表4可以看出,基本培养基和KT的F值均大于F0.05小于F0.01,说明基本培养基和KT对原球茎的增殖影响显著,6-BA和NAA的F值均小于F0.05,说明6-BA和NAA对原球茎的增殖影响不显著。
3.3 不同激素浓度对原球茎分化的影响
原球茎在分化培养基中,培养30 d后有白色芽点冒出,芽点慢慢变绿,叶原基逐渐发育长出幼叶,形成单株小苗,60 d后统计萌芽株数,结果见表5。
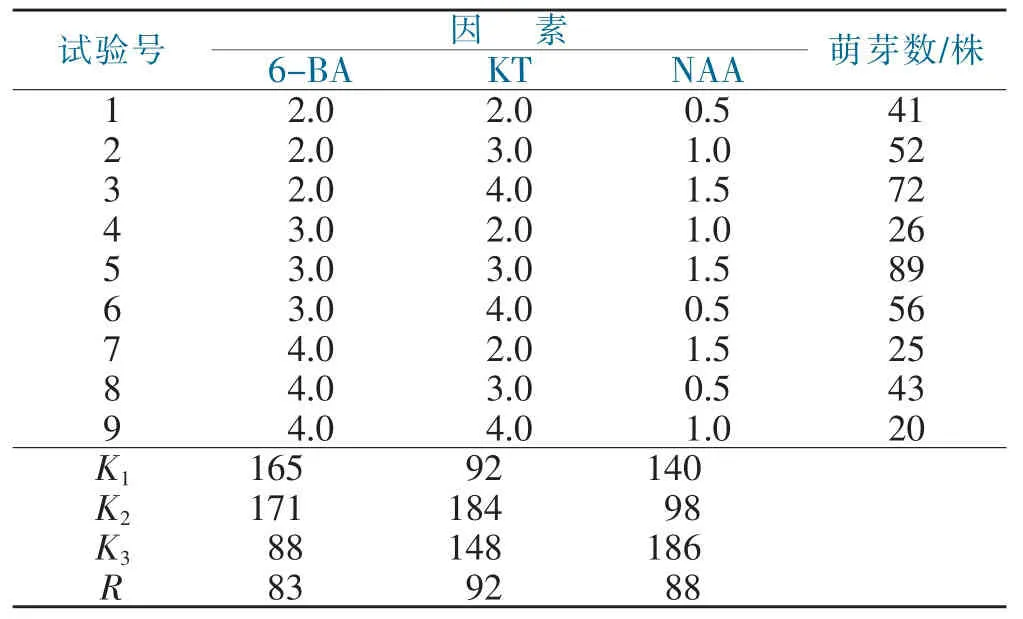
表5 不同激素浓度对原球茎分化的影响Tab.5 Effects of different hormone concentraitions on protocorm differentiation
从表5可以看出,不同激素浓度组合均能使原球茎分化出苗,其中试验5号的萌芽株数最多(89株),从R值可以看出,KT的R值最高,表明KT对原球茎分化的萌芽数影响最大,其次是NAA,再次是6-BA。从K值可以看出,6-BA的第2水平最好,KT的第2水平最好,NAA的第3水平最好。
对原球茎分化试验结果进行方差分析,结果见表6。

表6 原球茎分化正交试验方差分析表Tab.6 Protocorm differentiation orthogonal test ANOVA
从表6可以看出,因素6-BA、KT、NAA的F值均大于F0.05I小于F0.01,表明各因素对原球茎的分化均有显著影响。从各因素的最优水平可以得出,原球茎分化最佳培养基配方为改良MS+6-BA 3.0 mg·L-1+KT 3.0 mg·L-1+NAA 1.5 mg·L-1。
3.4 生根壮苗培养基的选择
将原球茎分化出带有3片以上叶子、高3 cm以上的小苗接种于生根壮苗培养基中,20 d后,小苗基部有白色根点形成,50 d后统计平均生根数,结果见表7。

表7 不同因素对生根壮苗影响的结果Tab.7 Effects of different factors on rooting and seedlings
从表7中可以看出,各试验号均能诱导出不定根,其中试验5号诱导出的根数最多,平均生根数可达3.1条,从R值可以看出,IBA对诱导生根数的影响最大,从各水平的K值看,因素NAA的第2水平最好,因素IBA的第2水平最好,因素AC的第3水平最好。
对生根壮苗的试验结果进行方差分析,结果见表8。
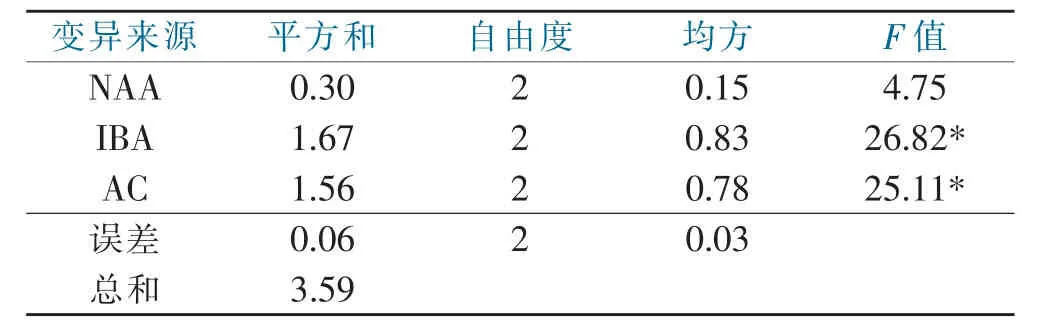
表8 不同因素对生根壮苗影响的方差分析表Tab.8 ANOVA table of different factors affecting rooting
从表8可以看出,IBA和AC对试验结果有显著影响,NAA对试验结果影响不显著。因此,结合各因素的最优水平看,梦之兰杂交种子生根壮苗的最适培养基为改良1/2MS+NAA 1.0 mg·L-1+IBA 1.5 mg·L-1+AC 2.0 mg·L-1。当培养基中的小苗根长至1 cm以上时,即可移到炼苗大棚进行移栽炼苗。
4 讨论与结论
兰花种子在自然条件下萌发较为困难,主要与其胚发育不完全、种皮致密透气性差和种皮中含有抑制物有关。而通过组织培养技术对果荚进行无菌播种可有效获取兰花幼苗,是兰花杂交育种和兰花产业发展的关键技术之一[8-9]。前人在兰花的无菌播种方面也有一些报道,如蓝炎阳等[10]使用MS为基本培养基,植物生长调节剂为6-BA和NAA,在种子萌发培养基中添加了活性炭,壮苗生根培养基中添加了香蕉泥和活性炭,建立了大花蕙兰和墨兰杂交种子的无菌播种方法,获得了种子萌发、根状茎增殖与分化、壮苗生根培养基的最适配方。张小娟等[11]运用MS培养基,附加植物生长调节剂6-BA和NAA,建立了墨兰种子无菌播种方法。陈汝民[7]等通过对墨兰种子、原球茎和根状茎的培养,获得了墨兰的幼苗。墨兰“梦之兰”是墨兰的一个新品种,其杂交种子无菌播种繁殖技术还未见有报道,本研究系统介绍了以“梦之兰”为母本开展杂交育种的过程和方法,对杂交种子无菌播种繁殖技术做了深入的阐述。研究发现,墨兰“梦之兰”杂交种子无菌播种基本培养基的主要组成也是MS培养基、6-BA和NAA,可见MS、6-BA和NAA是兰花无菌播种培养方法中的关键成分。但通过对MS基本培养基中的大量元素进行改良,对各培养阶段附加的激素浓度进行优化组合研究,获得了原球茎诱导的最佳培养基为改良MS+6-BA 3.0 mg·L-1+NAA 1.5 mg·L-1,原球茎增殖培养最佳培养基为改良MS+6-BA 2.0 mg·L-1+KT 2.5 mg·L-1+NAA 1.5 mg·L-1,原球茎分化最佳培养基为改良MS+6-BA 3.0 mg·L-1+KT 3.0 mg·L-1+NAA 1.5 mg·L-1,生根壮苗培养最佳培养基为改良1/2MS+NAA 1.0 mg·L-1+IBA 1.5 mg·L-1+AC 2.0 g·L-1,研究结果显示,利用优化后的培养基配方可获得大量有效的杂交子代幼苗。
兰花无菌播种受诸多因素的影响,每一个环节都可能影响最终的成苗。在实际操作中主要需注意如下几点:(1)诱导原球茎时,同一果荚的种子同时播种在相同的培养基中其萌发时间不一致,萌发时间间隔较长,在实际操作中,可将先萌发出的原球茎转接到增殖培养基中,未萌发种子转接到诱导培养基中继续萌发;(2)原球茎增殖培养时,增殖的原球茎必须及时进行转接,一般不宜超过90 d,否则会逐渐褐化死亡;(3)原球茎分化培养时,分化出的小苗长至3 cm高带有3片叶子时即可转接到生根培养基中进行生根培养,其余的原球茎转接到分化培养基中继续培养。

