阿司匹林/PLA/PVP复合纳米纤维的制备及其药物缓释性能试验
杨为森,吴敬林,王庆铭
(1.武夷学院 生态与资源工程学院,福建 武夷山 354300;2.闽北竹产业公共技术创新服务平台,福建 武夷山 354300)
近年来,高分子药物控制缓释在医学、生物、农业和环保领域得到了广泛应用。将高分子材料作为药物的载体,使药物和载体一起进入生物体内,药物在一定时间内以一定的速度缓慢释放,延长药物在体内的作用时间,从而起到提高药效并降低副作用的效果[1]。聚乳酸(PLA)是一种生物相容性良好、可生物降解且安全无毒的高分子材料,作为组织工程材料被广泛地应用于修复材料、伤口敷料、伤口闭合(应用缝合线、外科用品)以及控制释放体系等医学生物领域[2]。然而,PLA的高疏水性导致细胞黏附困难使得它的实际应用受限[1,3]。聚乙烯吡咯烷酮(PVP)是一种水溶性聚合物,具有优异吸湿性、溶解性、成膜性,良好的生物相容性和生物降解性,常用作成膜剂、药物包衣、缓释剂以及血浆增稠剂等[4-5]。研究发现,将PLA与PVP共混,有助于改善PLA的疏水性[2,6-8],提高PLA对细胞的黏附性。高压静电纺丝是一种简单有效的制备连续纳米纤维的技术,电纺纳米纤维具有高比表面积和孔隙率的优点,是一种优良的药物载体[9-10],如电纺聚乳酸纳米纤维及其复合物在药物缓释领域具有广阔的应用前景[11-12]。
以二氯甲烷/二甲基甲酰胺为溶剂,将PLA、PVP和阿司匹林混合,采用静电纺丝技术制备了阿司匹林/PLA/PVP复合纳米纤维膜,研究了复合纳米纤维膜的药物释放性能,拓宽了单一的PLA、PVP与阿司匹林在医学生物等方面的应用,为制备具有药物缓释功能的复合纳米材料提供了一种理论参考。
1 实验部分
1.1 主要试剂以及仪器
聚乙烯吡咯烷酮(PVP,相对分子质量130万)、聚乳酸(PLA,相对分子质量25万),阿拉丁试剂有限公司;二氯甲烷(DCM,AR)、二甲基甲酰胺(DMF,AR)、氢氧化钠(AR)、磷酸二氢钾(AR)、乙酰水杨酸(AR),国药集团化学试剂有限公司;去离子水,实验自制。
集热式恒温加热磁力搅拌器(DF-101S型),巩义市予华仪器有限责任公司;注射泵(LSP04-1A型),保定兰格恒流泵有限公司;高压电源(DW-P503-4ACCD),天津东文高压电源有限公司;紫外可见分光光度计(UV-1100型),上海美谱达仪器有限公司;实验室pH计(PHSJ-3),雷磁仪器厂;傅里叶变换红外光谱仪(AVATAR 330型),美国Nicolet公司;扫描电子显微镜(Vega 3),捷克TESCAN有限公司。
1.2 载药PLA/PVP复合纳米纤维膜的制备
将一定量的PLA和PVP分别加入到二氯甲烷(DCM)/二甲基甲酰胺(DMF)(体积比为2∶1)的混合溶剂中,在30℃下搅拌8 h,制得质量比为1∶1的PLA/PVP混合溶液。称取一定量的阿司匹林加入到上述PLA/PVP混合溶液中,室温搅拌6 h,使之完全混合,制得阿司匹林的占总溶质的质量分数分别为9%、11%、13%的载药PLA/PVP的纺丝液。将上述纺丝液装入体积为5 mL的注射器中,置于120 kV/m的电场下进行纺丝,将载药复合纳米纤维无规地收集在锡箔纸上,形成纳米纤维膜,取下,60℃真空干燥12 h,除去溶剂,置于干燥器中备用。
1.3 药物体外释放实验
1.3.1 磷酸盐缓冲溶液(PBS)的配制
取适量的氢氧化钠(NaOH)和磷酸二氢钾(KH2PO4),用去离子水溶解,分别配制成浓度分别为0.1 mol/L的NaOH溶液和0.2 mol/L的KH2PO4溶液,将两者混合至pH值为7.4的PBS缓冲溶液。
1.3.2 标准溶液曲线的绘制
分别配制质量浓度为10、15、20、25、30和35 mg/L的阿司匹林标准溶液,利用紫外-可见光分光光度计在阿司匹林的最大吸收波长275 nm处分别测定各标准溶液的吸光度。以阿司匹林标准溶液的浓度为横坐标,吸光度为纵坐标绘制标准工作曲线(如图1)。

图1 阿司匹林的标准工作曲线Fig.1 Standard operating curve of aspirin
1.3.3 载药复合纳米纤维膜的体外释放实验
取0.2 g干燥的载药的PLA/PVP复合纳米纤维膜,将其置于装有20 mL PBS缓冲溶液的锥形瓶中,密封,于37℃恒温振荡箱中振荡,每隔一段时间取出1 mL溶液,并再加入相同体积的PBS缓冲溶液,保持体积恒定。用紫外-可见光分光光度计测定吸光度,由阿司匹林的工作曲线计算药物浓度和释药量,然后计算累计的释放百分率。
1.4 样品表征方法
用傅里叶变换红外光谱仪对司匹林/PLA/PVP复合纳米纤维膜的组分进行分析。采用扫描电镜观察PLA/PVP和阿司匹林/PLA/PVP复合纳米纤维材料的形貌并测量其直径。
2 结果与讨论
2.1 阿司匹林含量对载药PLA/PVP复合纳米纤维结构的影响
图2是阿司匹林和阿司匹林质量分数分别为0%、9%、11%、13%的阿司匹林/PLA/PVP复合纳米纤维膜的红外光谱图。阿司匹林是乙酰水杨酸的俗称,其分子结构上具有3种特征官能团,即苯环、羧基、酯基。其中羧基既是强的受电子体又是强的供电子体,致使阿司匹林分子间存在极强的氢键作用,使得其无论在固态还是液态基本都是以环状二缔合体形式存在,1 695~1 725 cm-1之间的吸收峰和920 cm-1附近的中等强度的吸收峰是二缔合体羧酸中羰基和—OH面外弯曲振的特征吸收峰,单体无此谱带。图2(a)中阿司匹林的红外光谱图中具有二缔合体的特征谱带,可见阿司匹林是以二缔合体的形式存在而并非是单体形式。由图2(b)可知,在PLA/PVP的红外光谱中,3 400~3500cm-1为中—OH伸缩振动,2994和2 945cm-1归属于—CH的不对称与对称伸缩振动。1 755、1 182 cm-1分别为PLA中—C=O伸缩、C—O非对称伸缩振动,而1 652、1 290 cm-1归属于PVP中—C=O和C—N的伸缩振动。不同载药量的PLA/PVP复合纳米纤维膜的红外谱图上均出现了PLA和PVP的特征吸收峰[图2(c~e)],药物与PLA/PVP以物理共混的形式结合。然而,随着阿司匹林含量的增加,1 752 cm-1附近酯基上的羰基特征吸收峰强度逐渐增强,1 652 cm-1处酰胺键上—C=O特征吸收峰强度逐渐减弱,可能是阿司匹林、PLA和PVP三者之间产生了氢键所致。
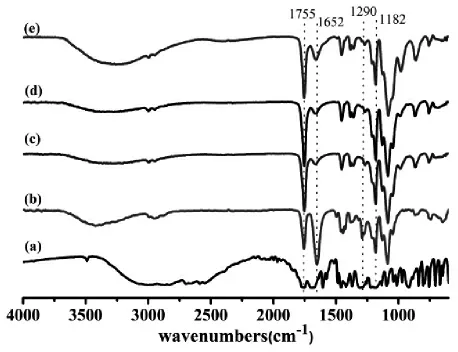
图2 阿司匹林和不同阿司匹林含量的阿司匹林/PLA/PVP复合材料的红外光谱图Fig.2 FT-IR Spectra of aspirin and aspirin/PLA/PVP composites with different aspirin contents
2.2 阿司匹林含量对阿司匹林/PLA/PVP复合纳米纤维形貌的影响
图3为PLA/PVP和载药量不同的PLA/PVP复合纳米纤维的SEM图。由图可知,PLA/PVP复合纳米纤维表面光滑,平均直径为(735±55)nm。不同载药量的PLA/PVP复合纳米纤维表面仍光滑且连续,无明显块状或结晶状物质析出,说明阿司匹林均匀分散在复合纳米纤维中。载药量为9%、11%、13%的复合纳米纤维的平均直径分别为(613±90)、(578±90)和(500±100)nm。可见,载药PLA/PVP复合纳米纤维的直径随着阿司匹林的增加而逐渐减小,且均小于PLA/PVP复合纳米纤维。原因可能是阿司匹林的加入,提高了纺丝原液的导电率[13],原液射流载有更多的电荷,在电场中受到的牵伸力更大,导致纤维直径变细。阿司匹林量加入过多时,射流中电荷太多且分布不均匀易导致分支,使纳米纤维的直径变得不均匀,分布范围更宽。

图3 阿司匹林含量不同的PLA/PVP复合纳米纤维的SEM图Fig.3 SEM images of PLA/PVP composite nanofibers with different content of aspirin
2.3 阿司匹林缓释对阿司匹林/PLA/PVP复合纳米纤维形貌的影响
通过SEM观察阿司匹林释放不同时期复合纳米纤维形貌的变化情况,如图4所示,纤维的直径列于表1中。由图4和表1可知,药物释放1 h时纤维因吸水发生溶胀,直径变大。随着药物释放的时间延长,复合纳米纤维直径逐渐减小且变得粗细不匀,纤维表面开始出现块状物质并且出现粘连现象。药物释放14 h时纤维直径明显变细,同一根纤维粗细严重不均匀,并在纤维表面逐渐产生孔洞,这可能是阿司匹林溶出和PVP在PBS溶液中有少量溶解所导致的。

图4 阿司匹林不同释放时刻时复合纳米纤维的SEM图Fig.4 SEM images of asprin nanofibers at different release time
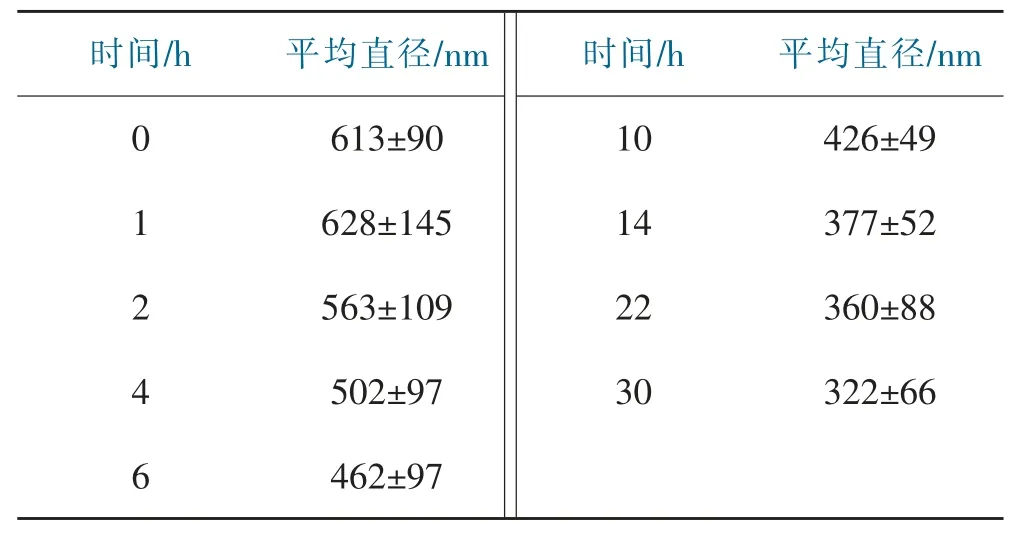
表1 不同释放时间复合纳米纤维的直径Tab.1 Diameter of composite nanofibers with different release times
2.4 体外释放性能的研究
图5是阿司匹林质量分数分别为9%、11%和13%的阿司匹林/PLA/PVP复合纳米纤维累计释药百分率曲线。由图可知,药物的释放速率随着阿司匹林质量分数的增加而增加,药物的累计释放百分率也逐渐增加,这是因为载药PLA/PVP复合纳米纤维的直径随着阿司匹林含量的增加而减小,比表面积逐渐增大,纤维表面的载药量也逐渐增大,载药复合纳米纤维与PBS缓冲溶液的接触面积越大,且药物扩散浓度越大,在相同的时间内药物就更加容易分散到释放介质中,因而释药速率依次增加[1,14]。三种载药纤维膜在释放14 h后,阿司匹林的累计百分率在50%~60%之间,前期的药物释放速率相对较快,14 h之后释放速率较慢,基本达到了恒速释放。这是由于纤维表层的阿司匹林释放完全之后,剩余的阿司匹林只能从复合纳米纤维内部向表面扩散再释放,从而导致后期释放速率减小[15]。30 h内载药复合纳米纤维的累计释药量均在70%以上。
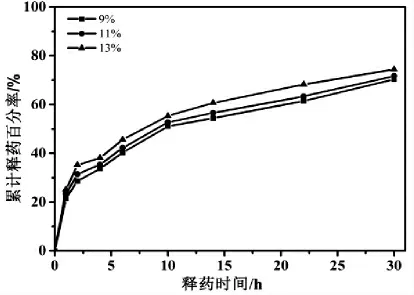
图5 载药量不同的阿司匹林/PLA/PVP复合纳米纤维的释放曲线Fig.5 Release curves of aspirin/PLA/PVP composite nanofibers with different drug loading
3 讨论与结论
采用纳米技术有助于以物理方式改善药物的物理存在状态或减少药物颗粒的直径,形成孔隙率高和韧性好复合纳米材料[19]。以高亲水性的聚乙烯醇、CS/PVA、胶原蛋白等[20-23]复合纳米纤维为载药体系,需经过化学交联或光交联以避免因溶液对药物载体的溶蚀而产生药物突释现象,工艺相对复杂,且化学交联剂可能在生物医学领域带来副作用。疏水性PLA是一种良好的药物载体,目前改善PLA亲水性的方法主要有化学改性[24-25]和物理共混[26]的两种方法。其中,物理共混的具有操作简单的优点而被广泛使用。PVP是一种水溶性的药用聚合物辅料,通常单独以PVP作为药物载体,可以改善药物的溶解性能且药物具有速溶的特点[19]。将PVP与PLA以物理共混的方式制备的复合纳米纤维为药物载体,不仅可以改善疏水材料PLA的亲水性,还可以实现对药物的缓释[26]。
采用静电纺丝技术制备的阿司匹林含量为9%、11%和13%的阿司匹林/PLA/PVP复合纳米材料对阿司匹林的释放时间都超过了30 h,且药物释放速率随着复合材料中含药量增加而提高。这种电纺纳米纤维载药体系可以控制药物缓慢释放。

