直接抗病毒药物治愈的慢性丙型肝炎患者NK细胞的免疫学特点分析
周文靖,史继静,李元元,王福生
慢性丙型肝炎(chronic hepatitis C,CHC)是由HCV感染引起的一种严重威胁人类健康的传染性疾病。病毒持续复制,机体HCV特异性免疫功能低下,诱发肝脏组织发生天然免疫和适应性免疫的损伤是CHC发生的主要病理基础[1-2]。机体适应性免疫尤其是细胞免疫在清除病毒过程中起重要作用,但天然免疫亦是机体抗HCV感染不可或缺的关键部分[3]。NK细胞作为机体天然免疫系统的主要成分,不仅在HCV感染早期病毒的自发性清除中发挥重要作用[4],还与慢性感染阶段抗病毒治疗效果有关[5]。当前,临床采用直接抗病毒药物(direct-acting antivirals,DAAs)可以治愈CHC,且疗程短、服用方便、安全性好,较干扰素抗病毒治疗具有极大的优势[6]。DAAs治疗已逐渐替代聚乙二醇干扰素- α/利巴韦林方案,成为国内外治疗CHC的主要手段。
目前有关DAAs治疗慢性HCV感染的研究较多集中在临床疗效方面,有关机体免疫学变化的研究较少。本研究对接受达拉他韦(daclatasvir,DCV)和阿舒瑞韦(asunaprevir,ASV)治疗的初治型HCV 1b型CHC患者外周血NK细胞表型和功能进行研究,以探索DAAs治疗对机体NK细胞免疫学特点的影响。
1 对象与方法
1.1 对象与材料
1.1.1 对象 纳入2015年9月 2016年11月于原解放军第三〇二医院门诊就诊,且接受DCV/ASV治疗的初治型HCV 1b型CHC患者13例。入组标准:①年龄≥18周岁;②仅为HCV 1b型感染;③初治受试者定义为既往未曾暴露于任何干扰素制剂、利巴韦林和DAAs;④筛选时HCV RNA≥104IU/ml ;⑤HIV-1和血清HBsAg阴性。排除标准:①有证据显示除HCV感染以外的疾病所导致的慢性失代偿性肝病,包括但不限于腹水、静脉曲张出血或肝性脑病;②确诊或疑似肝细胞癌或其他恶性肿瘤;③TBIL≥2 mg/dl(34 μmol/L);④ ALT ≥ 5×ULN;⑤白蛋白<3.5 g/dl(35 g/L); ⑥ AFP > 100 ng/ml(82.6 IU/ml)或AFP≥50 ng/ml且≤100 ng/ml(≥41.3 IU/ml且≤82.6 IU/ml)的受试者须进行肝脏超声检查,如疑似肝细胞癌则应排除;⑦HGB<8.5 g/dl(85 g/L);⑧中性粒细胞绝对计数<0.5×109/L;⑨PLT<50×109/L;⑩未受控制的糖尿病或高血压;中、重度抑郁症。所有患者均接受24周的DCV/ASV治疗,治疗结束后随访24周。另纳入健康对照(healthy control,HC)13例(表1)。入组的所有受试者均签署知情同意书。
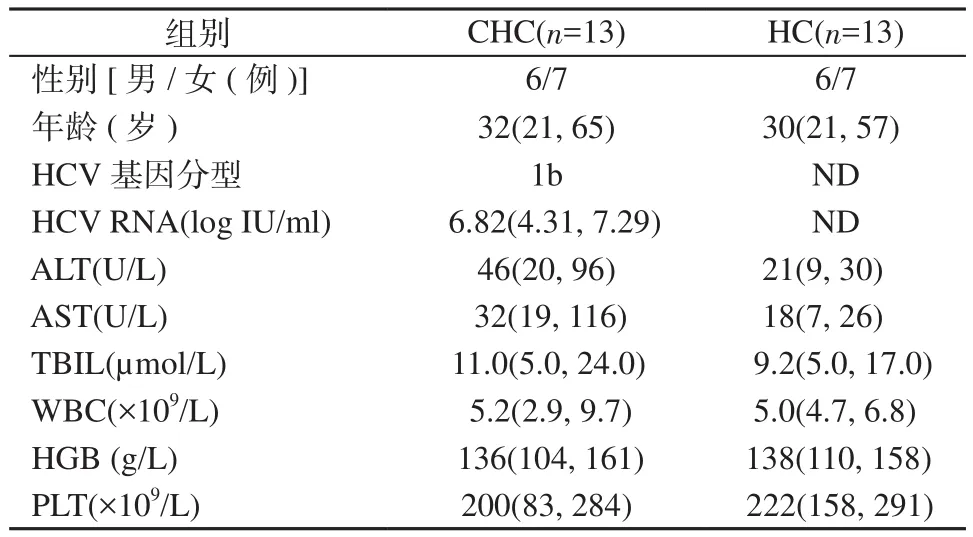
表1 入组患者和健康对照的基线临床资料Table 1 Baseline clinical data for enrolled CHC patients and healthy controls
1.1.2 材料 鼠抗人CD3-BV421、CD56-Percp、CD56-BV510、CD16-FITC、HLA-DR-BV421、CD38-PE-cy7、NKP46-BV510、NKP30-BV421、IFN-γ-PE-cy7、TNF-α-PE 等荧光抗体均购自美国Biolegend公司;鼠抗人NKG2A-PE购自美国R&D公司;CD107a-FITC荧光抗体、Golgistop、破膜剂及破膜洗液均购自美国BD公司;胎牛血清(fetal bovine serum,FBS)、RPMI 1640培养液均购自美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、佛波酯(phorbol-12-myristate-13-acetate,PMA)、离子霉素(ionomycin,IONO)、1%多聚甲醛均购自美国Sigma公司;淋巴细胞分离液购自天津美德太平洋公司;IL-12购自美国PeproTech公司;IL-18购自美国Biovision公司;HCV核酸定量检测试剂盒购自湖南圣湘生物科技有限公司。
1.2 方法
1.2.1 HCV核酸定量检测 使用HCV核酸定量检测试剂盒定量检测HCV RNA水平,该试剂盒的定量下限为50 IU/ml,检测下限为25 IU/ml,HCV RNA<25 IU/ml定义为检测不到。
1.2.2 外周血单个核细胞的分离与冻存 分别于CHC患者接受治疗第0周、1周、2周、4周、6周、8周、10周、12周、16周、24周及治疗结束后随访第4周、12周、24周采集EDTA抗凝外周静脉血,另外分别采集13例HC外周抗凝静脉血,1500 r/min离心10 min,留取血浆,将剩余细胞悬液用Ficoll-Hypaque密度梯度离心法分离获取外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),用含90%FBS和10%DMSO的细胞冻存液进行冻存。
1.2.3 NK细胞表型分子流式染色 复苏冻存的PBMCs,调整浓度为 5×106/ml,取 100 μl置于流式管中加入表型抗体(CD3、CD56、CD16、CD38、HLA-DR、NKP30、NKP46、NKG2A),混匀,室温避光孵育25 min;加入1 ml PBS,混匀,离心洗涤,1500 r/min,5 min;弃上清,拍干;用200 μl 1%多聚甲醛液重悬细胞,4 ℃避光保存,24 h内用流式细胞仪检测。
1.2.4 NK细胞脱颗粒(CD107a)和释放IFN-γ、TNF-α检测 复苏冻存的PBMCs,用含10%FBS的RPMI-1640细胞培养液重悬,按5×105/孔铺入96孔细胞培养板中;向指定培养孔内分别加入刺激因子 [PMA(50 ng/ml)+IONO(1 μg/ml)、IL-12(50 ng/ml)+IL-18(50 ng/ml)],同时向每孔加入 Golgistop(10 μg/ml)和鼠抗人CD107a荧光抗体,混匀,放入37 ℃ CO2细胞培养箱孵育6 h;收集细胞至流式管中,加入1 ml PBS,震荡混匀,1500 r/min离心5 min洗去刺激剂;弃上清液,加入表型抗体(CD3、CD16、CD56),避光孵育25 min;PBS洗涤后加入破膜剂,4 ℃避光破膜30 min;破膜洗液洗涤后加入IFN-γ、TNF-α单抗,避光孵育25 min;破膜洗液洗涤后,用300 μl 1%多聚甲醛液重悬细胞,4 ℃避光保存,24 h内用流式细胞仪检测。
1.2.5 统计学处理 使用SPSS 19.0软件对数据进行统计分析,并用GraphPad Prism 6.0进行图形绘制。定量资料以中位数(最小值,最大值)表示,CHC患者与HC各不同治疗时间点之间的比较采用Mann-Whitney非参数U检验,CHC患者不同治疗时间点之间的两两比较采用Wilcoxon配对符号秩检验,P<0.05为差异有统计学意义。
2 结 果
2.1 DCV/ASV治疗过程中CHC患者血清HCV RNA水平 对13例患者进行DCV/ASV抗病毒治疗,并在治疗过程中动态监测患者血清HCV RNA水平。结果显示,13例患者治疗前的HCV RNA水平为6.82(4.31,7.29)log IU/ml,所有患者在接受DCV/ASV治疗2周内血清HCV RNA均下降至检测不到的水平(HCV RNA<25 IU/ml),并一直维持到随访结束。
2.2 DCV/ASV治疗的CHC患者NK细胞表型变化 外周血NK细胞表型检测分析结果显示,与HC组相比,CHC患者治疗前外周血NK细胞活化程度较高,表达HLA-DR(U=43.000,P=0.037)(图1A)、CD38(U=39.500,P=0.023)(图1B)和NKP46(U=13.000,P< 0.001)(图1C)的水平显著升高;表达NKP30(图1D)和NKG2A(图1E)的水平无明显差异。接受DAAs治疗后HLA-DR的表达水平显著下降,且与HC组无显著性差异(图1A)。随访结束时NKP46的表达水平较治疗前显著下降(Z=84.000,P=0.007),但仍高于HC组(U=31.000,P=0.008)(图1C)。
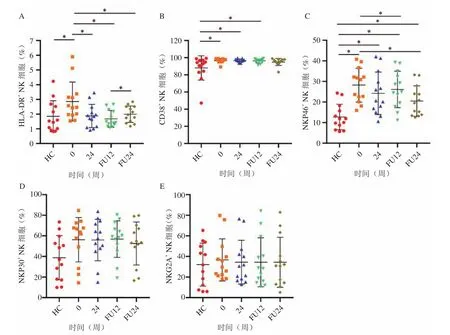
图1 DCV/ASV治疗的CHC患者NK细胞表型分析A~E.DCV/ASV治疗的CHC患者NK细胞HLA-DR、CD38、NKP46、NKP30、NKG2A的表达水平;0.治疗第0周(治疗前);24.治疗第24周;FU 12 、FU 24.治疗结束后随访第12周、24周;*.P<0.05Figure 1 Phenotypic analysis of NK cells in CHC patients treated with DCV/ASV
2.3 DCV/ASV治疗的CHC患者NK细胞毒性和功能的检测 在体外分别用PMA+IONO、IL-12+IL-18刺激来源于CHC患者和HC的PBMCs,通过流式细胞术检测NK细胞分泌CD107a、IFN-γ和 TNF-α的能力。结果显示:IL-12+IL-18刺激下,CHC患者治疗前分泌CD107a(U=16.000,P=0.002)和 TNF-α(U=36.000,P=0.040)的能力均较HC显著增高(图2A、2C),产生IFN-γ的能力显著降低(U=28.000,P=0.012)(图2B);DAAs治疗后,CHC患者在随访12周时CD107a的表达水平较治疗前有显著下降(Z=3.000,P=0.005)但仍高于HC(U=33.000,P=0.026),随访结束时与HC无明显差异(图2A);CHC患者NK细胞产生IFN-γ的能力在DAAs治疗后明显增强(Z=71.000,P=0.012)(图2B)。PMA+IONO刺激下,3种细胞因子的表达水平在组间及组内不同时间点无明显差异(图3)。

图2 IL-12+IL-18刺激下DCV/ASV治疗的CHC患者NK细胞毒性和功能的变化A~C.IL-12+IL-18刺激下DCV/ASV治疗的CHC患者NK细胞分泌细胞因子CD107a、IFN-γ和TNF-α的能力;0.治疗第0周(治疗前);24.治疗第24周;FU 12 、FU 24.治疗结束后随访第12周、24周;*.P<0.05Figure 2 Changes of NK cells cytotoxicity and function in CHC patients treated with DCV/ASV in response to IL-12 +IL-18 stimulation

图3 PMA+IONO刺激下DCV/ASV治疗的CHC患者NK细胞毒性和功能的变化A~C.PMA+IONO刺激下DCV/ASV治疗的CHC患者NK细胞分泌细胞因子CD107a、IFN-γ和TNF-α的能力;0.治疗第0周(治疗前)24.治疗第24周;FU 12 、FU 24.治疗结束后随访第12周、24周Figure 3 Changes of NK cells cytotoxicity and function in CHC patients treated with DCV/ASV in response to PMA +IONO stimulation
3 讨 论
天然免疫是机体抗病毒感染的第一道防线,对控制病毒感染和有效启动获得性免疫至关重要。NK细胞是天然免疫系统的重要组成成分,在HCV感染的各阶段均发挥着关键作用[7]。有研究表明,慢性HCV感染阶段患者NK细胞的活化程度增高、细胞毒性增强,但分泌IFN-γ的能力受损,不利于病毒的清除[8-10]。
DAAs的出现使CHC患者得以治愈,但DAAs治疗对机体免疫系统的影响目前仍不十分清楚。有研究显示,DAAs介导的HCV清除伴随有NK细胞免疫学功能的变化[11-15]。但亦有学者报道DAAs治疗后,CHC患者NK细胞的免疫学变化尚不确定,仍须进一步讨论[16]。
HCV 1b型是我国HCV感染最常见的基因型[17],DCV/ASV作为国内首个获批的DAAs联合治疗方案,对HCV 1b型CHC患者治愈率高、安全性与耐受性良好。本研究发现13例CHC患者接受DCV/ASV治疗24周后均获得持续病毒学应答。对其免疫学特点进行分析发现,CHC患者治疗前外周血NK细胞表达HLA-DR、CD38、NKP46、CD107a的水平显著增高,表达IFN-γ的水平显著降低,表明CHC患者外周血NK细胞活化程度增高,细胞毒性增强,但产生IFN-γ的能力减弱,这与既往研究报道一致[8-10]。此外,我们通过对DAAs治疗的患者不同随访时间点的外周血NK细胞表型和功能特点进行比较,发现治疗后患者NK细胞HLA-DR、NKP46、CD107a的表达水平显著下降,同时IFN-γ的表达水平显著升高,表明DAAs治愈的CHC患者外周血NK细胞的活化程度和细胞毒性降低,分泌IFN-γ的能力增强。同时,本研究还发现,CHC患者在接受DAAs治疗前及治疗过程中NK细胞表达NKP30和NKG2A的水平并未发生明显改变,这与既往的研究结果不同,先前研究认为CHC患者治疗前外周血NK细胞表达NKP30和NKG2A的水平显著增高,且经DAAs治疗之后其表达水平均显著下降[11-12,14],造成这种差异的原因可能与入选病例的种族、治疗经历、HCV基因型及采用DAAs治疗方案的不同有关。
总之,本研究发现DAAs在快速抑制CHC患者体内HCV达到治愈水平的同时,伴随NK细胞免疫功能的变化。然而,由于入组病例数较少,患者感染的HCV基因型及采用的DAAs治疗策略单一,研究存在着一定的局限性,有关DAAs治疗对机体免疫系统的影响及其具体机制有待进一步探索与验证。

