艾滋病抗病毒治疗新进展
吴雪韵,沈银忠
自1996年进入联合抗反转录病毒治疗(antiretroviral therapy,ART)时代,HIV感染者经过ART后病毒载量可得到有效抑制,患者的病死率大大下降[1],但同时也不可避免地催生了耐药HIV的出现,给艾滋病的治疗带来了不小的挑战。HIV在人体内的复制过程主要包括吸附和进入、反转录和整合、转录及翻译、成熟及出芽;不同的药物类型通过干扰病毒生活周期中不同的环节而发挥抗病毒作用。除外多种药物组合形成的单片制剂,目前国际上共有50余种抗反转录病毒药物,可分为7大类,分别是核苷类反转录酶抑制剂(nucleoside reverse transcriptase inhibitors,NRTIs)、非核苷类反转录酶抑制剂(nonnucleoside reverse transcriptase inhibitors,NNRTIs)、蛋白酶抑制剂(protease inhibitors,PIs)、整合酶抑制剂(integrase strand transfer inhibitors,INSTIs)、 融合抑制剂(fusion inhibitors,FIs)、CCR5抑制剂以及新型作用机制药物如CD4吸附后抑制剂[2]。另外还有常与PIs合用的利托那韦(ritonavir,RTV)、考比司他(cobicista,COBI)2种增效剂。ART方案通常包括两种NRTIs(称为骨干药物)和第三种药物。根据目标人群的不同,ART方案大致分为优选方案(初治人群)、二线方案(初治失败人群)及优化和简化治疗方案(病毒载量控制良好,因药物不能耐受或减少药物相互作用等原因须改变方案者)。ART方案的制定须要综合考虑药物的不良反应、相互作用和可及性,患者的用药经过、病毒载量、经济能力和服药负担,病毒的耐药性等因素[2]。本文结合国内外相关研究和指南,综述艾滋病ART药物的研究进展以及目前推荐的ART优选和简化方案,为临床医师启动和优化艾滋病患者的ART提供参考。
1 抗病毒治疗药物研究进展
1.1 核苷类反转录酶抑制剂 目前,丙酚替诺福韦(tenofovir alafenamide,TAF)逐渐代替传统替诺福韦酯(tenofovir disoproxil fumarate,TDF)成为ART的骨干药物。TAF为一种新兴的NRTIs,有研究证明包含TAF方案的有效性并不劣于包含TDF的方案[3-5]。TAF与TDF均为替诺福韦的前药,但相比TDF,TAF更易浓集于淋巴组织,且在CD4+T细胞中更能有效转化为替诺福韦双磷酸盐(药物的活性形式)[6-7]。由于TAF有特殊的组织分布,血药浓度较低,故肾、骨毒性更低,已有许多临床研究在初治、经治患者中证实了它短期内的安全性[5,8]。也有报道称TDF相关的肾功能损害在换用TAF后有所逆转[9]。TAF与恩曲他滨(emtricitabine,FTC)联合使用现已成为6岁以上非性活跃儿童和青少年的首选NRTIs骨干组合[10]。传统的NRTIs不良反应多,对于不能耐受的患者,可替换为同类中毒性较小的药物如TAF或其他种类药物。临床实践中,TDF和TAF常可互换,TAF的肾毒性和促骨质疏松作用较轻,但TDF具有价格优势,对血脂的影响较小[8]。
1.2 非核苷类反转录酶抑制剂 当前,NNRTIs中的多拉韦林(doravirine,DOR)逐渐成为ART的重要选择药物。美国卫生和人力服务部(United States Department of Health and Human Services,DHHS)颁布的指南推荐以NNRTIs为基础的初治方案中增加DOR[11]。一项769例受试者参与的III期临床试验DRIVE-FORWARD对比了服用DOR+2NRTIs和达芦那韦(darunavir,DRV)/RTV+2NRTIs的有效率(定义为治疗48周时血浆HIV RNA<50 拷贝/ml),结果显示基于DOR的方案非劣效于基于DRV/RTV的方案(有效率分别为84%和80%),且发生腹泻、恶心、中断治疗的患者比例少于DRV/RTV方案,仅头痛发生率略高(分别为6%和3%)[12]。另一项DRIVE-AHEAD临床试验考察了DOR复方单片制剂的有效性和安全性。该单片制剂由100 mg DOR、300 mg拉米夫定(lamivudine,3TC)、300 mg TDF组成,其疗效非劣效于依非韦伦(efavirenz,EFV)/ FTC/TDF组合(有效率分别为84.3%和80.8%),不良反应(眩晕、睡眠障碍、感觉异常)发生率更低,且DOR/3TC/TDF对低密度脂蛋白、非高密度脂蛋白的影响更小(低密度脂蛋白平均降低1.6 mg/dl和3.8 mg/dl,非高密度脂蛋白平均升高8.7 mg/dl和13.3 mg/dl)[13]。DHHS 指南中将 DOR/TDF/3TC和DOR+TAF/FTC列入次优推荐药物[11]。DOR对常见的含有抗NNRTIs传播性突变位点K103N、Y181C和G190A的HIV有效,且比EFV有更高的耐药屏障[14]。DOR使用时应注意不能与利福平和RTV合用。但由EFV转为DOR的患者换药后2 d内DOR不能达到有效浓度,不过就目前数据来看病毒抑制患者换药似乎没有必要调整DOR剂量[15]。此外,DOR还有其他优势:单片制剂每日1次给药,无食物服用限制,与质子泵抑制剂无明显的药物间相互作用,且对QT间期无明显影响。
我国第一个联合NRTIs和NNRTIs的复方制剂于2018年7月上市,包含奈韦拉平 200 mg、齐多夫定 300 mg及3TC 150 mg,相比进口药物是更具性价比的选择。
1.3 整合酶抑制剂 近年来,INSTIs类药物不断出现并成为ART优选药物。INSTIs通过阻断病毒DNA整合至宿主DNA的过程来影响病毒的复制,具有高效低毒、药物间相互作用少、耐药率低和服药方便等优点。目前INSTIs主要有拉替拉韦(raltegravir,RAL)、艾维雷伟(elvitegravir,EVG)、 多 替 拉 伟(dolutegravir,DTG)和bictegravir(BIC)以及尚在临床研究中的cabotegravir。总体而言,新一代INSTIs中DTG和BIC将逐渐成为ART的主要优选药物。
RAL是第一个被批准用于初治、经治患者的INSTIs。常规给药方式为400 mg,2次/d。近期研究提示,更改RAL+TDF+FTC方案中RAL用法为1200 mg,1次/d,并不影响疗效[16]。在美国儿科ART指南中,RAL成为0~6岁儿童优选的含INSTIs的ART方案[10]。在更新的美国CDC非职业性暴露后预防指南[17]和欧洲艾滋病临床协会(European AIDS Clinical Society,EACS)指南[18]中,RAL+TDF+FTC是怀孕或有生育能力的成人和青少年的优选方案。
EVG/COBI/TAF/FTC和EVG/COBI/TDF/FTC中增效剂COBI通过肝酶CYP3A4降解,导致了较多的药物相互作用;EVG本身耐药屏障低于DTG和BIC,在DHHS与EACS指南中降低了其推荐等级。
以DTG为基础的方案相比以EFV、DRV为基础的方案能更快地降低病毒载量,提升CD4+T细胞计数[19-20];且其耐药屏障高[21],病毒学失败风险低;与其他药物相互作用少。综合这些优势,2016年起各指南均将其列入首选的初治一线用药。DTG目前有单药制剂和阿巴卡韦(abacavir,ABC)/3TC/DTG复方单片制剂。后者在使用前应进行HLA-B*5701的筛查,以预测ABC相关超敏反应的发生风险。最近对DTG的关注集中于孕妇使用的安全性。博茨瓦纳的一项研究提示孕妇使用DTG可能会造成婴儿神经管畸形[22],进一步的研究正在进行中。WHO关于此问题发布的指南建议准备怀孕及怀孕8周内的妇女避免使用包含DTG的方案[23](DHHS则建议正在备孕及孕12周内妇女避免使用),初治者可使用以EFV为基础的方案,经治者根据耐药基因检测而做相应调整[11]。孕中期和孕晚期的患者可使用含DTG的方案(如DTG/TDF/3TC);如果产后不能持续有效避孕,则应换回以EFV为基础的方案。青春期女孩及有怀孕可能的妇女若近期不计划怀孕,则可在有持续、可靠避孕措施(包括口服避孕药,目前未发现激素类避孕药与DTG有明显相互作用)的情况下使用DTG。任何育龄期妇女使用DTG前均要做妊娠测试。DTG目前被批准用于年龄>6岁且体质量>15 kg的儿童。DTG与RAL交叉耐药较少,RAL治疗失败时可以试用包含DTG的方案[11]。加大DTG剂量至50 mg(2次/d)时对RAL耐药的患者可能有效[24-25]。在以NNRTIs为基础的初治方案失败人群中,多中心随机对照试验DAWNING比较了DTG和LPV/RTV作为第三种药物的有效性,治疗24~48周的结果均提示DTG的效果优于LPV/RTV,且总体不良反应发生率更低[26],因此在包含NNRTIs的初治方案失败后可考虑将DTG作为二线方案。
DHHS和EACS指南推荐的优选初治方案新近加入了BIC/TAF/FTC[11,18]。两项多中心随机对照研究分别对比了该方案与DTG/FTC/TAF方案、DTG/ABC/3TC方案的疗效,这两项研究结果显示48周内病毒载量得到有效抑制的患者比例分别为89.0%和93.0%以及92.4%和93.0%,差异属非劣效性,且该方案的药物相关不良反应更少[27-28]。BIC耐药屏障较高,在优化含有INSTIs、增效PIs的方案时可作为替代药物。由于BIC/TAF/FTC方案中不含有ABC,无须检测HLA*B5701,故在 诊断后同日启动治疗 这一策略中更有优势。须要注意的是BIC不能和利福平同用,合并肾功能受损患者须谨慎使用。目前无足够证据证明其在孕妇中的安全性,但与其结构相似的DTG对胎儿神经管发育有不良影响,故不推荐妊娠12周以内的孕妇及计划怀孕的妇女使用该方案。
1.4 蛋白酶抑制剂 PIs类药物种类较多,目前常用增效蛋白酶抑制剂(boosted-protease inhibitor,bPI)主要有LPV/RTV、DRV/COBI和DRV/RTV。以DRV为基础的四合一单片制剂(DRV/COBI/FTC/TAF),分别于2017年、2018年在欧洲及美国上市。这是近年来首个含bPI的四合一制剂,该药物的两项多中心随机对照试验AMBER和EMERALD分别显示了其在初治患者及已获得病毒学抑制患者中的有效性和安全性[29-30]。AMBER试验将未经ART的725例患者随机分为DRV/COBI/FTC/TAF组与DRV/COBI+FTC/TDF组,治疗48周时,病毒载量<50 拷贝/ml的患者比例分别为91.4%和88.4%,尿蛋白/肌酐比值下降幅度分别为22.42 mg/g和10.34 mg/g,腰椎、股骨颈和髋部的平均骨密度改变幅度分别为+0.26%和-2.97%,胆固醇/高密度脂蛋白比值中位数升高幅度为0.20和0.08。可见DRV/COBI/FTC/TAF对初治患者是有效和相对安全的。EMERALD试验入组了北美洲、欧洲9个国家1141例病毒抑制良好的患者(即维持HIV RNA<50 拷贝/ml至少2个月),其中15%的患者有非DRV方案治疗失败的经历。该研究采用与上述AMBER同样的分组方式,48周时控制组(DRV/COBI/FTC/TAF)与对照组(DRV/COBI+FTC/TDF)病毒反弹(HIV>50 拷贝/ml)率分别为2.5%和2.1%(属非劣效范围),2组严重不良事件发生率相近,胆固醇/高密度脂蛋白比值中位数升高幅度为0.20和0.10(差异有统计学意义但无临床意义)。因此,DRV/COBI/FTC/TAF是病毒学抑制患者可选择的换药方案。
须要注意的是,乙型肝炎及丙型肝炎患者使用DRV/COBI时可能出现严重的肝脏损害,须慎用。由于DRV含有磺胺基团,可能造成史-约综合征等严重的过敏反应,慎用于相关药物过敏者。LPV/RTV可导致心脏节律异常、胰腺炎等不良反应[2]。bPI可用于初治方案,也可用于调整初治方案。多项研究支持bPI与另一种敏感药物或多种部分敏感药物同时应用可有效降低初治失败患者的病毒载量[31-32]。因此,bPI是初治失败或耐药患者的主要选择药物。
1.5 融合抑制剂 FIs可阻碍病毒包膜与宿主细胞膜的融合,从而抑制病毒进入胞内。这类药物种类相对较少,临床上主要用于耐药患者,近年来该方面的研究进展主要体现在长效制剂的研发上。FIs以具有抗HIV融合活性的人类血浆白蛋白共轭肽(包括T20和C34)为基础[33]。恩夫韦肽即T20,为国际上该类第一个上市药物,由于该药化学性质为多肽,须皮下注射使用,可能会引起注射部位红肿、瘙痒或其他过敏反应,其半衰期在4 h左右,2次/d,皮下注射[34]。鉴于对该药疗效及安全性的考量,其并不被推荐作为初治患者用药[2]。我国自主研发的世界上首个长效FIs,即艾博卫泰(albuvirtide,ABT),于2018年6月在国内上市。ABT以C34为模板,经过修饰后增加了可溶性、稳定性和抗病毒活性。ABT进入血液后可与白蛋白共价结合,其半衰期长达11~12 d,达到稳定的血药浓度后可每周静脉滴注1次[33]。一项TALENT Ⅲ期临床试验评估了ABT与bPI组合构成的简化方案在一线治疗失败患者中的应用价值。该研究中一组患者予简化方案[ABT(静脉滴注,1次/周) +LPV/RTV(口服,2次/d)],另一组患者予三联药物口服(LPV/RTV+2NRTIs,2次/d)。治疗48周时,简化组与三联组患者治疗有效率(HIV RNA<50 拷贝/ml定义为有效)分别为80.4%和66.0%。2组患者不良事件发生率差异无统计学意义(分别为77.4%,70.7%),ABT组中并无严重的不良事件发生[35]。可见在二线治疗中ABT简化方案非劣效于LPV/RTV+2NRTIs方案,且耐受性良好。
1.6 CCR5抑制剂 近年来,CCR5抑制剂的研究进展缓慢,主要仍定位在耐药患者的治疗方面。CCR5抑制剂仅能对利用CCR5作为辅助受体的HIV有效,故在使用CCR5抑制剂前患者要做受体嗜性检测。目前该类药物仅有maraviroc,主要与骨干药物合用于经治耐药的患者[11]。两项支持其上市的MOTIVATE 1和MOTIVATE 2临床试验共入组了1049例经治多重耐药患者,这些患者被随机分配至安慰剂组、maraviroc组。治疗48周时maraviroc组患者的HIV载量平均降幅相比安慰剂组多0.9 log10/ml,CD4+T细胞平均增幅较安慰剂组多60 个/μl。除食道念珠菌病发生率更高外,maraviroc组中治疗相关的不良反应发生率与安慰剂组无显著差异[36-37]。在后期对初治患者的研究中,与2种NRTIs组合时,maraviroc的抗病毒效果并不优于NNRTIs,而与bPI组合为简化方案时其效果是否优于bPI+2NRTIs尚存在争议[38-40]。Maraviroc还有一定的免疫调节功能,可能有利于恢复因HIV感染而被破坏的调节性T细胞亚群结构[41],但在另一研究中使用maraviroc的患者CD4/CD8比值恢复率相对较低[42],可能不利于预后。CCR5抑制剂对初治患者的疗效和安全性未必优于目前的优选方案,因此尚未被推荐用于一线方案[42]。
1.7 CD4吸附后抑制剂 2018年3月美国FDA宣布首款CD4吸附后抑制剂ibalizumab(IBA)通过批准。该药适用于对多种药物耐药、现有药物控制不理想的经治患者。该药物为CD4的单克隆抗体,通过与CD4的结合阻止HIV进入细胞,且其与CD4的结合不影响主要组织相容性复合体Ⅱ类分子与CD4的结合[43]。在该药的Ⅲ期临床试验TMB-301中,40例经治患者接受IBA注射治疗(1次/2周),同时使用至少1种敏感药物,治疗24周时43%的患者HIV RNA拷贝数<50 拷贝/ml(并且在48周时仍保持该病毒载量水平),50%患者HIV RNA拷贝数<200 拷贝/ml。患者的不良反应大多为轻中度,如腹泻、眩晕、头痛、恶心、皮疹等,但有1例受试者因药物相关的免疫重建综合征死亡[44]。目前研究倾向于将IBA与其他药物联合使用,单药有较高耐药风险,因而不被推荐[45]。这类药物在临床应用中的价值尚须进一步研究。
1.8 其他药物 目前有众多正处在研发、试验阶段的新型抗HIV药物。一类为长效口服药物, 如 MK-8591、elsulfavirine 。MK-8591是 一 种正在进行临床试验的长效口服NRTIs,半衰期为78.5~128.0 h[46]。Elsulfavirine是 一种长效NNRTIs,在Ⅱ/Ⅲ期临床试验中其不良反应较EFV少[47]。第二类为中和抗体,如中国科学家研制的一种串联双特异性广泛中和抗体(bs-bnAb),在人源化的小鼠中能起到有效保护、治疗的作用[48]。第三类为长效注射制剂,如长效cabotegravir-rilpivirine注射剂[49]、长效DTG注射剂[50]。
2 抗病毒治疗方案
2.1 抗病毒治疗优选方案 近年来ART药物的研究进展推动了ART方案的优化,表1介绍了国际主要指南推荐的初治优选方案,其中以INSTIs为基础的方案占有较大比重。由于缺乏证明优越性的有力证据,FIs、CCR5拮抗剂及CD4吸附后抑制剂暂时不被推荐用于初治方案。而在优选方案中,各指南基本推荐以TAF/FTC和TDF/FTC为骨干药物选择,以INSTIs及bPI作为ART方案中第三种药物的选择。
2.2 简化治疗方案 随着对ART研究的深入,简化治疗方案引起了关注和重视。由于耐受性、不良反应等原因不能坚持三联治疗方案的患者,可根据情况采取简化治疗方案,但目前临床上并不推荐常规采用两联治疗方案。DHHS指南提供了几种可供选择的双药简化方案:DTG+3TC(中等级推荐);DRV/RTV+RAL(低等级推荐,仅在HIV RNA<100 000 拷贝/ml且 CD4+T细胞计数>200 个/μl时应用);DRV/RTV+3TC(低等级推荐,证据来自小规模临床试验,尚需更多数据支持)[2]。另外,如上所述,ABT+LPV/RTV也可作为简化方案的一种选择。目前简化治疗方案主要用于病毒学得到抑制或不能耐受首选方案的患者,尽管有些两联方案如DTG+3TC已经显示出在初治患者中的价值,但是临床上并不常规推荐作为初治患者的首选方案。
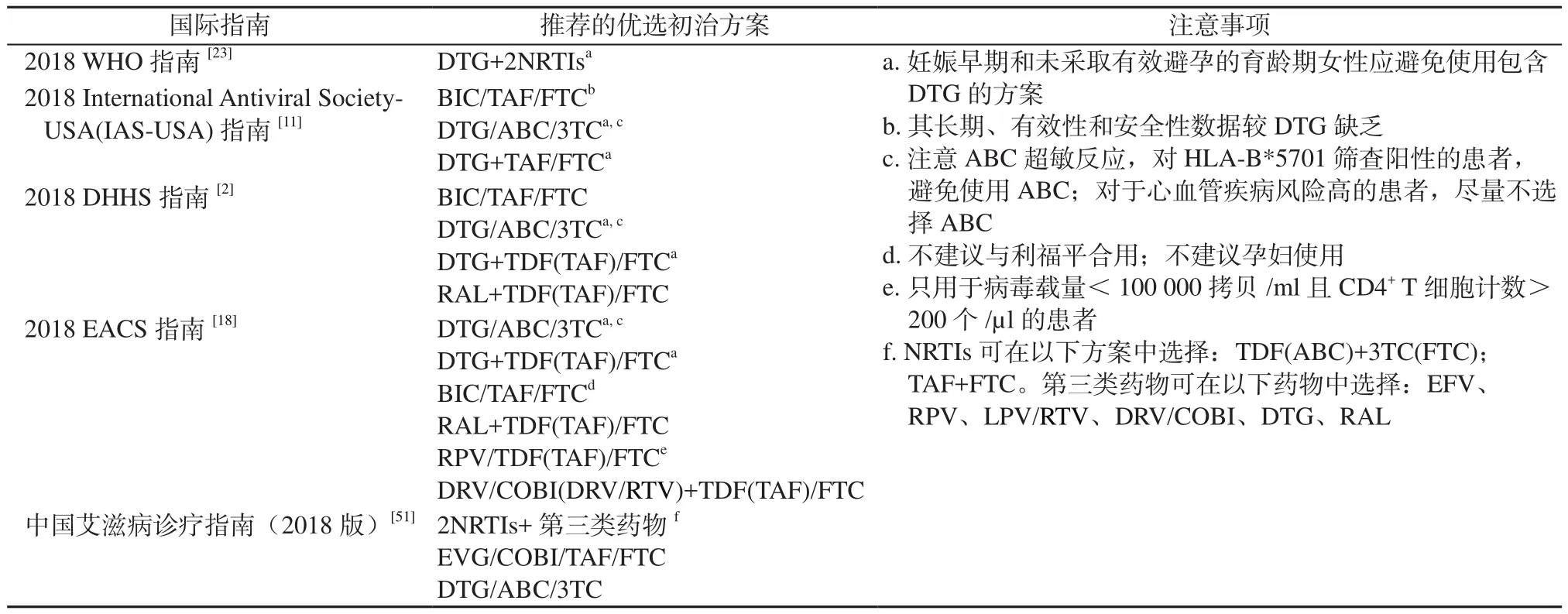
表1 国际指南推荐的初治优选方案Table 1 Initial optimal treatment regimen recommended by international guideline
3 结 语
ART的目标不仅仅是改善患者预后,还要提高患者生存质量。ART的研究进展为实现这些目标提供了更大可能。近年来ART的研究进展主要体现在新型、高效、低毒、服用方便、耐药屏障高的药物的出现和新作用机制的药物的研发以及ART方案的优化和简化方面。在推荐的优选ART方案中,各指南基本推荐以TAF/FTC和TDF/FTC为骨干药物选择,以INSTIs及bPI作为ART方案中的第三种药物的选择;而单片复合制剂和长效制剂的应用体现了ART的发展方向。

