血流储备分数评估颈动脉狭窄介入治疗的可行性研究
陈靖 徐宗良 李军荣 李圣华 余艳华 沈鑫 陈季南 陈来明
颈动脉粥样硬化所致管腔狭窄与发生卒中密切相关,是缺血性卒中重要的危险因素[1-2]。研究表明,约1/4的卒中归因于颈内动脉颈段狭窄和闭塞引起的缺血性事件[3]。既往研究证实,血管解剖狭窄程度是颈动脉介入治疗的判断依据[4-5],且颈动脉球囊扩张和血管支架置入术更符合中国的国情[6]。然而,近年来通过脑血管造影检查评价脑动脉狭窄程度的不足逐步被认识,单纯的解剖改变不能准确反映生理及功能改变。脑血管造影常不能明确脑动脉病变的性质,经常低估或高估相关病变的严重程度。研究显示,血流动力学、侧支循环及斑块特征是卒中复发的重要影响因素[7-10]。
1993年,Pijls等[11]提出了通过测定冠状动脉压力推算冠状动脉血流的新指标——血流储备分数(fractional flow reserve,FFR) 。冠状动脉研究结果显示,FFR指导经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)组疗效显著优于血管造影指导的PCI组,病死率、心肌梗死及再次冠状动脉介入诊疗发生率均低于血管造影指导的PCI组[12-13]。越来越多的研究结果支持FFR对评估狭窄冠状动脉血流情况更加准确可靠[14-15],且有研究应用FFR评估来指导肾动脉的血管内治疗[16]。目前,FFR被广泛应用冠状动脉,但应用FFR评估脑动脉的相关研究报道较少,且冠状动脉系统与脑血管系统的解剖及生理存在差异,因此有必要评价FFR在脑血管疾病中的作用。本研究监测颈动脉支架治疗前后FFR及跨病变压差的改变情况,探讨应用FFR指导颈动脉狭窄介入治疗的可行性及安全性。
1 对象与方法
1.1 对象
回顾性连续纳入自2015年1月至2016年6月于南京医科大学附属江宁医院神经内科住院行狭窄动脉支架置入术的30例症状性颈动脉严重狭窄患者,均经脑血管DSA检查明确诊断。30例中,男19例,女11例;年龄38~76岁,平均(61±5)岁;合并高血压病21例,糖尿病16例,高脂血症23例,高同型半胱氨酸血症13例,冠状动脉粥样硬化性心脏病8例;症状表现:脑梗死25例,短暂性脑缺血发作5例;血管狭窄部位:颈内动脉C1段26例,颈总动脉4例。本研究方案经本院伦理委员会同意,所有患者知情告知,并签署了手术治疗知情同意书。
纳入标准:年龄≥18岁;行脑血管造影术检查明确颈动脉严重狭窄(管腔狭窄率≥70%)的首发脑梗死或短暂性脑缺血发作患者,且确认狭窄血管为责任血管,头部MRI或CT支持脑梗死诊断。排除标准:有脑血管造影术及颈动脉支架置入术禁忌证的患者;严重的心、肝、肾功能不全者;妊娠者;无法合作者。
1.2 方法
1.2.1资料收集:收集患者的人口学资料(如年龄、性别等)、临床资料(如血管危险因素、症状体征、影像学检查结果、治疗方法及治疗结果、随访情况等)。
根据既往文献资料,对于常见危险因素采用常见的诊断标准[17]。高血压病定义为既往高血压病史或多次不同日测量血压≥140/90 mmHg。糖尿病定义为既往糖尿病病史或多次不同日测量空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L。高同型半胱氨酸血症为血同型半胱氨酸>15.0 μmol/L。高脂血症定义为胆固醇>6.2 mmol/L或三酰甘油>2.3 mmol/L或高密度脂蛋白<1.0 mmol/L或低密度脂蛋白>4.1 mmol/L[18]。
1.2.2影像学检查: 30例患者行头颈部MRI及MR血管成像(MRA)或 CT血管成像(CTA)检查,且脑血管造影显示颈动脉狭窄率≥70%。颈动脉狭窄程度分级方法参照北美症状性颈动脉内膜剥脱术试验(North American Symptomatic Carotid Endarterectomy Trial,NASCET)标准,狭窄程度计算公式:(1-颈动脉最窄处直径/狭窄病变远端正常颈内动脉直径)×100%,轻度狭窄为狭窄率0%~29%,中度狭窄为狭窄率30%~69%,重度狭窄为狭窄率70%~99%[4]。采用美国介入治疗神经放射学学会(American Society of Interventional and Therapeutic Neuroradiology,ASITN)/介入放射学学会(Society of Interventional Radiology,SIR)侧支循环血流进行分级评估[19],共分为5级,0级:无侧支血流到缺血区域;1级:缓慢的侧支血流到缺血周边区域,伴持续的灌注缺陷;2级:快速的侧支血流到缺血周边区域,伴持续的灌注缺陷,仅有部分到缺血区域;3级:静脉晚期可见缓慢但是完全的血流到缺血区域;4级:通过逆行灌注,血流快速而完全地灌注到整个缺血区域。
1.2.3FFR测定方法及血管内治疗:在脑血管造影后,根据颈动脉狭窄程度及侧支循环情况,结合患者的临床情况,决定是否需行颈动脉血管内介入治疗,包括球囊扩张手术和自膨式支架置入术等方法,并在介入治疗中完成术前及术后FFR及跨病变压力差的测定。手术时间:对于大范围脑梗死患者,2周后实行颈动脉球囊扩张和血管支架置入术治疗。对于短暂性脑缺血发作、小卒中、非致残性卒中,2周内行手术。手术前给予氯吡格雷75 mg和阿司匹林100 mg联合治疗至少5 d。0.014英寸(0.036 cm)的压力导丝通过距离其头端3 cm处的一个微小压力感受器进行压力测定。压力感受器通过6 F指引导管输送到主动脉内校正。再将0.014英寸(0.036 cm)压力导丝由6 F指引导管推送至颈总动脉开口近端的主动脉内,将经6 F指引导管测定的压力与经压力导丝测定的压力校正一致,然后推送压力导丝通过狭窄血管处至该血管远端,至少超过病变2 cm,始终保持压力导丝顶端在血管腔中间,不可触碰血管壁。此时,通过压力导丝测定狭窄血管远端的平均压力,通过6 F指引导管测定主动脉内压力,计算出FFR即为上述所测得的两压力的比值(远端压力/近端压力比率,即pd/pa),及跨病变压差(近端压力-远端压力,即pa-pd)。在血管介入治疗后,再次在相同的位置测定术后FFR及跨病变压差。FFR测定的不良反应包括:测定时导丝穿破血管壁引起脑出血或引起的动脉夹层。手术后尽可能立即进行头部CT检查,排除颅内出血情况。
1.3 统计学分析
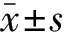
2 结果
30例患者均成功通过狭窄,并完成FFR及跨病变压差的测定。术后血管狭窄率和跨病变压差明显低于术前,FFR明显高于术前,差异均有统计学意义(均P<0.01),见表1。术前血管狭窄率与FFR、跨病变压差明显相关(r值分别为-0.86、0.96,均P<0.01),见图1、图2。使用压力导丝测定FFR、跨病变压差时,均未出现血管刺通破裂引起脑出血及血管夹层。

表1 30例症状性颈动脉严重狭窄患者狭窄动脉支架
注:FFR为血流储备分数

3 讨论
颈动脉粥样硬化所致的管腔狭窄与卒中的发生密切相关,是缺血性卒中重要的危险因素[1-2]。颈动脉狭窄所致的卒中大部分归因于栓塞和血栓形成,小部分归因于低灌注。因此对颈动脉狭窄的患者应着重关注的是降低血栓脱落风险和防止动脉粥样硬化部位血栓形成。血管内介入治疗主要目标是预防卒中。既往研究确定了血管解剖狭窄在颈动脉介入治疗的地位,脑血管造影检查成为颈动脉狭窄诊断的“金标准”,参考NASCET法计算动脉狭窄。根据2015年中国指南推荐意见:(1)对症状性颈动脉狭窄率70%~99%的患者,可考虑行颈内动脉内膜切除术或颈动脉球囊扩张和血管支架置入术治疗(Ⅰ级证据)[3]。
单纯血管狭窄仅能评价血管的解剖学改变,只能对病变血管的狭窄程度进行影像学评价,而不能准确反映该动脉血流,并不能反映出狭窄血管对远端组织的灌注情况。对于颅内血管狭窄,计算机流体动力学分析显示,管腔狭窄率70%以上患者中仅40%出现明显的血流动力学改变[20]。既往冠状动脉研究结果显示,FFR测量较管腔狭窄更能反映狭窄后区域灌注的情况[21],且有研究显示,跨狭窄压力差较解剖狭窄能更好反映肾动脉功能狭窄[16]。FFR不仅对病变冠状动脉进行有效诊断,且已经指导冠状动脉的PCI治疗。但是目前应用FFR评估脑动脉研究较少,缺少FFR在脑血管系统的基础研究。由于安全性及伦理学,不能简单地依据冠状动脉研究成果来进行FFR指导颈动脉狭窄支架治疗,应对根据动脉狭窄程度行颈动脉支架置入术患者监测治疗前后FFR及跨病变压差改变情况,探讨颈动脉狭窄程度是否与FFR及跨病变压差改变相关,从而探讨采用FFR指导颈动脉狭窄支架置入治疗的可能性及安全性。本研究结果显示,术前血管狭窄率与FFR、跨病变压差明显相关,且测定FFR、跨病病压差时均未出现血管刺通破裂引起脑出血及血管夹层,提示FFR有可能指导颈动脉狭窄支架治疗。
鉴于脑血管与冠状动脉的血管壁、血流调节及侧支循环不同,不能直接将冠状动脉研究成果应用于脑血管病。本研究仅评价使用压力导丝测定FFR的方法评价脑血管狭窄的可能性,而不是确定使用FFR指导脑血管病的诊治标准,仍需大量的基础及临床研究数据确定FFR在缺血性脑血管病的诊疗价值。
——导丝概述及导丝通过病变技巧

