高度近视糖尿病豚鼠视网膜中骨桥蛋白及整合素αvβ3受体的表达
胡凌飞,李晨皓,梅立新,吴昌凡
(1.皖南医学院第一附属医院 弋矶山医院 眼科,安徽 芜湖 241001;2.芜湖市眼科医院 眼科,安徽 芜湖 241002)
糖尿病视网膜病变(diabetes retinopathy,DR)是糖尿病最为常见和严重的微血管并发症,是主要的致盲眼病之一[1]。现有研究表明高度近视与糖尿病视网膜病变的程度和分期有负关联[2],目前尚无确切机制解释。有研究表明骨桥蛋白(Osteopontin,OPN)同整合素αvβ3受体相结合形成的黏附蛋白分子与糖尿病视网膜新生血管增生具有正相关性[3],本项研究为验证两者表达是否与高度近视对DR进展的影响机制有关联。
1 材料与方法
1.1 实验动物与分组 实验以1周龄英国种健康单色雄性豚鼠(体质量100~250g)为实验动物,共90只,按标准动物实验室条件饲养。随机数字表法随机分为4组,分别为Ⅰ组(正常对照组)、Ⅱ组[高度近视组(形觉剥夺性)]、Ⅲ组(患有糖尿病组)和Ⅳ组(高度近视合并糖尿病组)。设18只正常对照组,其他实验组均为24只。造模于适应性喂养1周后开始。
1.2 建立动物模型方法
1.2.1 正常对照组 常规实验室条件饲养8周,左下腹腔注射柠檬酸-柠檬酸钠缓冲液(0.1 mmol/L,pH 4.4,280 mg/kg),建立空白对照。
1.2.2 高度近视造模方法 Ⅱ组和Ⅳ组以半透明眼罩遮盖右眼(10英寸清洁不透明气球)8周后,散瞳验光(复方托吡卡胺滴眼液,带状光检影法),屈光度≥-6.00 D为成模标准,Ⅱ组豚鼠左下腹腔注射柠檬酸-柠檬酸钠缓冲液(0.1 mmol/L,pH 4.4,280 mg/kg),观察20周。
1.2.3 糖尿病造模方法 Ⅲ组、Ⅳ组糖尿病造模待Ⅳ组高度近视模型形成后建立,左下腹腔注射5% 链脲佐菌素(streptozotocin,STZ)溶液280 mg/kg 3 d后,禁食禁水10 h,经针刺耳缘静脉采血测定空腹血糖,空腹血糖≥16.5 mmol/L为糖尿病成模标准,观察20周。
1.3 眼球标本制作 所有试验豚鼠完成空腹血糖测定、散瞳验光后,取各组豚鼠右眼眼球标本,应用心尖部穿刺体循环灌注固定法快速进行。完成后即行眼轴长度测量3次取平均值。眼球组织固定7 d后取出(4%多聚甲醛固定液),沿视神经方向经视神经切开眼球,取出晶状体,切面朝下,脱水、媒浸、包埋、切片(厚度为4 μm)。完成若干张连续切取,并选择连续3张,在载玻片上铺展,分别行整合素αvβ3受体、OPN免疫组化染色及HE染色,完成区别标记。
1.4 切片观察方法 使用Image Pro Plus 6.0 显微镜成像计算机采集分析系统完成图像采集。视网膜组织形态,细胞排列及数目应用HE 染色,整合素αvβ3受体、OPN阳性表达情况应用免疫组化切片观察。两者均在神经节细胞层呈胞浆表达为淡黄至棕黄色颗粒。OPN、整合素αvβ3受体阳性表达率计算:随机观察每张免疫组化切片5个高倍镜(10×40 倍)视野,记录并计算视野内阳性细胞总数占总细胞数的比值。阳性细胞率 0%、l%~20%、21%~50%、大于51%分别代表阴性(-)、弱阳性(+)、阳性()、强阳性()。
1.5 统计学分析 应用SPSS 18.0软件完成统计学分析。造模后各组的屈光度、眼轴长度、空腹血糖以均数±标准差表示,总体差异比较采用单因素方差分析,组间两两比较采用q检验;各组视网膜中OPN、整合素αvβ3受体阳性表达率以中位数和四分位数间距表示,总体差异、组间两两比较采用Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
2 结果
Ⅰ组豚鼠存活率100%;Ⅱ组豚鼠的存活率100%,造模成功率为91.7%;Ⅲ组豚鼠存活率83.3%,造模成功率为83.3%;Ⅳ组豚鼠存活率为79.2%,造模成功率75%。各组随机抽取18只成模豚鼠为研究对象。造模后各组豚鼠屈光度、眼轴长度、空腹血糖比较见表1,其中无近视组(Ⅰ、Ⅲ组)较高度近视组(Ⅱ、Ⅳ组)屈光度值低,眼轴长度短,差异均有统计学意义(P<0.05);无糖尿病组(Ⅰ、Ⅱ组)空腹血糖值比糖尿病组(Ⅲ、Ⅳ组)低,差异有统计学意义(P<0.05)。
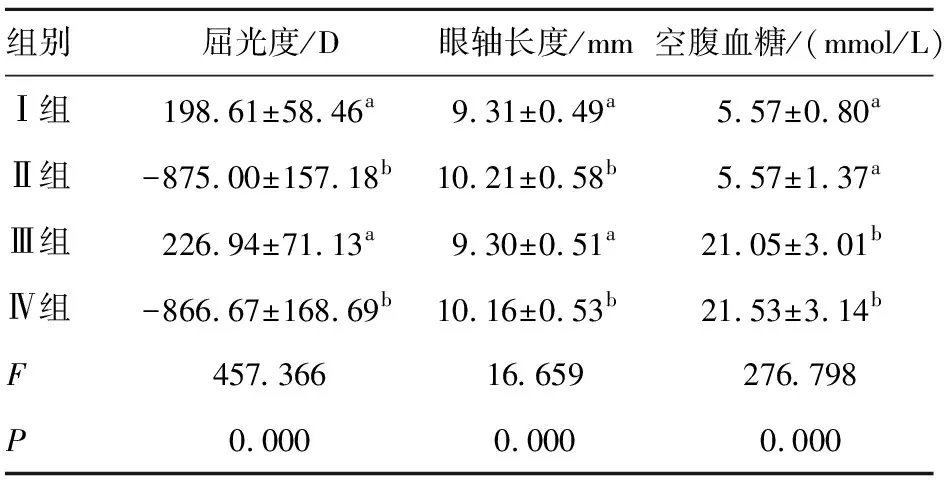
表1 造模后各组豚鼠屈光度、眼轴长度及空腹血糖(n=18)
注:多组间两两比较,字母不同表示P<0.05。
2.1 HE染色切片观察 Ⅰ组视网膜各层组织厚度及细胞的形态、数量均正常,细胞核呈蓝色,胞质呈红色,神经节细胞排列整齐;Ⅱ组视网膜细胞排列紊乱,视网膜各层尤其是神经节细胞层变薄;Ⅲ组视网膜组织形态疏松,细胞数目少,排列错乱,可见视网膜微动脉瘤、少量小动脉栓塞及静脉血栓,提示该组豚鼠发生了糖尿病视网膜病变;Ⅳ组视网膜组织变薄、疏松,且排列紊乱,可见少量微动脉瘤,提示发生糖尿病视网膜病变但较Ⅲ组细胞破坏轻。
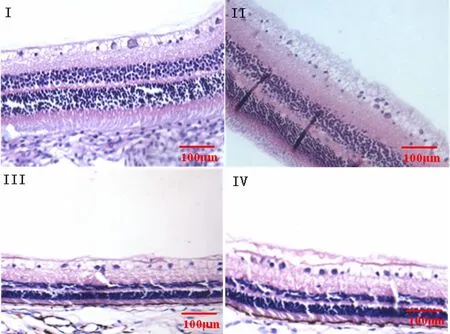
图1 各组豚鼠视网膜组织病理学改变(EnVISION×200)
2.2 免疫组化染色 结果显示,糖尿病组(Ⅲ、Ⅳ组)OPN、整合素αvβ3受体的表达水平较无糖尿病组(Ⅰ、Ⅱ组)增高,差异有统计学意义(P<0.05);在Ⅰ、Ⅱ组之间差异无统计学意义(P>0.05);Ⅳ组OPN、整合素αvβ3受体的表达水平较Ⅲ组降低,差异有统计学意义(P<0.05)。见表2。
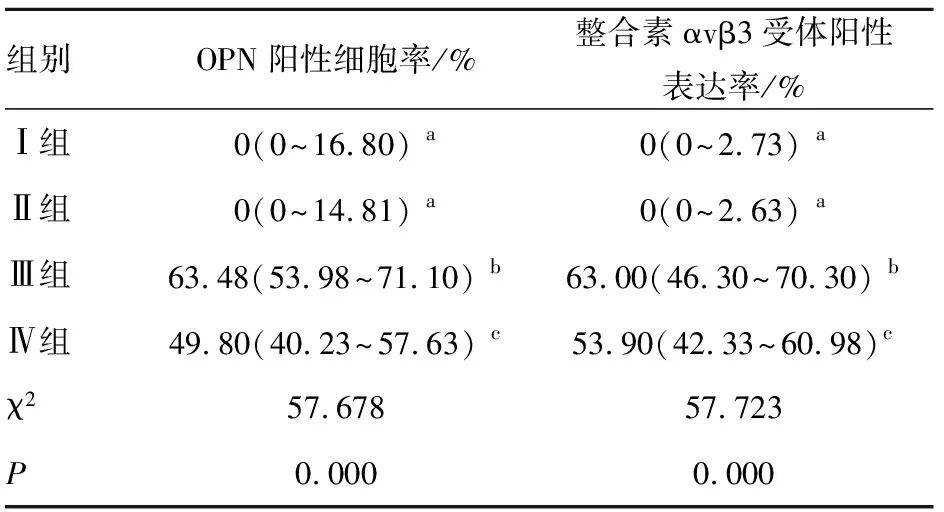
表2 各组豚鼠视网膜组织中OPN、整合素αvβ3受体的阳性表达率比较(中位数和四分位数间距)
注:多组间两两比较,字母不同表示P<0.05。
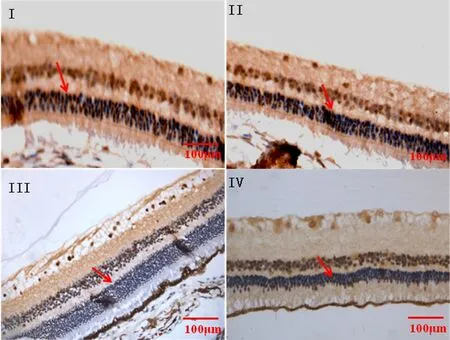
图2 各组豚鼠视网膜 OPN 免疫组化染色 (EnVISION×200)
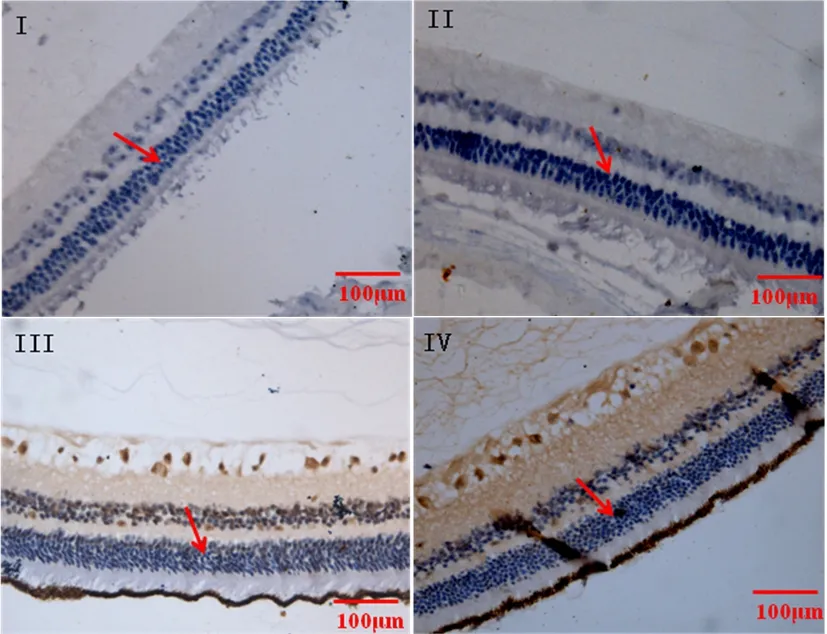
图3 各组豚鼠视网膜整合素αvβ3受体免疫组化染色 (EnVISION×200)
3 讨论
DR是糖尿病常见且严重的微血管并发症之一,是由多种细胞因子、多途径共同作用,导致视网膜新生血管形成及血-视网膜屏障破坏,引起玻璃体视网膜增生性改变,最终使糖尿病患者视力丧失。故抑制促新生血管形成因子的表达,使血管内皮损伤机制受阻,可望带来糖尿病治疗的新希望。目前掌握大量的实验证据表明,OPN及整合素αvβ3受体在视网膜缺血缺氧状态下产生视网膜新生血管的过程中发挥重要作用[4]。
OPN是一种增生相关蛋白,广泛分布于人体组织中,在炎症、肺结核、肿瘤的研究中均有表明,在新生血管形成、增生改变过程中均有OPN诱发作用[5]。有研究指出,血管内皮细胞通过OPN介导,与细胞外基质相互作用后分化、增殖,加速新生血管形成[6]。有学者研究结果推测增生性玻璃体视网膜病变的血管增生性改变机制与升高的OPN浓度存在相关性。在糖尿病视网病变增殖期患者玻璃体腔内,OPN可具有相似的浓度升高过程[7]。OPN同整合素受体家族有效的结合是其生物学作用有效发挥的基础,OPN和整合素αvβ3受体是一组相结合的黏附蛋白分子,两者为配体与受体的关系,在新生血管形成过程中有协同功能。整合素可作为新生血管的标志,其高表达可用来衡量侵袭性疾病和增生性疾病在治疗过程中评价恶化的标准。本文研究结果显示OPN及整合素αvβ3受体在糖尿病组(Ⅲ、Ⅳ组)豚鼠的表达水平比血糖正常组(Ⅰ、Ⅱ组)高,且差异均有统计学意义(P<0.05),与其他学者研究结果一致。
近年来发现高度近视与DR的程度及分期有负关联,近视、眼轴长的患者DR的发生率低,近视程度越高,DR病变程度越轻,尤其是危及视力的重度DR发生率更低[8]。提示近视度数高或眼轴长可能是DR的保护因素,已发现机制有:各种血管损伤因子和冲击损伤因血流量降低而减少,视网膜细胞透氧环境因巩膜变薄而得以改善,新生血管数量在玻璃体液化、后脱离后会降低[9-10]。但目前具体机制的诠释尚未统一。此次研究中,糖尿病合并高度近视组豚鼠视网膜中OPN和整合素αvβ3受体阳性表达率均比糖尿病组低(P<0.05),观察各组豚鼠视网膜形态,糖尿病组视网膜破坏也比糖尿病合并高度近视组明显。由此推测,OPN与整合素αvβ3受体结合后的协同促进增生作用同新生血管增殖损伤具有相关性,降低视网膜组织破坏程度可通过抑制两者表达来实现。
通过本研究推测高度近视对糖尿病视网膜病变进展的阻滞可能是通过下调视网膜内OPN和整合素αvβ3受体的表达。但具体调节机制尚不清楚,有待进一步研究探讨。

