亚硫酸钠浸泡预处理对脱水蒜片主要品质指标的影响
张静林,陶 阳,韩永斌,*,叶晓松,叶明儒,邬 超,叶淑娴
(1.南京农业大学食品科技学院,江苏 南京 210095;2.镇江市智海食品有限公司,江苏 镇江 212000)
大蒜(Allium sativum L.)是百合科葱属植物蒜的鳞茎[1]。它不仅是日常生活中重要的调味品,也具有很高的药用价值。约公元前1550年,就有古埃及人利用大蒜进行疾病治疗的记载[2-3]。我国著名医典《本草纲目》中详细描写了大蒜具有归五脏、散痈肿疮、除风邪、杀毒作用[4]。大蒜所具有的生理活性性主要源于其在加工过程中形成的系列有机硫化物,其所含皂苷、维生素、多糖、酚类物质等成分也具有一定的生理活性[5]。研究表明,大蒜含有的蒜烯和大蒜素等烃基硫代亚磺酸酯具有较强抗病毒活性[6];蒜素及蒜素分解所生成的硫醚类化合物在癌变早期和晚期阶段可起到抑制作用[7];Kim等[8]研究发现大蒜匀浆与不同比例水或油混合其抗氧化活性均增强,其中大蒜与油的混合物中油层的抗氧化活性最强;蒜中蒜氨酸、蒜素、二烯丙基二硫化物、二烯丙基三硫化物等硫化物为大蒜精油抗血小板凝集的主要活性成分[9]。新鲜大蒜休眠期短,易发芽霉变,不耐贮藏,故常被加工为醋腌大蒜、脱水蒜片/粉等,其中由于干制品具有体积小,耐贮藏,易于运输等优点而备受青睐。
蒜片在干制过程中会发生一定程度的褐变,工业生产中常会采用亚硫酸盐等护色剂进行浸泡前处理,在浸泡过程中,亚硫酸盐可以有效的抑制相关酶的活性,其释放的SO2可以把醌还原为酚,再与羰基发生加成反应,从而阻止了羰基化合物的聚合控制了褐变反应,使产品具有较好的色泽[10-11],然而过量使用亚硫酸盐会使产品中SO2的残留量过高,从而危害人体健康。目前,工业生产脱水蒜片时,常会采用亚硫酸盐溶液对蒜片进行浸泡预处理,获取具有良好色泽的脱水蒜片,然而鲜见有文献报道,亚硫酸盐的浸泡处理在维持蒜片色泽的同时,对脱水蒜片的主要品质可能造成一定程度的影响。大蒜自身含硫物质较多,并且在其生长过程中可吸收无机硫如SO42-及SO32-合成半胱氨酸,半胱氨酸经系列反应合成蒜氨酸,即为大蒜中功能性成分硫代亚磺酸酯的前体[12-14],因此大蒜自身存在无机硫的成分,使得未经亚硫酸钠溶液浸泡的脱水蒜片测得的SO2残留量不为零。本实验采用不同条件亚硫酸钠溶液浸泡切片后的鲜蒜,旨在考察不同条件亚硫酸盐溶液的浸泡处理,研究对干制所得脱水蒜片色泽、硫代亚磺酸酯含量、SO2残留量、体外抗氧化活性及复水比造成的影响。
1 材料与方法
1.1 材料与试剂
白皮四六瓣大蒜,于6月中旬采自江苏省徐州市邳州市大蒜基地。
L-半胱氨酸、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB) 上海瑞永生物科技有限公司;亚铁氰化钾(分析纯) 国药集团化学试剂有限公司;乙酸锌(分析纯)、盐酸副品红 上海麦克林生化科技有限公司;2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS);三吡啶基三嗪(2,4,6-tris(2-pyridyl)-S-triazine,TPTZ) 美国Sigma公司。
1.2 仪器与设备
UV-2802型紫外-可见扫描分光光度计 美国优尼柯公司;CR-400色差计 日本柯尼卡美能达公司;DHG-9030A型鼓风干燥箱 上海一恒科技有限公司。
1.3 方法
1.3.1 单因素试验
分别称取25 g切片厚度为3 mm及5 mm蒜片,在20、30、40、50 ℃条件下,浸泡于50 mL pH 7.45,质量浓度为500 mg/L亚硫酸钠溶液中,浸泡时间为 30 min,完成浸泡后,50 ℃烘干至水分质量分数低于8%,考察浸泡温度对不同厚度脱水蒜片品质影响。
分别称取25 g切片厚度为3 mm及5 mm蒜片,在20 ℃条件下,浸泡于50 mL质量浓度为0、100、250、500、750、1 000 mg/L亚硫酸钠溶液中,pH值范围约为7.00~8.14,浸泡时间为30 min,完成浸泡后,50 ℃烘干至水分质量分数低于8%,考察浸泡质量浓度对脱水蒜片品质影响。
分别称取25 g切片厚度为3 mm及5 mm蒜片,在20 ℃条件下,浸泡于50 mL pH 7.45,质量浓度为500 mg/L亚硫酸钠溶液中,浸泡时间为0、15、30、45、60 min,完成浸泡后,50 ℃烘干至水分质量分数低于8%,考察浸泡时间对脱水蒜片品质影响。
1.3.2 指标测定
1.3.2.1 色泽
脱水后的蒜片粉碎后用色差仪进行色泽测定。以仪器白板色泽为标准,依CIELAB表色系统测量样品的L*、a*和b*值。其中L*、a*和b*分别代表试样的明度、红绿度和黄蓝度(L*为0表示黑色,L*为100表示白色。+a*偏红、-a*偏绿,值越大表示偏向越严重;+b*偏黄、-b*偏蓝)。

1.3.2.2 硫代亚磺酸酯含量
采用DTNB法,参考文献[15]和[16]。将干燥后的蒜片粉碎成蒜粉。精确称取蒜粉0.3 g于试管中,加入7.5 mL去离子水,在旋涡式混合器中充分混合1 min,静置9 min,离心后取上清液1 mL,加入10 mmol/L左右的半胱氨酸溶液5 mL,保温15 min后,取1 mL反应混合液于100 mL容量瓶中,加水至刻度。取稀释100 倍的反应混合液4.5 mL与1.5 mmol/L DTNB溶液0.5 mL在26 ℃保温15 min后,在412 nm波长处测定其吸光度(A)。
取10 mmol/L左右的半胱氨酸溶液5 mL,加1 mL去离子水,摇匀后取1 mL于100 mL容量瓶中,加水至刻度。取稀释100 倍的半胱氨酸溶液4.5 mL与1.5 mmol/L DTNB溶液0.5 mL在26 ℃保温15 min后,在412 nm波长处测定其初始吸光度(A0)。硫代亚磺酸酯计算公式如下:
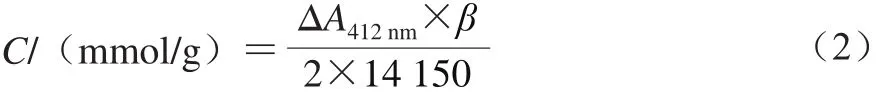
式中:C为硫代亚磺酸酯含量/(mmol/g);β为稀释倍数;14 150为2-硝基-5-硫代苯甲酸在412 nm波长处的摩尔消光系数(1 cm的光径)。
1.3.2.3 SO2残留量
采用盐酸副玫瑰苯胺比色法,参考GB 5009.34—2016《食品中亚硫酸盐的测定》及文献[17]。将蒜片粉碎成蒜粉,称取5.00 g样品于100 mL容量瓶中,加入20 mL EDTA-2Na工作液,超声提取90 min,然后加入亚铁氰化钾溶液及乙酸锌溶液各2.5 mL,定容至100 mL,摇匀过滤即为提取液。取5 mL提取液加入5 mL EDTA-2Na工作液,0.5 mL 0.3%氨基磺酸铵溶液,开盖放置 5 min,加入1 mL 1 mol/L NaOH溶液及0.5 mL 0.025%盐酸副玫瑰苯胺溶液,混匀室温静置20 min,测定吸光度。
1.3.2.4 抗氧化活性
ABTS自由基清除能力测定参照文献[18]。将7 mmol/L ABTS自由基、2.45 mmol/L过硫酸钾等体积混合,避光静置16 h后,用pH 7.4(0.2 mol/L)磷酸缓冲液稀释至0.70±0.02制得ABTS工作液。取0.2 mL蒸馏水+3.8 mL ABTS工作液,30 ℃避光水浴6 min,测定734 nm波长处吸光度,得到空白A空白;0.2 mL样品+3.8 mL ABTS工作液,30 ℃避光水浴6 min,测定734 nm波长处吸光度,得到A样品。按式(3)计算抑制率:

将抑菌率带入标准曲线y=0.462 4x-0.006,R2=0.998 4(其中y为抑制率,x为浓度/(mmol/L))。
铁离子还原能力(Ferricion reducing antioxidant power,FRAP)测定参照文献[19]的方法。10 mL 10 mmol/L FRAP(40 mmol/L HCl溶液)、10 mL 10 mmol/L FRAP 0.3 mol/L和100 mL乙酸盐缓冲液(pH 3.6)混合后37 ℃避光水浴1 h,得FRAP工作液。取3 mL FRAP工作液+0.3 mL去离子水+0.1 mL样品37 ℃避光水浴,A593 nm波长处测定吸光度。标准曲线:y=6.260 8x+0.000 9,R2=0.999 5,y为吸光度,x为Fe2+浓度/(μmol/L)。
1.3.2.5 复水比
将5 g脱水蒜片加适量蒸馏水(50 mL左右),常温放置1 h,用滤纸过滤,将滤渣留下,并滤纸吸干其表面自由水分,在电子天平上,称出复水后的蒜片质量,每组样品做3 组平行,取平均值。复水沥干后的质量mf和干蒜片原有质量之比(Rf)即为复水比[20],计算如式(4)所示:

式中:mf为复水沥干后的质量/g;mg为产品原有质量/g。
1.4 数据处理与统计分析
实验设置3 个重复,3 个平行,实验数据采用Excel和SPSS统计软件进行显著性检验,P<0.05。
2 结果与分析
2.1 脱水蒜片色泽变化

表1 亚硫酸钠浸泡温度对脱水蒜片色泽的影响Table 1 Effect of soaking temperature on color of dehydrated garlic slices
由表1可以看出,在不同温度条件下进行亚硫酸钠浸泡时,脱水蒜片的L*及a*值均无显著变化,而b*值则随浸泡温度上升略有升高,蒜片的色泽会略有偏黄。切片厚度为3 mm时,40 ℃条件下蒜片ΔE*值最大,说明此时脱水蒜片的色泽较20 ℃浸泡条件所得脱水蒜片颜色差别最大;切片厚度为5 mm时ΔE*值均较小,说明浸泡温度低于50 ℃时不同浸泡温度对于脱水蒜片色泽影响较小。大蒜汁呈弱酸性[21],因此将蒜片浸入亚硫酸钠溶液时,蒜中酸性物质可以促进亚硫酸钠溶液中SO2的产生,从而达到良好的护色效果。

表2 亚硫酸钠浸泡质量浓度对脱水蒜片色泽的影响Table 2 Effect of sodium sulfite concentration on color of dehydrated garlic slices
由表2可以看出,当蒜片切片厚度为3 mm时,与对照组相比,随着亚硫酸钠浸泡溶液质量浓度的上升,蒜片的L*值呈上升趋势,浸泡溶液质量浓度越大,蒜片色泽越白。a*值无显著性差异,b*值均较空白组略有上升,ΔE*值整体也呈现上升趋势,这与李静[22]研究中亚硫酸钠对魔芋护色效果的影响相似;当蒜片的切片厚度为5 mm时,随着亚硫酸钠溶液质量浓度上升,干燥所得脱水蒜片的L*值略有上升,但组间并无显著差异,a*值略有上升,b*值也呈上升趋势,ΔE*变化较小,说明在切片厚度为5 mm条件下,浸泡质量浓度对于脱水蒜片色泽保护能力较弱,影响较小。亚硫酸钠溶液的护色效果取决于有效SO2的含量,因此随溶液质量浓度的上升护色效果会增强。综上所述,当切片厚度为3 mm时,亚硫酸钠质量浓度的升高更有利于脱水蒜片色泽品质的维持。
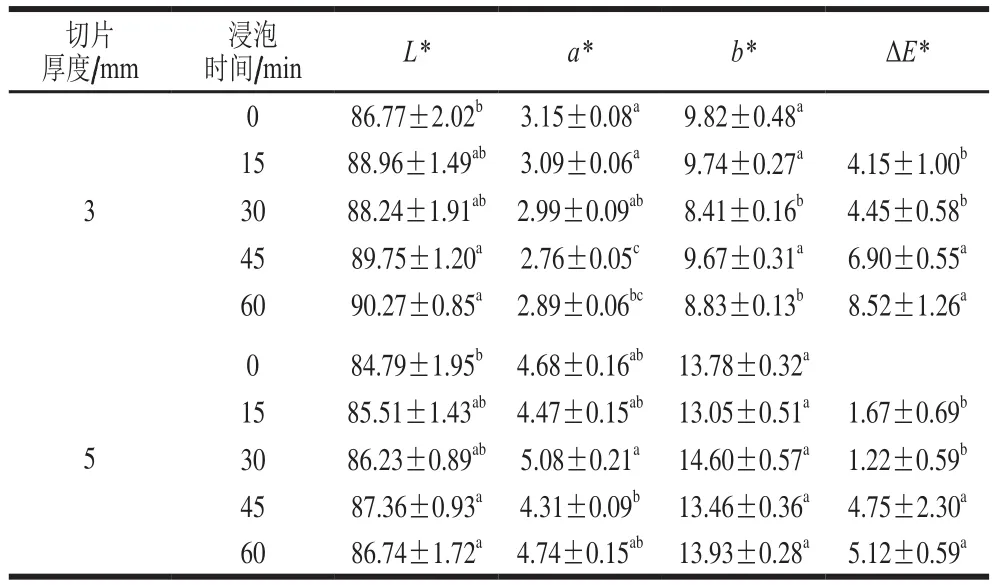
表3 亚硫酸钠浸泡时间对脱水蒜片色泽的影响Table 3 Effect of soaking time on color of dehydrated garlic slices
由表3可以看出,在蒜片切片厚度为3 mm或5 mm条件下进行亚硫酸钠溶液浸泡,随着浸泡时间的延长,干燥所得脱水蒜片L*值显著提高,a*值显著下降,b*值略有下降,ΔE*整体呈上升趋势,说明浸泡时间对于脱水蒜片色泽有一定影响,但当时间长到一定程度后,继续延长浸泡时间护色效果并无继续增强。
2.2 硫代亚磺酸酯含量测定结果

图1 亚硫酸钠浸泡温度对脱水蒜片硫代亚磺酸酯含量的影响Fig. 1 Effect of soaking temperature on thiosulfate content in dehydrated garlic slices
由图1可知,在亚硫酸钠溶液质量浓度与浸泡时间相同的条件下,随着浸泡温度的上升,脱水蒜片中硫代亚磺酸酯含量均呈现下降趋势。大蒜组织结构遭到破坏时,蒜中的蒜氨酸与蒜氨酸酶接触生成的系列硫代亚磺酸酯,提供了蒜的主要生物活性[23]。蒜氨酸酶的最适酶活温度低于30 ℃[24],当浸泡温度过高时,蒜氨酸酶活会受到抑制,从而影响硫代亚磺酸酯的生成。硫代亚磺酸酯为热不稳定成分[25],其分解速率随温度的升高而加快,使得测得产品中硫代亚磺酸酯含量下降。综合蒜氨酸酶及生成物硫代亚磺酸酯的特性,使得脱水蒜片中测得的硫代亚磺酸酯的总体含量随浸泡温度的升高呈现下降趋势。此外,切片厚度较薄时,蒜片的破损程度高于较厚切片,所暴露的蒜氨酸酶与蒜氨酸的接触更多,酶促反应更加充分,可能使得生成的硫代亚磺酸酯的量更多。
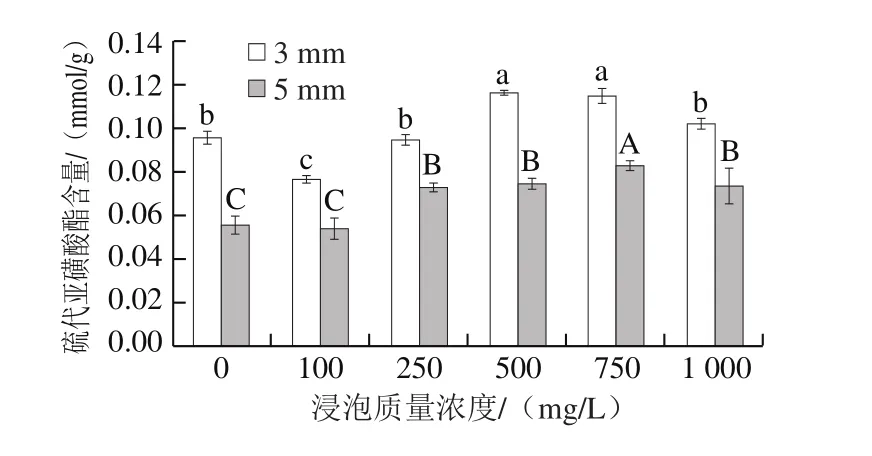
图2 亚硫酸钠浸泡质量浓度对脱水蒜片硫代亚磺酸酯含量的影响Fig. 2 Effect of sodium sulfite concentration on thiosulfate content in dehydrated garlic slices
由图2可知,经不同质量浓度亚硫酸钠溶液处理的脱水蒜片硫代亚磺酸酯含量均与对照有差异,整体趋势均高于对照组。硫代亚磺酸酯是完整蒜瓣组织被破坏时,其中的蒜氨酸在蒜氨酸酶的催化下反应生成的风味性物质,反应过程中会生成副产物丙酮酸[26]。随着亚硫酸钠浸泡溶液质量浓度升高,测得脱水蒜片中的硫代亚磺酸酯含量升高可能是因为,弱碱性的浸泡条件,中和了反应中产生的丙酮酸,促进反应进行从而使得浸泡处理后的脱水蒜片的硫代亚磺酸酯含量略有提高。当浸泡液质量浓度较低时,浸泡过程主要起到稀释作用,无法促进硫代亚磺酸酯的积累。
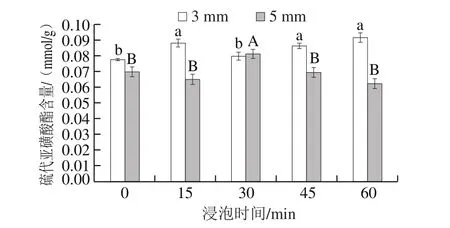
图3 亚硫酸钠浸泡时间对脱水蒜片中硫代亚磺酸酯含量的影响Fig. 3 Effect of soaking time on thiosulfate content in dehydrated garlic slices
由图3可知,蒜片切片厚度为3 mm时,随着浸泡时间的延长,脱水蒜片中硫代亚磺酸酯含量变化较小;切片厚度为5 mm时,随浸泡时间的延长,脱水蒜片中硫代亚磺酸酯含量呈现先增高后降低的趋势,说明适当的延长浸泡过程有利于硫代亚磺酸酯的生成,但过长的浸泡时间可能会造成硫代亚磺酸酯溶于浸泡液中,不利于脱水蒜片中硫代亚磺酸酯的保存。
2.3 SO2残留量测定结果
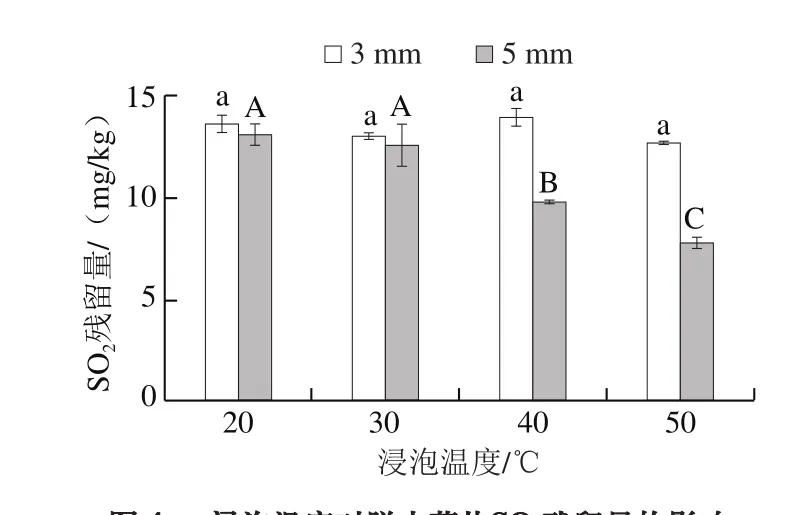
图4 浸泡温度对脱水蒜片SO2残留量的影响Fig. 4 Effect of soaking temperature on SO2 residue in dehydrated garlic slices
由图4可知,随着浸泡温度的升高,当蒜片切片厚度为3 mm时,SO2残留量并无显著性差异;当蒜片切片厚度为5 mm时,SO2残留量随浸泡温度的上升而显著下降。蒜片中的SO2由样品自身固有的和浸泡过程中亚硫酸钠分解产生的这两部分组成。温度越高,浸泡液中亚硫酸钠分解速率越快,释放的SO2的量就越多,因此蒜片中残留的SO2会呈现下降趋势,但切片厚度较薄时,蒜片比表面积增大,浸泡过程中与亚硫酸钠溶液接触更为充分,此条件下升温在加快亚硫酸钠分解的同时可能促进了样品对SO2的吸收,从而使所得到的脱水蒜片中SO2残留量并不随着浸泡温度的升高而下降。
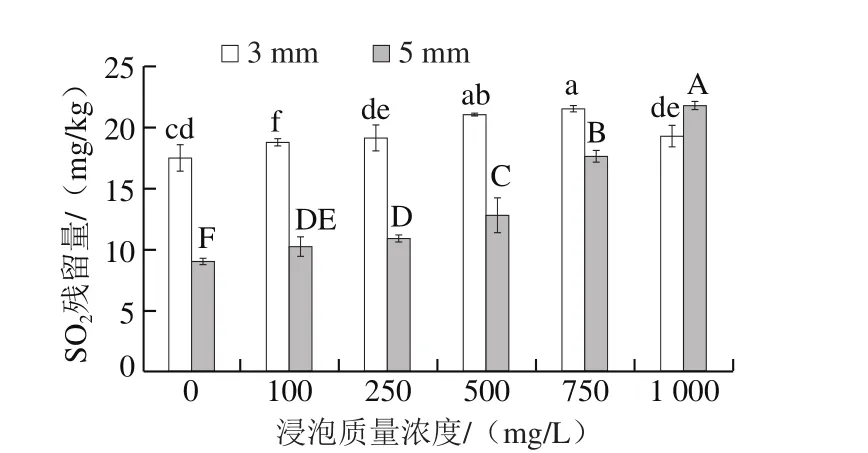
图5 亚硫酸钠浸泡质量浓度对脱水蒜片SO2残留量的影响Fig. 5 Effect of sodium sulfite concentration on SO2 residue in dehydrated garlic slices
由图5可知,随着亚硫酸钠浸泡质量浓度的上升,蒜片切片厚度为3 mm或5 mm所得的脱水蒜片的SO2残留量均呈现上升趋势。当亚硫酸钠浸泡质量浓度低于750 mg/L 时,切片厚度为3 mm的脱水蒜片的SO2残留量低于切片厚度为5 mm的蒜片;当浸泡质量浓度大于750 mg/L时,则相反。质量浓度越高,溶液中的有效SO2的含量就越高,因此随着浸泡质量浓度的上升,蒜片中残留SO2的量逐渐增多。
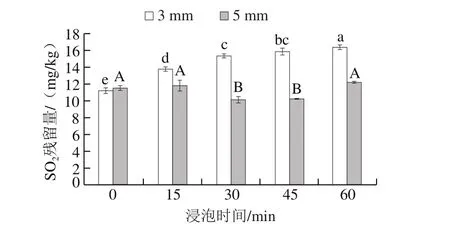
图6 亚硫酸钠浸泡时间对脱水蒜片SO2残留量的影响Fig. 6 Effect of soaking time on SO2 residue in dehydrated garlic slices
由图6可知,当蒜片切片厚度为3 mm时,随着浸泡时间的延长,脱水蒜片中SO2残留量呈现增加趋势,说明浸泡过程中蒜片会吸收SO2,使得自身SO2残留量增大;当蒜片切片厚度为5 mm时,虽浸泡时间的延长SO2残留量保持在稳定的状态,可能是因为此条件下大蒜内部组织暴露于外的部分占蒜片总表面积比例较小,抑制了蒜瓣内部组织与亚硫酸钠溶液的直接接触,从而使得吸收的SO2的含量较低。
2.4 体外抗氧化活性测定结果
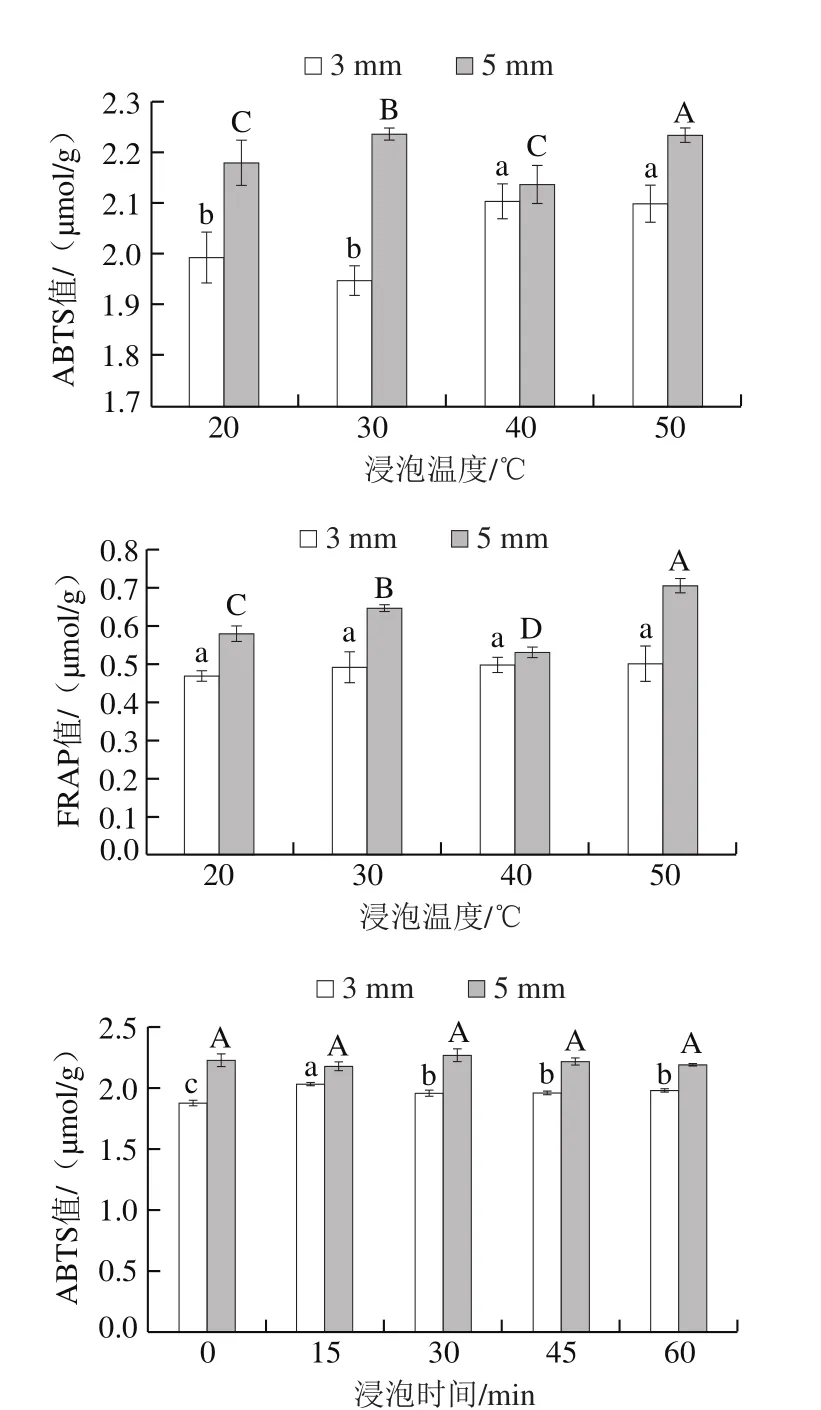

图7 亚硫酸钠浸泡条件对脱水蒜片体外抗氧化活性的影响Fig. 7 Effects of different sodium sulfite soaking conditions on antioxidant activity of dehydrated garlic slices
由图7可知,不同浸泡条件下,切片厚度为5 mm的脱水蒜片的FRAP及ABTS抗氧化性均优于切片厚度为3 mm脱水蒜片。大蒜的抗氧化功能主要源于其中所含的硫代亚磺酸酯及硫代亚磺酸酯分解产生的硫醚、烯等含硫成分以及酚类、硒、锗等成分的作用。在浸泡过程中,3 mm厚的蒜片的比表面积较大,浸泡过程中与亚硫酸钠溶液接触更加充分,虽然测得其硫代亚磺酸酯及SO2残留量均高于5 mm厚度的蒜片,但可能浸泡过程中其所含酚类物质及其他硫化物的溶出量较大,从而导致其抗氧化性能低于切片厚度为5 mm的蒜片。浸泡温度、浸泡浓度及浸泡时间对ABTS及FRAP抗氧化性影响均较小。
2.5 复水比测定结果
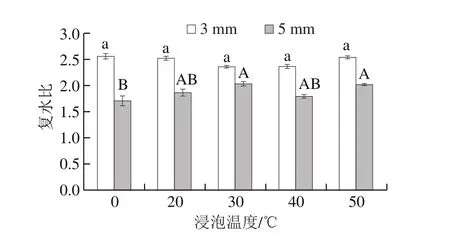
图8 亚硫酸钠浸泡温度对脱水蒜片复水比的影响Fig. 8 Effect of soaking temperature on rehydration ratio of dehydrated garlic slices
由图8可见,蒜片切片厚度为3 mm时,不同浸泡温度下脱水蒜片复水比并无显著性差异;当蒜片切片厚度为5 mm时,复水比均低于3 mm蒜片,但随浸泡温度上升,蒜片的复水比略有上升。说明当蒜片较薄时,在相同浸泡条件只改变浸泡温度对脱水蒜片复水比并无显著影响。切片厚度较薄时,蒜片比表面积较大,复水时与水的接触更充分,吸收水的速度相对较快,因此复水比相对较大。
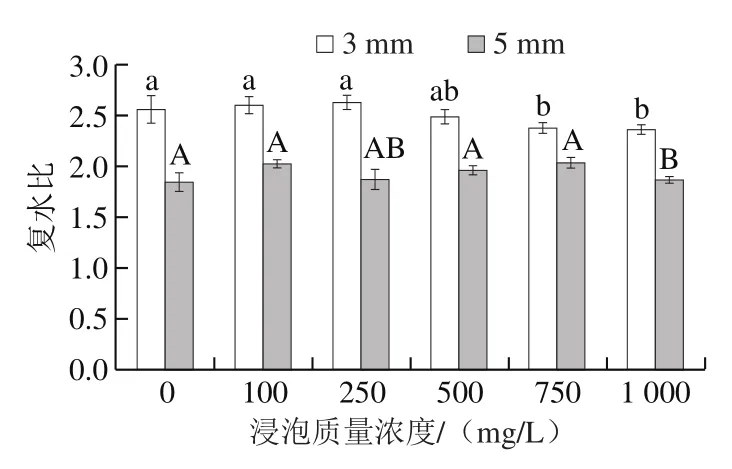
图9 亚硫酸钠浸泡质量浓度对脱水蒜片复水比的影响Fig. 9 Effect of sodium sulfite concentration on rehydration ratio of dehydrated garlic slices
由图9可知,随浸泡质量浓度的增大,脱水蒜片复水比略有下降,其中切片厚度为3 mm蒜片复水比均高于5 mm,浸泡质量浓度对于相同切片厚度的蒜片的复水比影响较小。产品的复水性主要取决于物料细胞和结构的破坏程度。不同浸泡质量浓度干燥得到的脱水蒜片的复水性的差别可能源于浸泡过程中溶液中的盐溶液质量浓度的差别,随着亚硫酸盐溶液质量浓度的升高,可能会引起蒜片内部组织损伤及细胞收缩[27],从而使得蒜片质构发生了一些改变,影响了干制蒜片复水性。

图10 亚硫酸钠浸泡时间对脱水蒜片复水比的影响Fig. 10 Effect of soaking time on rehydration ratio of dehydrated garlic slices
由图10可知,随浸泡时间的延长,脱水蒜片的复水比均呈现下降趋势。其中,切片厚度为3 mm的蒜片复水比均高于切片厚度为5 mm时复水比。可能由于较长时间的浸泡预处理会使得蒜片中细胞溶胀,结构遭到改变,蒜片干燥前的初始含水量增高,干燥过程中,蒜片外层水分快速挥发,影响了内部水分外迁,从而影响了最终产品的组织结构,导致产品复水性能下降。
3 讨 论
从实验结果可知,将亚硫酸钠应用于脱水蒜片的预处理过程中,蒜片厚度对于所得脱水蒜片的品质影响很大。切片厚度为5 mm时,采用相同条件进行浸泡处理,所得蒜片SO2残留量较低,抗氧化性较强,但其色泽、复水比及硫代亚磺酸酯含量均低于切片厚度为3 mm脱水蒜片。并且在干燥过程中,达到相同干燥终点所需干燥时间远大于3 mm蒜片,因此脱水蒜片加工过程中选择3 mm作为蒜片厚度较为适宜。
亚硫酸盐具有漂白、防腐、抗氧化等多种功能,被广泛应用于食品加工的各个领域。但过量摄入亚硫酸盐会引起头痛、恶心、呕吐及气喘等慢性或急性中毒,对神经系统、呼吸系统及消化系统均会产生不良影响[28]。故如何合理有效的控制亚硫酸盐使用量对于食品的加工十分重要。我国GB 2760—2014《食品添加剂使用标准》规定,干制蔬菜SO2的最大使用量为0.2 g/kg,腌渍蔬菜的最大使用量为0.1 g/kg(最大使用量以SO2残留量计)。德国对干制大蒜的要求为SO2残留量低于50 mg/kg[10]。本实验采用质量浓度范围0~1 000 mg/L亚硫酸钠溶液对蒜片进行浸泡,发现亚硫酸钠溶液浸泡处理具有良好的护色效果,处理浓度对脱水蒜片的色泽影响最大,当处理质量浓度大于500 mg/L时,L值不再有显著变化,色泽状态基本稳定。随着亚硫酸钠溶液质量浓度的上升及处理时间的延长,干燥后所得脱水蒜片的SO2残留量不断提高,由实验结果可知,当3 mm蒜片经质量浓度为1 000 mg/L亚硫酸钠溶液浸泡30 min后,SO2残留量为24.39 mg/kg;经500 mg/L浸泡1 h后,SO2残留量为16.36 mg/kg,均符合国标要求。
大蒜独特的风味源于中含有蒜氨酸在蒜氨酸酶作用下生成的硫代亚磺酸酯,硫代亚磺酸酯在不同条件下可分解生成硫醚、蒜烯等风味成分,蒜素也是硫代亚磺酸酯的一种,约占其70%。因此选择测定硫代亚磺酸酯含量作为其功能性成分的代表物质[29]。通过浸泡处理后所得的脱水蒜片的硫代亚磺酸酯保留量有所提高,可能由于适宜的浸泡条件有利于硫代亚磺酸酯的生成及保留,当蒜片在20 ℃经500 mg/L亚硫酸钠溶液浸泡30 min时,硫代亚磺酸酯含量为0.11 mmol/g显著高于对照组0.09 mmol/g。浸泡条件对于脱水蒜片的抗氧化性影响较小,其变化不随浸泡条件的改变而改变。
4 结 论
采用亚硫酸钠浸泡作为脱水蒜片预处理方法时,常温条件下,浸泡质量浓度选择为500 mg/L,浸泡时间选择为30 min,干燥后所得脱水蒜片品质较佳。综上,适量的将亚硫酸钠应用于脱水蒜片的生产加工过程中,可有效提高脱水蒜片成品品质。

