蛋白水解物制备工艺及其在生物技术领域中的应用研究进展
张邵博,靳冬武,李明生*
1西北民族大学生命科学与工程学院;2甘肃省动物细胞工程技术研究中心;3兰州民海生物工程有限公司,兰州 730030
蛋白水解物是蛋白质经酶、酸、碱和发酵等方法水解得到的混合物,其主要成分为肽类,还包含少量氨基酸、糖类、脂类、矿物质和维生素等物质[1]。蛋白水解物的水解效果通常用水解度来评价,但根据其用途评价指标也有所不同,在无血清培养基中主要以氨基酸含量,肽键数为指标,在ACE抑制肽中主要以ACE酶的抑制率为指标,蛋白水解物的抗氧化活性主要以其抗氧化肽含量为评价指标[2],脑蛋白水解物注射液以各游离氨基酸和总游离氨基酸的含量为评价指标[3]等。图1为蛋白质水解为多肽或氨基酸的结构图。

图1 蛋白质水解结构图Fig.1 The structure pattern of protein hydrolysis process
1880年Nagelli等[4]人最先将蛋白水解物用在生物技术领域,即微生物培养。1900年蛋白水解物成为Vogoes-Proskauer 和McConkey培养基中的重要成分[5]。在1914年Difco实验室将蛋白胨用在细菌培养基中[5]。2000年Heidemann等[6]人采用酶解及其下游工艺纯化蛋白水解物并应用在生物技术领域中。随后,蛋白水解物在生物技术领域中使用更为广泛。
20 世纪 70 年代Mizrahi[7]研究发现蛋白水解物对动物细胞培养是有利的,能够提高蛋白或药物表达系统的性能。目前,研究表明,蛋白水解物除了为动物细胞增殖提供普通的氮源以外,还能够提供多种营养成分、贴壁因子及生长因子类似物等[6],可用于无血清或低血清培养基中支持动物/昆虫细胞生长、提高目标产物表达量。Franek等[8-10]研究表明蛋白水解物中存在不同分子量的活性短肽,这些肽段可作为外部分子信号从而影响细胞的增殖和代谢,并能促进细胞生长,提高细胞活力。
本文主要从蛋白水解物制备工艺的研究概况、蛋白水解物在生物技术领域的应用、蛋白水解物对细胞代谢增殖的影响以及在细胞培养中应用的优缺点出发,对蛋白水解的研究进展进行综述。
1 蛋白水解物制备工艺的研究概况
微生物培养基中的蛋白水解物的制备工艺已有几十年的历史,其基本的生产工艺基本稳定并且几乎保持一致。但随着蛋白水解物的应用范围越来越广泛,尤其是在动物细胞培养的个性化培养基中的应用,其生产工艺也有了显著的提高。目前,其工艺处在寻找特异性肽类的起步阶段,该工艺及其应用的预期效果是得到单个氨基酸的混合物和特异性生物活性肽。这将成为蛋白水解物生产厂商和最终用户共同努力开发针对特定应用的最佳水解蛋白的制备工艺。
1.1 蛋白水解物基本水解方法
目前,蛋白水解物的制备方法主要有酸水解法,碱水解法和酶水解法。酸水解法是利用盐酸在一定温度条件下水解一段时间再用碱中和。水解成本低、水解彻底、反映迅速、生产周期短,产物几乎不被消旋,酸水解会破坏色氨酸、天冬酰胺和谷氨酰胺等敏感氨基酸,部分糖也会被破坏导致水解液颜色呈现棕黑色,酸水解蛋白原料过程中会产生具有毒性和致癌性的氯丙醇[11]。碱水解法水解蛋白质色氨酸稳定,但水解后氨基酸会消旋,使L型氨基酸变成D型,水解率低,易产生尿素等不利物质,尤其胱氨酸和半胱氨酸易损失,酸碱水解法不存在专一性。酶水解法水解位点特定,可以有选择的水解某些特定的氨基酸肽键,用于一级结构,安全性高、反应条件温和、副反应少、不破坏敏感氨基酸、水解产物在营养、风味、工艺等方面均优于酸、碱水解法[12,13]。
1.1.1 酸水解法
Braconnot在1820年第一次报道。该方法主要是用在食品领域中,主要是增加和改善食品的风味[14]。在生物技术领域中只占一小部分。酸水解最常用的是硫酸水解或盐酸水解,在蛋白质水解过程中,有一些必需氨基酸被破坏,例如色氨酸,蛋氨酸,胱氨酸、半胱氨酸等,谷氨酰胺和天冬酰胺进一步的被转化为谷氨酸和天冬氨酸[15]。更显著的是酸水解破坏了蛋白质中的特有氨基酸或者短时间内破坏了大量的小分子肽。除此之外,酸水解过程中盐含量显著的增加,脱盐等疑难问题在下游技术中需要解决。通常酸水解的酪蛋白和大豆蛋白用于诊断和发酵培养基中[16]。
1.1.2 碱水解法
在生物技术领域中碱水解法使用很少,在水解过程中有些蛋白质被破坏,如丝氨酸和苏氨酸,但色氨酸是完整的。张忆华等采用微波碱水解法水解了全脂豆粉,水解时间由常规方法的20多个小时缩短为55秒,同时检测了水解产物的色氨酸和酪氨酸的含量[17]。
1.1.3 酶水解法
目前有大量的动物、植物和微生物蛋白质可用多种酶进行酶解,并使用于生物技术领域中,近几年,发酵产生的蛋白酶水解蛋白质技术被大量学者研究。酶解蛋白质的主要优势是水解条件温和,制造商能够精确控制蛋白质水解物的水解度,从而满足不同的用户。蛋白质水解常用的蛋白酶有动物源性蛋白酶、植物源蛋白酶、微生物源性蛋白酶。动物蛋白酶主要有胰酶、胰蛋白酶、胃蛋白酶等,植物蛋白酶主要有木瓜蛋白酶和菠萝蛋白酶,还有细菌和真菌性蛋白酶属于微生物酶,表1为蛋白酶举例。蛋白质的水解可以用单酶来完成,也可以采用多种酶连续水解的方法来完成。酶的选择经常依赖于蛋白质的来源和最终用户的要求。例如,蛋白质中含有较高浓度的疏水性的氨基酸,在酶选择时就要选择能够特异性水解疏水性氨基酸的酶[18]。
除了酸、碱、酶水解蛋白质以外,蛋白水解物制备的一个新趋势是采用发酵法水解蛋白并得到游离氨基酸和多肽、短肽[23]。微生物发酵法是较为传统的食品加工手段,包括液态发酵和固态发酵。其生产工序相对简单,经发酵后可提升原料蛋白的溶解性、乳化性、起泡性等特性。
1.2 蛋白水解物制备工艺流程
根据蛋白水解物和产品类型的不同,其工艺流程也略有不同,图2为蛋白水解制备的一般工艺流程。
根据图2可以看出,水解蛋白质的方法不同,其控制条件也不一致。靳冬武等[24]以游离氨基酸含量为指标,采用超高压协同酶解的方法对酪蛋白进行水解。通过单因素试验,考察了底物浓度、水解温度、水解pH对氨基酸含量的影响,结果证明随着底物浓度的增加氨基酸含量也随之增加,随着水解压力的增加氨基酸含量呈先增后减的趋势,随着水解温度的上升氨基酸含量呈先增后减的趋势,随着水解 pH的增加氨基酸含量呈先增后减的趋势。张健[25]等采用高压技术水解卵清蛋白,在单因素试验基础上采用正交实验的方法对高压酶解卵清蛋白的工艺进行优化,结果显示,随着压力的增加,卵清蛋白的水解度呈上升趋势,150 MPa 时水解度达到最大;水解温度的升高,水解度的变化极其明显,50解时达到最大;水解度随pH升高在一定范围内逐渐升高,但变化不明显;随酶浓度增加,水解度变化极其明显且呈升高趋势,以水解度为标准正交试验确定最佳水解工艺为:水解压力120 MPa,水解温度50解,水解pH =7.0,酶与底物比(E/S) =1∶2.5。众多试验结果表明,水解度受多因素影响,水解条件的确定应综合压力、温度、pH、酶与底物浓度的比值等条件筛选最优条件得到理想的水解产物。在酶解蛋白质的工艺中,要随时监控体系的pH和温度。这主要与酶的性质有关,在酶的最佳条件下酶才能发挥最好的作用,这样不会造成酶的浪费,并且可以缩小批间差异。

表1 蛋白酶种类及其特性举例

图2 典型蛋白水解物工艺流程图Fig.2 Typical manufacturing overview of protein hydrolysates
1.3 蛋白水解物制备过程中的质量控制
要得到质量好、稳定性好、批间差异小的高质量蛋白水解物,在制备过程中严格控制生产环境、严格监控每一操作工艺等尤为重要。应严格遵守2015年版《中华人民共和国药典》生物制品通则对生产和质量管理规范的原则性要求,包括:生物制品生产用原材料及辅料的质量控制规程、生物制品生产和检定用动物细胞基质制备及检定规程、生物制品分装和冻干规程、生物制品贮藏和运输规程等[26]。
蛋白水解物的质控要点主要有1)严格遵守GMP规程;2)保持车间的卫生;3)原材料和供应商的筛选,获得高质量,批间差异小、稳定性好、一致性强的原材料;4)生产过程抽样监测保持一致性;5)干燥过程中干燥开始与干燥结束时的样品保持一致;6)不断的检测蛋白、酶、水以及下游工艺能影响产品质量的各个环节。
1.4 蛋白水解物制备下游工艺
下游制备工艺是对初步水解产物的分离纯化。蛋白质水解物经过简单分离步骤后其清亮度差、溶解度低,不能直接添加于干粉培养基和动物细胞培养基中。此外,忽略对蛋白水解物中内毒素含量的检测和控制,可能对细胞培养过程中后期蛋白表达、疫苗生产等带来巨大的浪费和损失,罗非君[27]等研究表明,内毒素能诱导巨噬细胞凋亡,细胞吞噬机能显著下降(P<0.01)。因此通过下游工艺对蛋白水解物进行优化尤为关键。表2[28]、图3列举了蛋白水解物下游工艺主要方法。
表2 蛋白水解物下游工艺处理方法
注:A、B、C、D分别为板框压滤、连续离心、超滤、层析。
Note:A.Plate and frame filter press,B.Centrifuge,C.Ultra filtration system,D.Chromatography.

图3 蛋白水解物下游工艺设备Fig.3 The downstream process instruments of protein hydrolysates
总之,蛋白水解物制备工艺基本稳定,但在制备特异性肽类还处于起步阶段。要得到质量好、稳定性好、批间差异小的高质量蛋白水解物,制备过程中生产环境、严格操作生产工艺步骤尤为重要。
2 蛋白水解物在生物技术领域的应用概况
随着生物技术的不断发展,蛋白水解物在生物技术领域中使用越为广泛。近年来,蛋白水解物作为氮源和营养成分使用在分子生物学、微生物学、动物细胞的培养、昆虫细胞的培养、植物细胞的培养。
2.1 蛋白水解物在哺乳动物细胞蛋白表达中的应用
由于哺乳动物细胞转录后修饰,哺乳动物细胞表达系统在蛋白表达产品中使用最为普遍[29]。目前,中国仓鼠卵巢(Chinese Hamster Ovary,CHO)细胞能够正确的转录后修饰,并且在大规模的工业化生物反应器无血清培养基悬浮培养中有很好的适应性,几乎60%~70%的重组蛋白在CHO细胞中成功的表达[30]。通常采用含有血清的培养基培养CHO细胞或者是未分泌蛋白的小鼠骨髓瘤(NSA)细胞并表达和生产蛋白质,包括单克隆抗体。因此,1972年和1974年Taylor学者[31,32]开始采用蛋白水解物代替血清培养哺乳动物细胞进行了研究。在哺乳动物细胞培养基中添加蛋白水解物能够促进细胞生长,并提高目标蛋白的产率。
Chun BH等[33]研究了不同水解物对CHO DG44细胞悬浮培养的影响,结果显示分批培养最大细胞密度为不添加水解物对照组的106%至144%,其中添加大豆水解产物组的最大细胞密度和生长速率均高于其他水解产物。 Sung YH等[34]研究了重组中国仓鼠卵巢(rCHO)细胞悬浮培养表达人血小板生成素(hTPO),在无血清培养基(SFM)中添加酵母水解产物(YH),YH对hTPO表达的正面影响极其显著,当5g/LYH加入SFM时,分批培养的最大hTPO浓度为40.41μg/mL,是不加YH的SFM的11.5倍。Franek 等[35]研究指出,大豆蛋白水解物分离组分及小麦蛋白水解物分离组分能显著提高杂交瘤细胞ME-750 密度及单克隆抗体的产量,其最高值分别为无血清对照组的180% 及239%。Pham PL等[36]研究表明添加明胶蛋白胨N3的无血清培养基培养的HEK293SF-3F6细胞系的蛋白表达量提高了四倍。Heidemann R等[37]研究表明,在培养基中添加高浓度蛋白胨提高了重组BHK细胞系20%~30%的单位生产率。
2.2 蛋白水解物在昆虫细胞蛋白表达中的应用
在昆虫细胞中杆状病毒表达载体系统是蛋白表达常用的工艺过程,有一些系统采用了(Spodoptera frugiperda,Sf-9)细胞表达蛋白并使用了含有水解乳蛋白的培养基[38]。许多昆虫细胞培养基中含有胎牛血清,是培养基中最为昂贵的成分。由于血清的批间差异,可能含有细胞毒性成分,病毒、支原体等对细胞的影响最大。并且会引起泡沫、下游蛋白纯化复杂等问题。进一步说,血清并不是昆虫细胞培养中的必须成分,而在无血清培养基中添加一些蛋白胨或水解乳蛋白更为有效。蛋白胨是培养基中主要的氨基酸来源,其中水解乳蛋白是最广泛应用的添加剂,通常和酵母提取物一起被添加到各种昆虫培养基中。水解乳蛋白对昆虫细胞的作用不是与其含量成正相关的,其浓度一般在0.2%~0.5%之间对昆虫细胞有促生长作用[39]。
2.3 蛋白水解物在疫苗中应用
由于牛血清可能会引起朊病毒病疾病(BSE会感染大脑中大神经元),从而在疫苗生产中使用牛血清已被轻视。因此,在无动物源性的疫苗生产用的培养基成分中动物源性的材料(血清、动物源性蛋白水解物)逐日被植物蛋白水解物代替。例如,在破伤风毒素的制备中,为了破伤风梭菌的免疫和增殖,在传统培养基中添加肉提取物、脑心浸液,酪蛋白水解物等动物源性的材料,但经常会发现在类毒素中经常有动物的加成化合物。为了解决这个问题,在新的培养基中添加了植物蛋白水解物并培养了破伤风梭菌,从而发现其增殖、收率和滴度就高于含有原来传统的含动物源性蛋白的培养基[40-42]。
2.4 蛋白水解物在微生物细胞中的应用
培养基中不同氮源会对微生物细胞的增值和代谢途径产生影响。肠道细菌的组成和代谢均会受到蛋白质结构以及氨基酸组成的影响,刘艺端等[43]研究了以豆粕、菜粕或鱼粉水解物上清液为氮源的不同蛋白源对小肠微生物代谢的影响,结果表明,空肠组和回肠组氨氮浓度和菌体蛋白浓度均相对增加,尤其是酶解菜粕组菌体蛋白合成量较高,十二指肠组菌体蛋白浓度以及氨氮含量不断减少,能够转化乳酸并大量产生丁酸和丙酸,丁酸是肠道上皮细胞的重要能量来源,同时能够促进肠道黏蛋白的生成。高海燕[44]研究表明,用乳清蛋白水解物分别等量替代MRS培养基中的蛋白胨或牛肉粉对保加利亚乳杆菌、嗜热链球菌、植物乳杆菌、干酪乳杆菌以及双歧杆菌的培养效果较好,生长量及生长趋势均可达到市售MRS培养基及自配MRS培养基的水平甚至更优。左伟勇[45]研究表明,伴大豆球蛋白胃蛋白酶水解肚是良好的双歧杆菌促增殖因子,能够促进双歧杆菌增殖,并且优于等氮量的伴大豆球蛋白,不仅具有营养功能,而是发挥了某种调节作用。
2.5 蛋白水解物在植物细胞蛋白表达中的应用
紫杉醇是通过植物细胞培养制得的一种重要的产品,是最为成功的抗癌药物之一。它是通过红豆杉细胞的悬浮培养制备所得。2000年Choi等[46]的标准培养基中含有酪蛋白水解物,而在2002年张等[47]的标准培养基中含有水解乳蛋白。
2.6 蛋白水解物在初级代谢产物生产中的应用
初级代谢产物工业化生产是微生物的最主要的贡献之一,例如氨基酸、维生素、呈味核苷酸等。许多代谢产物的发酵工艺中都能利用蛋白水解物。例如L-谷氨酸的制备是工业化生产最大的初级代谢产物,每年能生产150万吨。2006年Kataoka等[48]在生产L-谷氨酸时在培养谷氨酸棒状杆菌的商业化培养基中添加了大豆蛋白水解物。
3 蛋白水解物对细胞代谢、增殖的影响
蛋白水解物在动物细胞培养过程中作为完全培养基的组成成分或在生物反应器批培养的重要成分而被普遍利用。如果细胞生长在游离氨基酸中,只能通过游离氨基酸的运输系统才能进入到细胞体内被细胞吸收。但细胞生长在含有多肽和游离氨基酸的培养基中时,游离氨基酸和多肽进入细胞体内,由细胞本身所携带的酶水解并以短肽和氨基酸的形式被细胞吸收,从而影响细胞的整体代谢[49],具体见图1-4所示。
由于蛋白水解物中含有多种活性因子和营养成分,这从根本上改善培养体系的整体性能,进而影响细胞代谢、增殖、生物合成和蛋白表达[1]。1999年Nyberg等[50]研究表明采用含有动物组织水解物PrimatoneTMRL的无血清培养基培养CHO细胞过程中,从多肽中释放出的氨基酸数量有显著变化。这充分证明,蛋白水解物能对细胞生长和细胞蛋白的生产有明显的正面影响。Bonarius HPJ等[51]对杂交瘤细胞的连续培养中的胞内代谢通量,氨基酸、葡萄糖的消耗率和乳酸、氧气、CO2和NH4+的生成率以及在含有动物组织水解物和无蛋白水解物的培养基中对细胞内氨基酸的通量和单克隆抗体产率进行了研究,结果表明,细胞密度增加两倍以上,单克隆抗体的产量增加50%,整个氨基酸的组成是正常培养基的两倍。
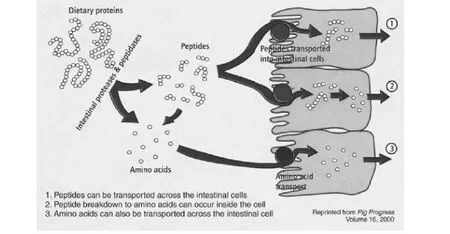
图4 细胞吸收蛋白水解物模式图Fig.4 The pattern of cell absorption protein hydrolysates
本实验室研究了酪蛋白水解乳蛋白对细胞生长的影响,在BHK-21贴壁细胞中进行了应用,以含有0.25%酪蛋白水解乳蛋白(45%MEM,45%欧氏液,10%FBS)为培养基,培养BHK-21贴壁细胞。同时以MEM培养基为空白组,含有0.25%Hyclone水解乳蛋白的基础培养基为对照组。连续培养10代,结果显示BHK-21细胞培养24 h时空白组、试验组和对照组的细胞均能生长至50%以上;在48 h均生长成致密单层,细胞生长正常,形态良好。但在24 h试验组和对照组的细胞密度明显高于空白组。这说明Hyclone水解乳蛋白和超高压酶解酪蛋白产物对BHK-21细胞均有促生长作用。
蛋白水解物对细胞生长有明显的影响其原理并没有合理的解释,Sxhlaeger等[52]研究表明,蛋白水解物作为HEK293细胞转染的激活因子,它不但是一种重要的营养成分而且具有抗细胞凋亡功能[53]。目前培养基中添加蛋白水解物后其中的游离氨基酸有可能会改变细胞中葡萄糖,乳酸和氨的代谢,从而引起在不同系统中有不同的反应[54-56]。Davami等[33]对在rCHO细胞中分别添加了几种大豆蛋白水解物和酪蛋白水解物,对其代谢情况进行了研究,结果表明,不同的蛋白水解物对rCHO细胞的代谢有不同的影响。2015年Hu等[57]在CHO细胞中表达Fc融合蛋白并研究了酵母水解物对细胞胞内效应的影响进行了研究,结果发现,添加酵母水解物之后,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)被激活从而增强Fc融合蛋白的翻译,Fc融合蛋白翻译后的步骤变的缓慢。Frenek,Sung等[58,59]研究表明植物蛋白水解物和酵母水解物中含有促细胞生长因子类的肽类和抗细胞凋亡的多肽。Nyberg,Heidemann R等[50,60]研究表明植物蛋白水解物作为氨基酸资源在细胞培养中营养更好。生物活性化合物作为营养添加剂可以提高细胞能量代谢的效率。例如1992年Daniel等[61]解释,小分子肽类以完整形式被细胞吸收并随后水解的效率明显高于游离氨基酸的吸收效率。这样的话,更多的氨基酸可以用于促进细胞生长而不仅仅是提供能量。2012年Luo进一步研究表明,蛋白水解物中存在矿物质,通过铜的添加表明,蛋白水解物可以提高氧化代谢。1996年Bonarius等[51]还发现,在培养基中添加蛋白水解物后,细胞内磷酸戊糖途径流量加快。NADPH产生量增加,细胞合成代谢增强,TCA循环速率加快。Chun等[62]研究表明,蛋白水解物可以促进细胞生长,并且可以减少碳源的消耗和乳酸的生成,但氨的生成会略有增加。Burteau 等[63]学者强调,当葡萄糖消耗完后,乳酸被植物蛋白水解物触发被作为碳源从而被细胞所利用。这些研究均表明,蛋白水解物会影响细胞代谢主要依赖于培养基。因此,有许多学者研究了蛋白水解物对细胞代谢的动力学。
总之,蛋白水解物在细胞培养中的代谢机制尚不明确,近年来,有许多的学者对其细胞代谢机制的影响进行研究。但研究表明,由于水解物的来源及生产工艺不同,导致其氨基酸组成、肽段分子量大小及结构不同,因而对细胞生命活动产生影响也有所不同[1],但基本都能够对细胞代谢有正面的影响。因此,蛋白水解物是无血清培养基或低血清培养中的很好的一种营养添加剂。
4 蛋白水解物在细胞培养中应用的优缺点
许多研究结果表明,蛋白水解物作为培养基中的添加剂不但可以提供营养成分促进细胞增殖,而且可以提高蛋白产物的产率。但蛋白水解物在应用中仍有局限性。以下为蛋白水解物在细胞培养中应用的优缺点。
4.1 蛋白水解物在细胞培养中的优点
蛋白水解物的使用代替了血清添加成分,作为基础营养成分为无血清培养基开发技术提供了可靠的解决方案。推动了个性化无血清培养基的研制进程。无血清培养基研制比较费时并且很有难度。向DMEM、MEM、DM/F12等基础培养基中添加适量的蛋白水解物制备个性化或普通无血清培养基,能够加快无血清培养基的研制进程。
蛋白水解物作为无血清培养基的补充剂或基础配方,为无血清培养基的快速开发技术提供了一个临时的解决方案。虽然蛋白水解物中的化学成分尚不明确并存在一定的变量,但蛋白水解物提供了许多有益的因素,例如减少了添加血清带来的相关风险,避免血清蛋白酶对目标产物的分解、简化下游工艺的相关步骤、消除血清潜在的免疫原性及病毒微生物污染,减少制药工业的风险[1]。此外,蛋白水解物作为无血清培养基的基本成分可应用与贴壁依赖性细胞和非贴壁依赖性细胞[64-66]。
蛋白水解物以干粉形式可以储存在低温条件下,一般都是大批量生产,可以控制原材料、制备工艺的一致性和合理性。从而保证了最终使用者所用产品的一致性。减少了无血清培养基的批间差异。从而为审核供应商可能会提供一些成本优势。蛋白水解物可以改变生物反应器的生产环境,从而生产出高质量、高收益率的生物产品。
4.2 蛋白水解物在细胞培养中的缺点
动物源的蛋白水解物可为生物制药行业带来支原体、噬菌体、病毒等污染,因此在产品申报及审批过程中会遇到和血清同样的问题[5]。
蛋白水解物在基础培养基中的添加量可能在100 mg/L至5.0 g/L范围内,但在基础培养基中所添加的蛋白水解物是否为单独使用或与其他营养添加剂相结合。这样的话,大量可变的生化组成或生物性能可能会影响目的产物的表达。此外,蛋白水解物的化学成分不明确,这可能为目的产物的进一步分离纯化带来一定的困难。
蛋白水解物的加工过程可能引入一些不利因素,如革兰氏阴性细菌的降解会引入一些脂多糖成分,从而改变蛋白水解物中的内毒素水平,进而会影响目标产物的产率及质量[1,5]。
此外,蛋白水解物的组成及功效成分不完全明确,对动物细胞生长及功能的作用机制尚未深入研究。
5 总结与展望
综上,从大量文献来看,蛋白水解物在生物技术领域应用越发广泛,目前蛋白质水解物主要应用在细胞蛋白表达、动植物细胞代谢增殖、微生物培养、个性化培养基、食品加工业等方面。蛋白水解物主要成分为肽类,还包含少量氨基酸、糖类、脂类、矿物质和维生素等物质,可为细胞生长提供多种营养成分、贴壁因子及生长因子类似物等,可作为非动物源性成分添加至培养基中应用于疫苗生产中。应用非动物源性蛋白水解物可以生产安全性更高的生物制品,但由于水解物的来源及生产工艺不同,导致其氨基酸组成、肽段分子量大小及结构不同,因而对细胞生命活动产生影响也有所不同,目前蛋白水解物在细胞培养中的代谢机制尚不明确,是当前的研究热点。

