藏药波棱瓜子中酚性成分的研究
戴宇轩,胡 沙,蒋合众,谭 睿,2*
1西南交通大学生命科学与工程学院;2西南交通大学医学院,成都 610031
藏药波棱瓜子,又名色吉美多,系葫芦科植物波棱瓜Herpetospermumcaudigerum(Wall.)的成熟干燥种子。主要产于中国西南(四川、云南、西藏)及印度等地区,常生长在海拔2 300~3 500 m的山坡灌丛、林缘及路旁[1]。为藏医常用药,性寒,味苦,具泻肝火、胆热、解毒的功效,用于治疗“赤巴”引起的黄疸、肝炎、消化不良及肝胆疾病的配方[2]。近年来,国内外有关波棱瓜子的化学成分报道表明其含有脂肪酸类、木脂素类、氨基酸和多糖类等成分[3]。本课题组通过前期的研究成果表明,波棱瓜子乙酸乙酯部位对乙肝病毒有明显的抑制作用[4]。为了进一步揭示其中的活性成分,本文对波棱瓜子乙酸乙酯部位酚性成分进行了分离研究,并对分离得到的单体化合物进行了抗菌活性测试,为后期进一步的药理实验提供重要参考。
1 仪器与试剂
Bruker DRX 400核磁共振仪;电子天平;EYELA旋转蒸发仪;冷却循环装置;Agilent 6210 TOF LC-MS质谱仪。TH-3560立式高压灭菌锅、Leica多功能显微镜、接种环、电子天平、移液枪、超净工作台、恒温摇床、恒温培养箱、恒温培养室、96孔微孔稀释板等。柱层析所用硅胶(200~300目、300~400目)由青岛海洋化工厂生产;Sephadex LH-20购买自瑞典Pharmacia Biotech;TLC层析板(0.15~0.2 mm)为烟台市芝罘黄务硅胶开发公司生产。其余试剂为分析纯。
波棱瓜子药材购买于四川省泸定县,经西南交通大学生命科学与工程学院宋良科副教授鉴定为波棱瓜Herpetospermumcaudigerum(Wall.)的干燥种子,标本部分留样保存于西南交通大学生命科学与工程学院3704实验室。
2 提取与分离
取10 kg波棱瓜子的干燥种子粉碎成粗粉,用95%乙醇对粗粉进行渗漉提取,合并滤液,减压回收溶剂,将总浸膏用水分散,依次加入石油醚、乙酸乙酯和正丁醇进行萃取3到4次,分别减压浓缩得到石油醚部位浸膏重约217 g,乙酸乙酯部位浸膏重约208 g,正丁醇部位重约107 g。
乙酸乙酯部位进行除糖除脂处理后,取146 g浸膏进行硅胶柱层析,以三氯甲烷-甲醇(100∶1~1∶1)体系洗脱,并以TLC检测判断合并,最终粗分为9个组分(Fr.1~Fr.9)。
取Fr.4(32 g)进行硅胶柱层析,以石油醚-丙酮(40∶1~1∶1)的系统进行梯度洗脱,依据TLC检测,合并成8个组分(Fr.4-1~ Fr.4-8)。选取Fr.4-1(7.3 g),继续硅胶柱层析,最后反复进行Sephadex LH-20凝胶柱层析,洗脱剂分别采用三氯甲烷-甲醇(1∶1)、纯甲醇,最终分离得到化合物1(12.8 mg)。
选取Fr.4-7(6.6 g)进行硅胶柱层析,以石油醚-丙酮(40∶1~0∶1)梯度洗脱。TLC鉴别合并后,选取Fr.4-7-1(1.2 g),采用Sephadex LH-20凝胶柱层析进一步纯化(洗脱剂:纯甲醇),之后反复进行硅胶柱层析,最终得到化合物2(17.4 mg)。将Fr.4-7-3(1.8 g)进行硅胶柱层析,以石油醚-乙酸乙酯(50∶1~0∶1)梯度洗脱,经TLC检测合并后得到6个组分(Fr.4-7-3-1~ Fr.4-7-3-6)。选取Fr.4-7-3-2经Sephadex LH-20凝胶柱层析,洗脱系统为三氯甲烷-甲醇(1∶1),得到化合物6(10.8 mg)。再将Fr.4-7-3-4反复经凝胶柱分离纯化,洗脱系统依次为三氯甲烷-甲醇(1∶1),纯甲醇,最终得到化合物7(9.6 mg)。另取Fr.4-7-5(2.3 g)凝胶柱层析,三氯甲烷-甲醇(1∶1)为洗脱剂分离合并后取Fr.4-7-5-4(45 mg),再次采用凝胶柱层析(纯甲醇)分离得到白色粉末状固体,即为化合物3(11.5 mg)。
取Fr.4-8(4.9 g)以石油醚-乙酸乙酯(20∶1~0∶1)梯度洗脱,分离得到5个组分。其中Fr.4-8-3反复经过Sephadex LH-20凝胶柱层析,洗脱系统依次为:三氯甲烷-甲醇(1∶1),纯甲醇,最终得到化合物4(20.2 mg)。将Fr.4-8-1经凝胶柱层析(洗脱剂:纯甲醇)得到单体化合物5(10.7 mg)。
3 结构的鉴定
化合物1无色油状物(C20H20O6);HR-ESI-MSm/z379.1174 [M+Na]+;1H NMR (400 MHz,Acetone-d6)δ:7.54 (1H,d,J=2.0 Hz,H-2′),7.42 (1H,dd,J=8.2,2.0 Hz,H-6′),7.33 (1H,d,J=1.2 Hz,H-2),7.03 (1H,d,J=1.2 Hz,H-6),6.99 (1H,d,J=8.2 Hz,H-5′),6.69 (1H,dt,J=15.8,1.4 Hz,H-7),6.41 (1H,dt,J=15.8,5.4 Hz,H-8),4.87 (2H,d,J=5.4 Hz,H-9′),4.25 (2H,dd,J=5.4,1.1 Hz,H-9),4.04 (3H,s,-OMe),3.94 (3H,s,-OMe)。通过对比已知化合物的物理数据以及波谱数据,与文献[5]对比一致,故确定其为木脂素二聚体(herpetol )。
化合物2白色无定形粉末(C16H14O6);HR-ESI-MSm/z325.0674 [M+Na]+;1H NMR (400 MHz,Chloroform-d)δ:8.12 (1H,s,H-1′),7.89 (1H,s,H-4′),6.93 (1H,d,J=2.8 Hz,H-6),6.88 (1H,d,J=2.8 Hz,H-8),5.83 (1H,s,-CH2OH),5.01 (2H,d,J=6.0 Hz,-CH2-),4.09 (3H,s,2′-OMe),3.87 (3H,s,7-OMe)。通过对比已知化合物的物理数据以及波谱数据,以上数据与文献[6]对比基本一致,故确定其为波棱内酯 A(herpetolide A)。
化合物3无色油状物(C20H24O7);HR-ESI-MSm/z399.1417 [M+Na]+;1H NMR (400 MHz,Acetone-d6)δ: 7.56 (1H,s,-OH),7.04 (1H,d,J=1.8 Hz,H-2′),7.00 (1H,d,J=1.7 Hz,H-2),6.84 (1H,dd,J=8.1,1.8 Hz,H-6′),6.83 (1H,d,J=8.1,1.8 Hz,H-6),6.79 (1H,d,J=8.1 Hz,H-5),6.78 (1H,d,J=8.1 Hz,H-5′),4.47 (1H,d,J=9.0 Hz,H-7′),4.44 (2H,d,J=9.0 Hz,H-9),3.85 (3H,s,-OMe),3.84 (3H,s,-OMe),3.67 (2H,dd,J=9.0,7.1 Hz,H-9′),3.62 (1H,m,H-8),3.51 (1H,t,J=8.6 Hz,H-8′),2.59 (1H,m,H-7),2.24 (1H,m,H-7)。通过对比已知化合物的物理数据以及波谱数据,与文献[7]对比一致,故确定其为(9R)-9-羟基落叶松脂醇[(9R)-9-hydroxylariciresinol ]。
化合物4淡黄色油状物(C17H18O6);HR-ESI-MSm/z341.0962 [M+Na]+;1H NMR (400 MHz,Acetone-d6)δ: 7.66 (1H,dd,J=8.3,2.0 Hz,H-6),7.59 (1H,d,J=2.0 Hz,H-2),6.99 (1H,d,J=1.9 Hz,H-2′),6.85 (1H,d,J=8.3 Hz,H-5),6.80 (1H,dd,J=8.1,1.9 Hz,H-6′),6.74 (1H,d,J=8.1 Hz,H-5′),4.82 (1H,dd,J=8.6,5.2 Hz,H-8),4.24 (1H,dd,J=10.4,8.8 Hz,H-9),3.87 (3H,s,-OMe),3.81 (3H,s,-OMe),3.70 (1H,dd,J=10.5,5.2 Hz,H-9)。通过对比已知化合物的物理数据以及波谱数据,与文献[8]对比一致,故确定其为楝叶吴萸素 B(evofolin-B)。
化合物5淡黄色油状物(C27H30O14);HR-ESI-MSm/z601.1526 [M+Na]+;1H NMR (400 MHz,Acetone-d6)δ: 12.69 (1H,s,-OH),7.89 (1H,d,J=8.8Hz,H-2′),7.89 (1H,d,J=8.8 Hz,H-6′),7.03 (1H,d,J=8.8 Hz,H-3′),7.03 (1H,d,J=8.8 Hz,H-5′),6.78 (1H,d,J=2.1 Hz,H-8),6.47 (1H,d,J=2.1 Hz,H-6),5.64 (1H,d,J=1.4 Hz),5.54 (1H,d,J=1.4 Hz),4.22 (1H,br s),4.05 (1H,br s),3.84 (1H,d,J=3.2 Hz),3.70 (1H,m),3.60 (1H,m),3.50 (1H,m),3.34 (1H,m),1.22 (3H,d,J=6.1 Hz),0.90 (3H,d,J=5.7 Hz)。通过对比已知化合物的物理数据以及波谱数据,与文献[9,10]对比一致,故确定其为山奈苷(kaempferol 3,7-O-α-L-dirhamnoside)。
化合物6白色无定型粉末(C30H34O9);HR-ESI-MSm/z561.2116 [M+Na]+;1H NMR (400 MHz,Acetone-d6)δ:7.63 (1H,s,4-OH),7.46 (1H,s,3"-OH),7.04 (1H,d,J=1.8 Hz,H-2),6.94 (1H,d,J=1.5 Hz,H-2"),6.89 (1H,dd,J=8.2,1.8 Hz,H-6),6.80 (1H,d,J =8.1 Hz,H-5),6.76~6.78 (3H,m,H-6′,5",6"),6.74 (1H,br s,H-2′),5.52 (1H,d,J=6.7 Hz,H-7),4.78 (1H,d,J=6.2 Hz,H-7"),4.12 (1H,m,H-9′),3.97 (1H,dd,J=8.6,6.2 Hz,H-9′),3.85 (2H,m,H-9"),3.83 (3H,s,3-OMe),3.81 (6H,s,3′,4"-OMe),3.68 (1H,dd,J=8.0,6.8 Hz,H-9),3.52 (1H,dd,J=12.6,6.5 Hz,H-8"),2.97 (1H,m,H-7′),2.71 (1H,m,H-8),2.55 (1H,m,H-7′),2.31 (1H,m,H-8′)。根据以上波谱数据与文献[12]的对照,信息基本一致,故确定其为波棱素(herpetin)。
化合物7无色油状物C30H32O10;HR-ESI-MSm/z575.1858 [M+Na]+;1H NMR (400 MHz,Chloroform-d)δ:7.60 (1H,dd,J=8.3,1.8 Hz,H-6),7.58 (1H,d,J=1.8 Hz,H-2),6.87 (1H,d,J=8.3 Hz,H-5),6.87 (1H,d,J=1.8 Hz,H-2′′),6.81(1H,d,J=8.2 Hz,H-5′′),6.77~6.79 (2H,m,H-2′,6′′),6.60 (1H,d,J=1.5 Hz,H-6′),5.20 (1H,dd,J=8.1,4.6 Hz,-CH2OH),4.68 (1H,d,J=5.1 Hz,H-7′),4.59 (1H,d,J=5.1 Hz,H-7′′),4.13~4.24 (3H,m,H-9,9′,9′′),3.89 (6H,s,3,3′-OMe),3.87 (3H,s,3′′-OMe),3.77~3.86 (3H,m,H-8,9′,9′′),2.93~3.07 (2H,m,H-8′,8′′)。与文献[13]对比基本一致,故确定其为木脂素三聚体(herpetrione)。
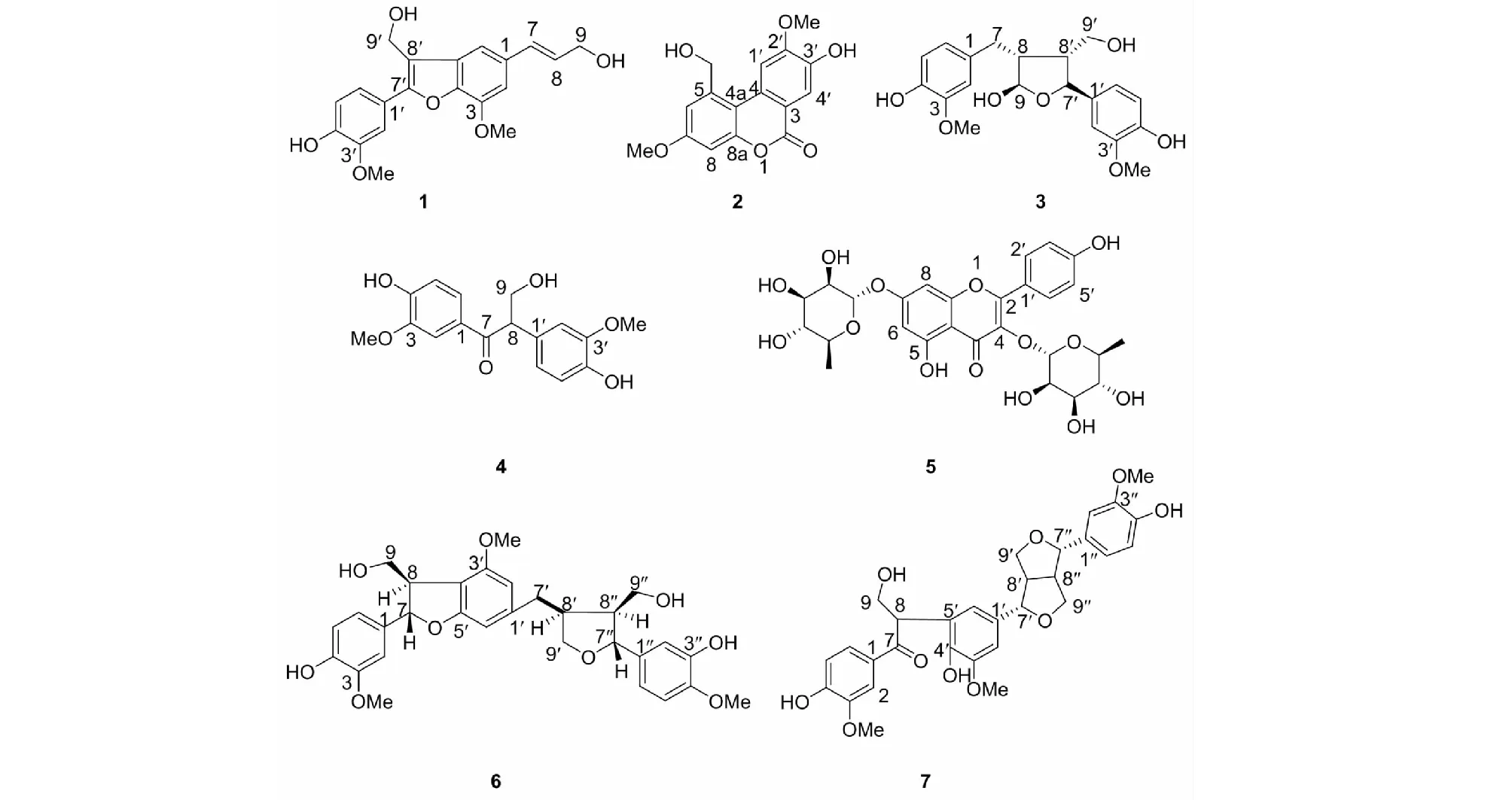
图1 化合物1~7的化学结构Fig.1 The chemical structures of compounds 1-7
4 活性测试
4.1 抗菌活性研究
使用镊子夹取牙签(已灭菌)挑取平板上的单菌落,并置于已灭菌的液体Mueller-Hinton培养基中,在35 ℃摇床中培养过夜,随后将80~500 μL菌液转接至新液体培养基中,用同样的方法培养2~6 h;将菌液稀释至麦氏标准0.5,并用无菌水稀释20倍,用排枪在96孔板中每个孔加20 μL,随后将化合物先后溶解于50 μL DMSO、无菌水中,配成10 μM浓度的药液,并在微孔中加入50 μL的无菌水,采用二倍稀释法稀释成一定梯度浓度。在96孔板中加入梯度浓度的药液,待微孔稀释板振荡混合后,在35 ℃摇床中培养16~20 h;最后,于有黑色背景光源处观察实验结果,有菌生长的孔底部有扣子样沉淀或呈现出弥漫型浑浊,无菌生长的孔所含的最低样品浓度即为该样品的最小抑菌浓度MIC[14,15]。
4.2 活性测试结果
对所分离得到的7个单体化合物进行了抗菌活性实验,以链霉素为阳性对照,结果如下(见表1):在10 μM的浓度下,除化合物6和7对白色念珠菌(CandidaalbicansATCC 14053)具有一定的抑制活性外,其余大部分单体化合物对白色念珠菌,新型隐球酵母(CryptococcusneoformansACCC 20337),枯草芽孢杆菌(BacillussubtilisCICC 10285)和耻垢分枝杆菌(MycobacteriumsmegmatisCGMCC 1.562)并没有表现出良好的抑制活性。
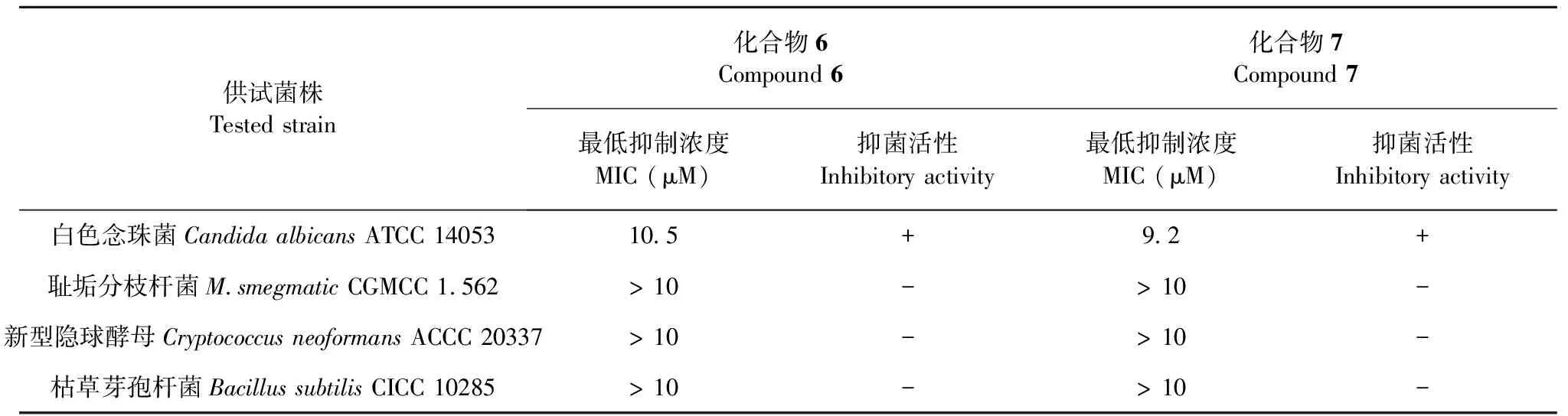
表1 部分化合物的抗菌活性测试结果
注:MIC代表最低抑制浓度;“+”表示具有较好的抑制活性;“-”表示测试浓度(10 μM)下没有显著的抑制活性。
Note:MIC represents minimum inhibition concentration;“+” shows good inhibitory activity;“-” shows no significant inhibitory activity (Concentration:10 μM).
5 讨论
作为藏药常用药,波棱瓜子具有较好的药理活性和疗效[3] [11],但其药理活性的报道主要还是以其粗提物或不同的极性部位为主,其单体化合物药理活性的研究报道较少,因此从波棱瓜子中获得单体化合物,丰富天然产物的类型,并进行活性研究是阐明其药用价值的关键。本实验从波棱瓜子乙酸乙酯部位分离得到7个酚性成分,其中包括6个木脂素类、1个黄酮苷类化合物,抗菌活性实验结果表明,波棱瓜子中木脂素类成分Herpetin(6)和Herpetrione(7)有可能是波棱瓜子具有抗白色念珠菌活性的药效物质基础之一,但这些化合物抗白色念珠菌活性的作用机制还需要做进一步探讨。同时,波棱瓜子乙酸乙酯部位可能还有更多木脂素类和黄酮苷类化学成分未被发现或报道,存在一定的研究价值,能够为波棱瓜子化学成分和药理活性的深入研究提供重要参考,从而进一步促进其研究与开发。
致谢:南京大学医药生物技术国家重点实验室功能生物分子研究所测试所有波谱数据,同时,特别感谢南京大学生命科学学院硕士研究生张雯景和邓欣召在活性测试方面给予的帮助。

