咪唑修饰萘酰亚胺与DNA的作用及其细胞毒性
高云燕,蔡温姣,欧植泽,马拖拖,倚 娜,李志远
西北工业大学理学院应用化学系,空间应用物理与化学教育部重点实验室,西安 710072
1 引言
萘酰亚胺为平面芳香性杂环化合物,可通过插入作用或沟槽结合与双链DNA作用,影响DNA的复制,阻断细胞的分裂过程,表现出良好的抗肿瘤活性1。其中米托萘胺(mitonafide)和氨萘非特(amonafide)两种萘酰亚胺衍生物已进入对实体肿瘤的药物临床III期研究阶段2,3。但这些化合物还存在剂量限制性骨髓毒性、神经毒性和血液毒性等毒副作用。在萘酰亚胺芳香环上引入异恶唑烷4、炔基5、吗啡啉6、多胺7,8等活性基团,或者在3位和4位并入各类芳香环如噻唑杂环、噻二唑、硫杂环等9–11,可得到相应的衍生物。这些衍生物与双链DNA的结合常数可达105–106L·mol-1,能有效改善萘酰亚胺母体的抗肿瘤活性。传统的萘酰亚胺药物以双链DNA为靶点,对DNA的序列或结构选择性较差,容易引起毒副作用12,13。针对特定的核酸序列或者与 DNA作用相关的蛋白质进行药物设计,是近年来抗肿瘤药物研究的一个重要发展趋势14–17。近年来进入临床试验的萘酰亚胺类药物UNBS5162和DMP-840可与DNA作用,降低拓扑异构酶活性并发挥药效,具有抗癌活性高、毒副作用小的特点,已用于实体肿瘤和淋巴瘤的治疗18。进一步研究萘酰亚胺与DNA结合过程中对序列选择性和结合强度的影响因素,有利于开发出靶向性更强的药物19。
在人体端粒末端和原癌基因启动子中存在大量可形成G-四链体的富含G-碱基序列20。G-四链体的形成会抑制端粒酶的活性或者相关基因的转录和表达,而 G-四链体 DNA解链后相关基因的转录或表达功能将恢复21,22。85%以上的恶性肿瘤细胞,如乳腺癌、结肠癌、以及小细胞肺癌等多种实体肿瘤中端粒酶表达呈阳性,而正常体细胞中通常无端粒酶的表达。部分以G-四链体为靶点的化合物对癌细胞有较强的抑制作用,而对正常细胞的毒性相对较小,其中Quarfloxin (CX-3543)已经进入临床试验阶段并取得了良好的疗效23,24。因此,设计合成能诱导G-四链体形成并稳定其结构的化合物,已成为国内外肿瘤靶向治疗的新策略25–28。萘酰亚胺衍生物作为一类临床使用药物,与G-四链体的相互作用也受到了研究者的关注。单取代萘酰亚胺与G-四链体的作用较弱,而多取代萘酰亚胺衍生物与G-四链体作用较强,并表现出良好的抗癌活性29,30。三联吡啶铂配合物和硫脲基团修饰的萘酰亚胺与G-四链体具有很强的相互作用,表现出对癌细胞的选择性细胞毒性31,32。但是萘酰亚胺衍生物对G-四链体稳定性的影响,以及靶向G-四链体萘酰亚胺衍生物的结构与活性的关系尚未得到深入研究33。
含有咪唑及其衍生物的药物被广泛用于临床。近年来的研究表明,多取代咪唑基团可作为G-四链体稳定剂34–36。咪唑阳离子化合物与磷酸根有很强的静电相互作用,常用于识别磷酸基团37,38。含咪唑阳离子的芘或萘二酰亚胺等芳香化合物对G-四链体有良好亲和性和选择性39,40。本文将咪唑和N-烷基化的咪唑阳离子基团引入萘酰亚胺,以增强萘酰亚胺衍生物与G-四链体的结合能力。了解咪唑衍生物结构对萘酰亚胺与 DNA作用和抗癌活性的影响,利用AutoDock分子对接方法进行计算机虚拟筛选,为开发新型萘酰亚胺类抗癌药物提供理论据。
2 实验部分
2.1 试剂与仪器
碘代正辛烷(分析纯),溴代正辛烷(分析纯),溴代十六烷(分析纯),购自梯希爱(上海)化成工业发展有限公司。1-(4,5-二甲基-2-噻唑基)-3,5-二苯基甲臢(MTT,分析纯),4′,6-二氨基-2-苯基吲哚(DAPI,分析纯),小牛胸腺DNA (CT DNA,分析纯),4-溴-1,8-萘二甲酸酐(分析纯)购自 Sigma-Aldrich 公 司 (美 国)。 FHtelo(5′-FAM-GGG-TTAGGG-TTAGGG-TTA-GGG-TAMRA-3′)和 Htelo(5′-GGG-TTA-GGG-TTA-GGG-TTA-GGG-3′)均 由 上海生工合成并纯化。其他溶剂和化学药品均为分析纯,购自北京化工。除非另有说明,光谱滴定实验都在含有 0.1 mol·L-1K+的 Tris-HCl (10 mmol·L-1,pH 7.4)的缓冲溶液进行。所有有机溶剂均经过干燥重蒸后使用。
所用仪器:核磁共振氢谱由BrukerAvance 400核磁共振仪(瑞士,400 MHz)测定,核磁共振碳谱由BrukerAvance 600 (瑞士)核磁共振仪(碳谱 150 MHz)测定,荧光数据皆在 Hitachi F-4500荧光光谱仪(日本)上测定,紫外可见吸收光谱用 Hitachi UV-3010紫外可见分光光度计(日本)测定,细胞成像实验所用仪器为Olympus IX70 (日本)。
2.2 化合物合成
2.2.1 化合物2的合成
4-溴-1,8萘二甲酸酐(1.5 g,5.4 mmol)分散于10 mL乙二醇乙醚中,加入吗啡啉(0.94 mL,10.8 mmol),在氮气气氛下130 °C反应24 h。除去溶剂后,利用硅胶柱色谱分离(THF/CHCl3的体积比为1/4),得黄色固体1.33 g,产率86%。1H NMR(CDCl3,400 MHz) δ:8.60–8.58 (d,1H,J = 7.2),8.54–8.48 (m,2H),7.78–7.75 (m,1H),7.29–7.26(m,1H),4.07–4.05 (m,4H),3.36–3.33 (m,4H)。
2.2.2 化合物3的合成
化合物2 (0.5 g,1.7 mmol)溶于15 mL吡啶中,逐渐加入 1-(3-氨基丙基)-咪唑(248 g,2.04 mmol),在氮气气氛下100 °C反应24 h得到棕红色澄清液,除去溶剂后,利用硅胶柱色谱分离(THF/CHCl3的体积比为 1/2)。得黄色固体 0.573 g,产率 83.2%。1H NMR (CDCl3,400 MHz) δ:8.61–8.59 (d,1H,J = 7.2),8.55–8.53 (d,1H,J =8.0),8.46–8.44 (d,1H,J = 8.0),7.75–7.71 (m,1H),7.59 (s,1H),7.29–7.24 (m,1H),7.06–7.03(d,2H,J = 10.4),4.26–4.29 (m,2H),4.11–4.03(m,6H),3.30–3.28 (m,4H),2.31–2.24 (m,2H)。13CNMR (CDCl3,150 MHz) δ:164.50,164.01,155.96,137.08,132.81,131.41,130.43,129.94,129.18,126.15,125.92,123.02,118.78,116.74,115.03,66.95,53.46,45.10,37.56,29.69。MS(MALDI-TOF):[M+] 391.1,cacld for C22H22N4O3,390.4。
2.2.3 化合物4a–c的合成
化合物3 (0.3 g,0.76 mmol)分散于15 mL重蒸乙腈中,并转移至水热反应釜中,搅拌,缓慢滴加卤代烷(2.28 mmol),100 °C反应24 h。得到黄色澄清液,除去溶剂后采用硅胶柱色谱分离(甲醇/CHCl3的体积比为1/25),得黄色固体。
4a:产率 63.6%。1H NMR (CDCl3,400 MHz)δ:10.05 (s,1H),8.54–8.47 (m,2H),8.41–8.39(d,1H,J = 8.4),7.78–7.68 (m,2H),7.52 (s,1H),7.23–7.21 (d,1H,J = 8.0),4.50–4.38 (m,4H),4.21–4.18 (m,2H),4.03–4.01 (m,4H),3.18–3.27(m,4H),2.45–2.41 (m,2H),2.02–1.88 (m,3H),1.38–1.26 (m,9H),0.88–0.84 (m,3H)。13C NMR:(DMSO-d6,150 MHz) δ:163.77,163.24,155.55,136.11,132.22,130.68,130.66,129.22,126.12,125.23,122.61,122.42,122.34,115.84,115.04,66.15,53.02,48.84,46.98,36.46,31.12,29.25,28.44,18.29,25.42,22.02,13.89。MS (MALDITOF):[M-I]+503.3,cacld for C33H39N4O3,503.6。
4b:产率70%。1H NMR (CDCl3,400 MHz)δ:10.50 (s,1H),8.55–8.40 (m,3H),7.77–7.67(m,2H),7.47 (s,1H),7.24–7.22 (d,1H,J = 8.0),4.50–4.39 (m,4H),4.22–4.19 (m,2H),4.04–4.02(m,4H),3.29–3.26 (m,4H),2.46–2.40 (m,2H),2.00–1.93 (m,2H),1.30–1.23 (m,9H),0.88–0.85(m,3H)。13C NMR (DMSO-d6,150 MHz) δ:163.78,163.25,155.57,136.13,132.22,130.69,130.61,129.27,126.11,125.26,122.63,122.43,122.35,115.85,115.05,66.15,53.03,48.84,46.99,36.47,31.11,29.25,28.43,28.29,25.42,22.01,13.88。MS(MALDI-TOF):[M-Br]+503.2,cacld for C30H39BrN4O3,503.6。
4c:产率 70%。1H NMR(CDCl3,400 MHz) δ:10.48 (s,1H),8.55–8.40 (m,3H),7.76–7.68 (m,2H),7.45 (s,1H),7.23–7.21 (d,1H,J = 8.0),4.51–4.39 (m,4H),4.22–4.19(m,2H),4.04–4.02(m,4H),3.28–3.27 (m,4H),2.45–2.40 (m,2H),2.03–1.93(m,3H),1.24(m,25H),0.90–0.86(m,3H)。13C NMR (DMSO-d6,150 MHz) δ:(163.75,163.24,155.56,136.16,132.22,130.69,130.66,129.22,126.10,125.25,122.61,122.44,122.38,115.84,115.02,66.15,53.03,48.84,46.97,36.43,31.25,29.24,28.99,29.94,28.87,28.79,28.65,28.34,28.25,25.39,22.05,13.91。MS(MALDITOF):[M-Br]+615.5,cacld for C38H55N4O3,615.8。
2.3 摇瓶法测定化合物亲脂性系数(log P)
将 4 mL 化合物 (50 μmol·L-1)的缓冲溶液(Tris-HCl,pH 7.4,10 mmol·L-1)与等体积的正辛醇混合,室温搅拌24 h后,在2500 r·min-1条件下离心 9 min,利用紫外-可见吸收光谱测定化合物在缓冲溶液相浓度Cw和正辛醇相中的浓度Co,采用公式log P = log (Co/Cw)计算出化合物的亲脂性系数log P,每次实验均重复进行三次,取平均值。
2.4 滴定实验
配制 40 μmol·L-1的萘酰亚胺衍生物的缓冲溶液 1.0 mL (Tris-HCl,pH 7.4,0.1 mol·L-1KCl),逐渐滴加DNA溶液,并在参比溶液中加入相应浓度的 DNA,室温静置 15 min后,测定化合物与DNA混合溶液的紫外-可见吸收光谱。利用公式(1)求得化合物与DNA的结合常数:

式中 D 为 DNA 的浓度。Δεap= ǀεa- εfǀ,Δε = ǀεb-εfǀ。εa为化合物的表观摩尔消光系数 εa= Aobs/[化合物],即用加入不同浓度 DNA后化合物的吸光度值Aobs除以化合物浓度得到。εf为未加入DNA时,化合物的摩尔消光系数。εb为所有的化合物与DNA结合后的摩尔消光系数。Ka为化合物与DNA的结合常数。采用D/Δεap与D作图,利用线性拟合后得到的斜率除以相应的截距,进而求得Kα。
荧光光谱滴定实验过程中,先配制化合物(5 μmol·L-1)的缓冲溶液,分别加入不同浓度DNA,室温静置15 min进行荧光光谱测试,激发波长为402 nm,扫描范围为425–700 nm。
2.5 CT DNA粘度测定
将乌氏粘度计置于 25 °C恒温水浴槽中,分别测定Tris-HCl缓冲溶液、DNA溶液和萘酰亚胺衍生物与DNA的混合溶液流经毛细管所需时间。CT DNA 的浓度固定为 100 μmol·L-1,每个样品重复测定5次,取平均值,各次测量值相差小于0.5 s。按照公式η = (t - t0)/t0计算相对粘度,其中t0为缓冲溶液流经毛细管所需时间,t为不同浓度萘酰亚胺衍生物与 DNA的混合溶液流经毛细管所需时间,η0为没有加入萘酰亚胺衍生物时DNA溶液的相对粘度。以(η/η0)1/3对萘酰亚胺衍生物浓度与DNA浓度的比值作图,得到DNA的粘度变化曲线。
2.6 圆二色谱(CD)光谱实验
在缓冲溶液中加入 20 μmol·L-1的 G-四链体和 40 μmol·L-1的化合物,4 °C 静置过夜后,在230–500 nm范围内扫描CD光谱图。扫描速率100 nm·min-1,带宽1 nm,读数5次,响应时间1 s。
2.7 荧光共振能量转移 (FRET)熔温测定实验
配制 Tris-HCl (10 mmol·L-1,pH 7.4),0.1 mol·L-1Li+,20 mmol·L-1K+的缓冲溶液,加入FHtelo G-四 链 体 (0.2 μmol·L-1), 化 合 物 (1.0 μmol·L-1),混合均匀后,冰箱静置过夜。由 27 °C逐渐加热到 96 °C,升温速度控制为 1 °C·min-1。以 494 nm为激发波长,测定 FHtelo在 505–700 nm范围内的荧光光谱。将G-四链体在523 nm处的荧光强度变化值进行归一化后对温度作图,中间拐点处的温度即为G-四链体的熔解温度。
2.8 分子对接
为深入了解目标化合物与G-四链体的结合模型,采用AutoDock (4.2版本)对目标化合物和G-四链体的相互作用进行了分子对接模拟。运用Gaussian 09中密度泛函理论方法B3LYP41,选取6-31G(d)基组对化合物进行几何优化,获得目标化合物能量最低的构象。人体端粒G-四链体的晶体结构模型在蛋白质数据库获得,其 PDB文件为1KF1,AutoDock过程进行了简化处理,将 DNA整体结构始终设定为刚性,而允许对接化合物有可以转动的键。使用拉马克遗传算法(LGA)对可能的构象和结合位点进行搜索,计算出最有可能的100种构象,从而分析得到化合物与DNA的结合模式和作用方式。
2.9 细胞荧光成像
将细胞与化合物和 4’,6-二脒基-2-苯基吲哚(DAPI)孵育 4.0 h后,用磷酸缓冲溶液(PBS)洗涤三次。使用 Olympus IX70荧光显微镜进行细胞成像。DAPI的荧光用405 nm的激光激发,测量范围为425到475 nm;萘酰亚胺衍生物的荧光用488 nm的激光激发,测量范围为500–600 nm。荧光图像用Olympus FV10-ASW 1.6 viewer software处理。
2.1 0 体外细胞毒性实验
采用MTT还原法进行检测。取对数生长期的A549和 MRC-5细胞,调整细胞密度为 1 × 106mL-1,分装于96孔板中,每孔加入上述细胞悬液100 μL。第2天分别加入不同浓度的目标化合物,每个浓度设6个平行孔,细胞培养72 h。弃去培养基后,用磷酸缓冲溶液冲洗两次,每孔中各加入200 μL 新鲜的培养基和 MTT (5 mg·mL-1) 10 μL,再继续培养 4 h后取出。吸去上清液,每孔加入150 μL DMSO,再将培养板震荡均匀20 min左右,在酶标仪上测定各孔的吸光度(OD),测定波长为570 nm,记录结果,并按下列公式计算出被测物对癌细胞生长的抑制率。根据公式(2)计算细胞生长抑制率:

3 结果与讨论
3.1 化合物的合成
G-四链体是一种有别于双链 DNA的核酸二级结构,它由G碱基通过Hoogsteen氢键作用形成G-四集体,并进一步堆积形成。最近的研究发现,在寨卡病毒和艾滋病毒(HIV)的基因末端也存在富含G-碱基的链段,并能形成G-四链体42,43,因此以G-四链体为靶点进行筛选和结构设计是抗肿瘤药物研究的热点之一。与G-四链体作用的化合物大多具有平面芳香大共轭结构且带正电荷,可通过堆积作用和静电作用等多种结合模式稳定G-四链体结构。将咪唑和咪唑阳离子等基团引入萘酰亚胺衍生物,有望提高与G-四链体的结合能力及抗癌活性44,45。本文以 4-溴萘二甲酸酐为原料,通过亲核取代反应合成4-吗啡啉萘二甲酸酐,进一步与胺丙基咪唑反应得到含咪唑基团的萘酰亚胺衍生物3 (图1)。将3与卤代烷反应,得到含有咪唑阳离子的萘酰亚胺衍生物 4a–c,利用1H NMR,13C NMR和质谱对化合物的结构进行了表征(图 S1–S13 (Supporting Information))。化合物 4a和4b均为正辛基取代的咪唑阳离子衍生物,对离子分别为碘离子和溴离子,其亲脂性系数(log P)分别为 1.43和 0.76。化合物 4c的烷基链为十六烷基,其亲脂性更强(log P = 1.71,表S1)。化合物3和4a–c的亲脂性有利于提高细胞吸收,增强细胞毒性46。

图1 含咪唑基团萘酰亚胺衍生物的合成路线Fig.1 Synthetic route for the naphthalimide derivatives containing imidazole moiety.
3.2 紫外-可见吸收光谱滴定
在3的缓冲溶液中加入双链CT DNA后,285和402 nm处的吸收峰强度下降,且402 nm处的减色效应大于30% (图2a)。以402 nm处吸光度的变化值对DNA浓度作图,并进行线性拟合,求得3 与 CT DNA 的结合常数为 1.40 × 104L·mol-1(表1)。加入CT DNA后,化合物4a–c在300–500 nm范围内的吸光度也明显下降(图 S14 (Supporting Information))。与双链DNA作用的强弱顺序为:4c > 4b ≈ 4a > 3,说明咪唑正离子的修饰可增强萘酰亚胺衍生物与双链DNA的作用47。

图2 (a) CT DNA和(b) Htelo G-四链体DNA对3(40 µmol·L-1)吸收光谱的影响Fig.2 UV-Vis titration of 3 (40 µmol·L-1) with (a) CT DNA and (b) Htelo G-quadruplex in Tris-HCl buffer(10 m mol·L-1,pH 7.4) containing 0.1 mol·L-1 KCl.
化合物3与Htelo G-四链体的相互作用也可由吸收光谱检测。Htelo G-四链体的加入可引起3的吸收峰强度下降(图 2b),利用线性拟合可求得二者的结合常数为 7.8 × 106L·mol-1(表 1)。化合物4a-c和Htelo G-四链体DNA也具有很高的亲和性(Ka> 4 × 106L·mol-1) (图 S15 (Supporting Information)),与文献报道的多取代萘酰亚胺衍生物30,苝二酰亚胺衍生物48,金属配合物等相当49。化合物3和4a-c与Htelo G-四链体的结合常数是其与双链DNA结合常数的30倍以上,说明3和4a-c可作为G-四链体的稳定剂。化合物4b对G-四链体 DNA的亲和力高于 4a,表明阴离子种类也可影响化合物与DNA的作用50。在紫外滴定过程中没有观察到等吸收点,表明化合物与CT DNA及G-四链体的作用存在多种结合模式32。

表1 紫外-可见吸收光谱测定的萘酰亚胺衍生物与双链CT DNA和Htelo G-四链体的结合常数(Kα,L·mol-1)Table1 Association constant (Kα,L·mol-1) of naphthalimide derivatives with duplex CT DNA and Htelo G-quadruplex DNA determined by UV-Vis spectroscopy.
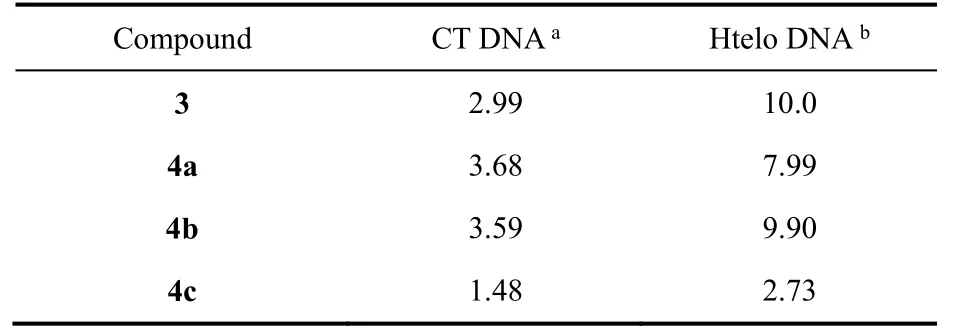
表2 双链CT DNA和Htelo G-四链体DNA对萘酰亚胺衍生物荧光强度的影响Table2 Effects of double-stranded CT DNA and Htelo G-quadruplex DNA on the fluorescence enhancement(F/F0) of naphthalimide derivatives.
3.3 荧光光谱滴定
4-胺基取代的萘酰亚胺衍生物的荧光对环境比较敏感,利用荧光光谱可以了解萘酰亚胺衍生物与DNA作用后所处化学环境的变化51。CT DNA的加入可使 3和 4a–c的荧光增强(图 S16(Supporting Information))。当CT DNA与化合物的浓度比为20时,化合物的荧光可增强至1.48–3.68倍(图3和表2)。Htelo G-四链体DNA的加入可使3和4a–b的荧光强度增加7倍以上,而4c的荧光增强 1.73倍(图 S17 (Supporting Information))。这表明取代基对萘酰亚胺衍生物与 DNA的作用有影响52。萘酰亚胺衍生物3和4a-c可作用于G-四链体的疏水区域,减小水分子对化合物的荧光猝灭,从而使荧光增强,这与化合物在低极性溶剂中荧光较强的性质相符合(图 S18 (Supporting Information))53。
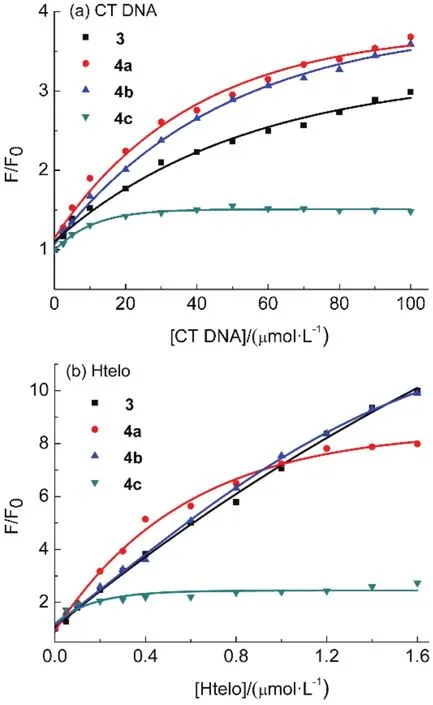
图3 不同浓度的(a) CT DNA和(b) Htelo G-四链体DNA后,萘酰亚胺衍生物的荧光强度变化Fig.3 The fluorescence enhancement (F/F0) of naphthalimide derivatives upon addition of(a) CT DNA and (b) Htelo G-quadruplex.
3.4 DNA的粘度研究
DNA的粘度对其分子长度的变化非常敏感,是判断小分子与DNA结合方式的重要依据54。小分子与DNA发生插入作用会使DNA相邻碱基之间的距离增大,双螺旋伸长,粘度增加;而发生静电作用或沟槽结合时,DNA的粘度不会发生明显变化55,56。为进一步确定萘酰亚胺衍生物与双链DNA的作用方式,用乌式粘度计在25 °C测定了CT DNA在3、4a-c、EB存在下的粘度变化。如图4所示,CT DNA的相对粘度随着萘酰亚胺衍生物浓度的增大而明显增大,说明萘酰亚胺衍生物与 CT DNA的作用方式为插入作用1。化合物4a-c对 DNA粘度的影响与典型的 DNA插入剂EB相当,而3对DNA粘度的影响小于EB,表明在萘酰亚胺衍生物中引入正电荷有利于插入作用。
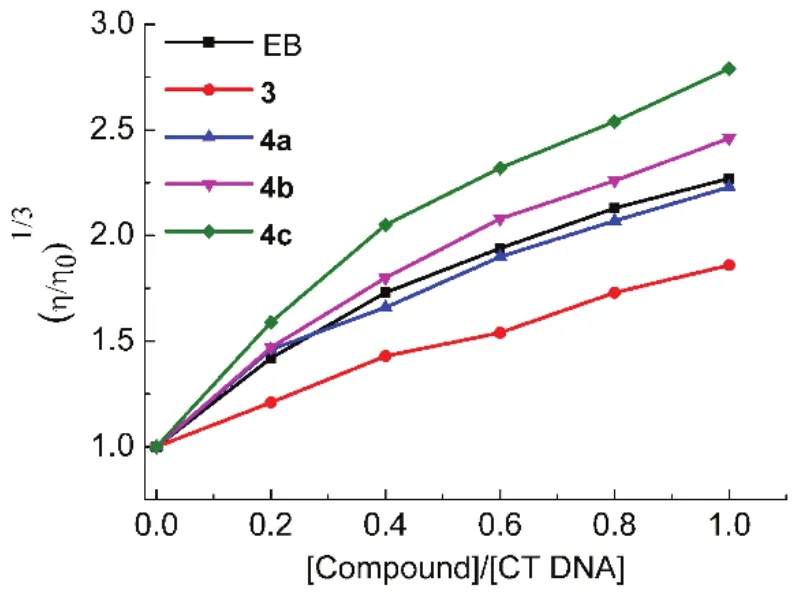
图4 在含有 0.1 mol·L-1 KCl的 Tris-HCl (10 mmol·L-1,pH 7.4)缓冲溶液中不同浓度萘酰亚胺衍生物和EB对CT DNA (0.1 mmol·L-1)粘度的影响Fig.4 Effect of naphthalimide derivatives and EB on the relative viscosity of CT DNA (0.1 mmol·L-1) in Tris-HCl(10 mmol·L-1,pH 7.4) buffer containing 0.1 mol·L-1 KCl.
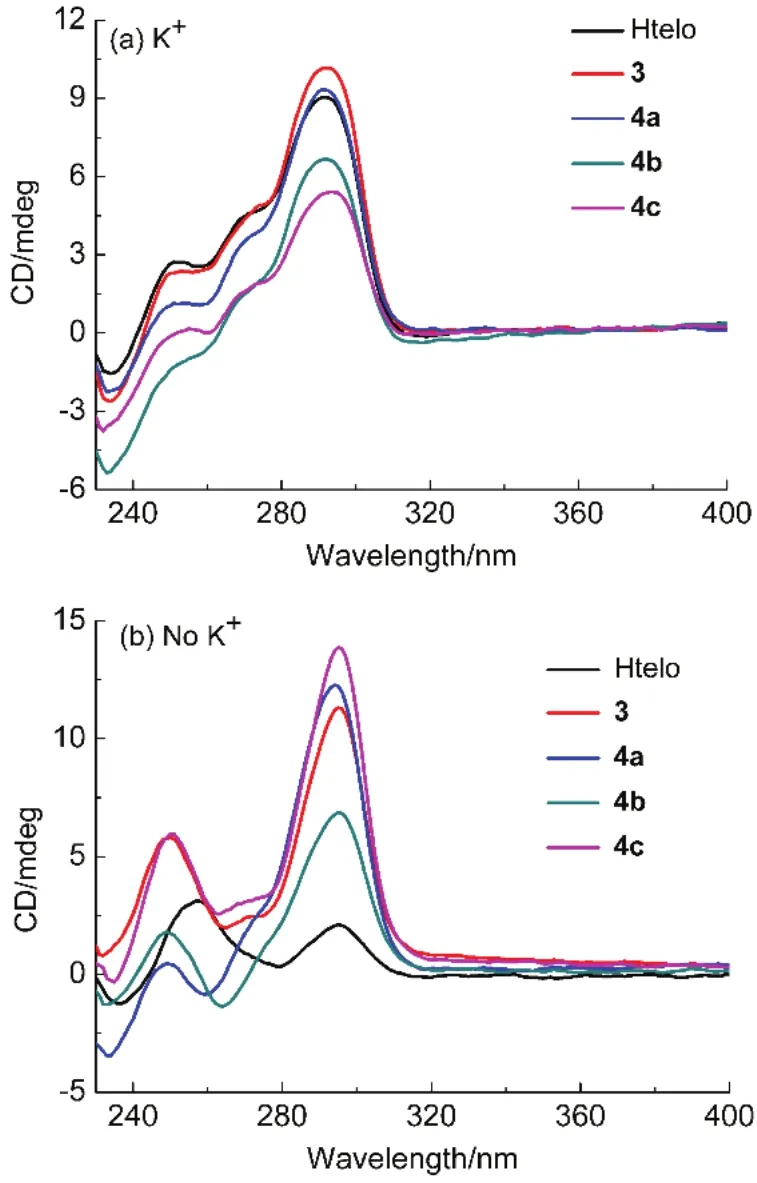
图5 (a)含K+和(b)不含K+的Tris-HCl缓冲液中,加入化合物3,4a-c对Htelo G-四链体CD谱的影响Fig.5 CD spectra of Htelo (20 µmol·L-1) inTris-HCl (10 mmol·L-1,pH 7.4) upon addition of 3,4a-c(40 µmol·L-1) (a) in the presence of 0.1 mol·L-1·K+ and (b) in the absence of K+ .
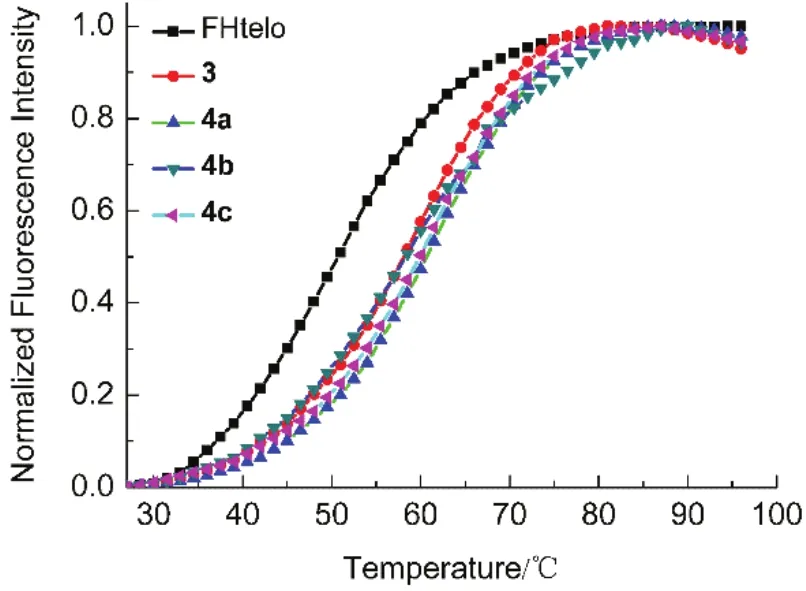
图6 化合物3,4a-c对FHtelo G-四链体熔解温度(Tm)的影响Fig.6 Effect of naphthilimides 3,4a-c on the melting temperature (Tm) of FHtelo G-quadruplex[FHtelo] = 0.2 μmol·L-1;[3] = [4a] = [4b] = [4c] = 1.0 μmol·L-1
3.5 圆二色谱(CD)研究
在K+缓冲溶液中,Htelo G-四链体的CD谱在265、295 nm处各有一个正峰,是一种典型的混合型结构(图5a)。随着化合物3和4a–c的加入,CD信号峰基本不发生变化,表明Htelo G-四链体在这种条件下仍然保持混合型结构25–28。
在不含碱金属离子的 Tris-HCl缓冲溶液中,Htelo G-四链体的CD谱在255,295 nm处各有一个正吸收峰,表明它以未折叠结构和四链体的混合形式存在(图5b)。加入3和4c后,谱图没有明显变化,表明3和4c不能诱导未折叠的Htelo序列形成四链体结构。但是随着4a和4b的加入,在295 nm处的正峰强度增强,在265 nm左右出现负峰,但是与典型的反平行结构或平行结构G-四链体的 CD谱在峰位上还有差异,其具体构型还有待于进一步研究57。
3.6 荧光共振能量传递(FRET)研究
通过 FRET方法可以研究萘酰亚胺衍生物稳定端粒G-四链体的能力。如图6所示,FHtelo本身的熔解温度为 52.7 °C。加入化合物 3和 4a–c后,FHtelo的熔解温度分别变为58.3、63.2、60.9和 60.3 °C,其ΔTm分别为 5.8、10.7、8.4 和 7.8 °C,表明3、4a–c能够有效稳定FHtelo的四链体结构.
3.7 分子对接研究
为进一步了解萘酰亚胺与端粒 G-四链体DNA的结合模式,我们进行了分子对接研究58。采用密度泛函(DFT)对化合物进行结构优化后,再与端粒G-四链体DNA的晶体结构(PDB ID:1KF1)进行分子对接。在AutoDock分子对接过程中,常忽略 G-四链体稳定剂中阴离子对 DNA结合的影响59。因此我们仅研究3、4a和4c的分子对接。由图8可以看出,3、4a和4c的萘酰亚胺基团均位于TTA环和G-四分体形成的loop及沟槽区,存在疏水相互作用60。化合物 3的咪唑基团与DG16碱基2位上的氨基形成氢键,键长约为2.060 Å (1 Å = 0.1 nm,图7a,b)。咪唑基与DNA碱基之间的氢键可增强药物与DNA的相互作用61。化合物4a和4c中的季铵盐N原子与G-四链体的磷酸骨架的距离为 3 Å左右,表明存在静电相互作用(图7c–f)62。4c中的酰胺羰基与DG14碱基2位上的氨基之间还存在氢键作用(图 7e,f)。化合物3、4a和4c与G-四链体间存在疏水作用、静电相互作用或氢键等多种结合方式,因而与Htelo G-四链体间的结合常数较高。

图7 化合物 3 (a,b),4a(c,d)和 4c (e,f)与端粒 G-四链体DNA (PDB ID:1KF1)对接作用的模式图。红色虚线表示化合物与G-四链体间的氢键或静电作用Fig.7 Different views of the docked model of 3 (a,b),4a (c,d) and 4c (e,f) with telomeric G-quadruplex DNA(PDB ID:1KF1).The red dashed lines represent the hydrogen bonding or electrostatic interaction betweennaphthalimides and G-quadruplex.
3.8 细胞荧光成像
4-氨基萘酰亚胺基团有很好的荧光特性,因此可以通过荧光成像了解化合物的细胞分布。将A549细胞分别用3、4b以及细胞核定位染料4’,6-二氨基-2-苯基吲哚(DAPI)在37 °C孵育4 h后,在细胞核内可以明显观察到 DAPI的蓝色荧光,3和4b的黄绿色荧光(图8)。但是3孵育的细胞,除了细胞核内有明显的荧光外,在其他区域还可观察到一些分散的弱绿色荧光(图8a,c)。这说明4b比3能够更快地进入细胞核。化合物4a和4c的细胞成像结果与4b相似,与A549细胞作用4 h后主要位于细胞核(图S19 (Supporting Information))。化合物4a–c带有正电荷,且具有合适的亲疏水性,因而可以快速进入细胞核31,50。这些结果表明,本文合成的咪唑基团修饰萘酰亚胺具有与 DAPI相似的细胞渗透性并且可用于细胞核定位。
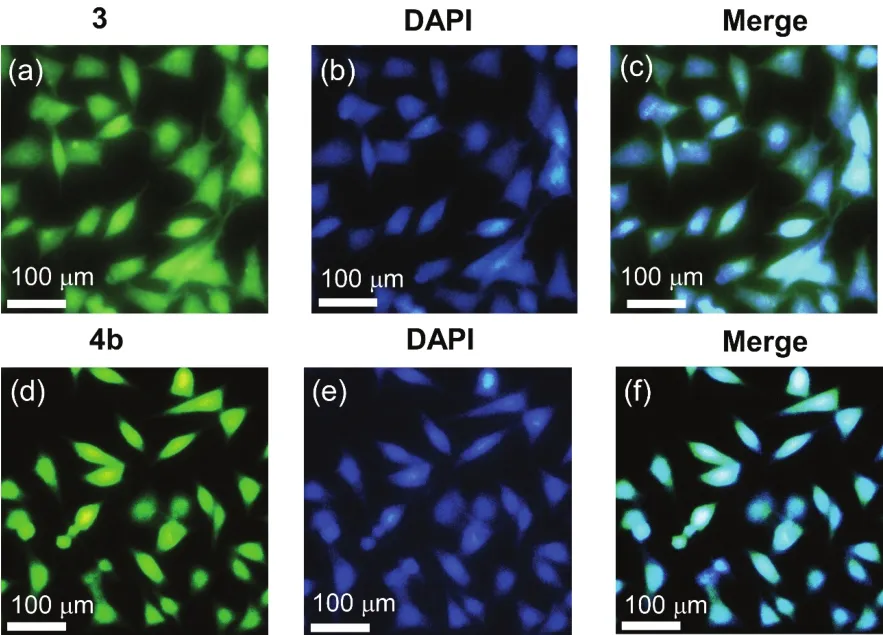
图8 A549细胞用化合物(a) 3,(d) 4b,及DAPI (b,e)孵育4.0 h后的荧光成像。(c) 图 (a)和(b)的叠加图;(f) 图(d)和(e)的叠加图Fig.8 Fluorescence images of A549 cells incubated with(a) 3,(d) 4b ,and DAPI (b,e) for 4.0 h.(c) merged image of(a) and (b);(f) merged image of (d) and (e).
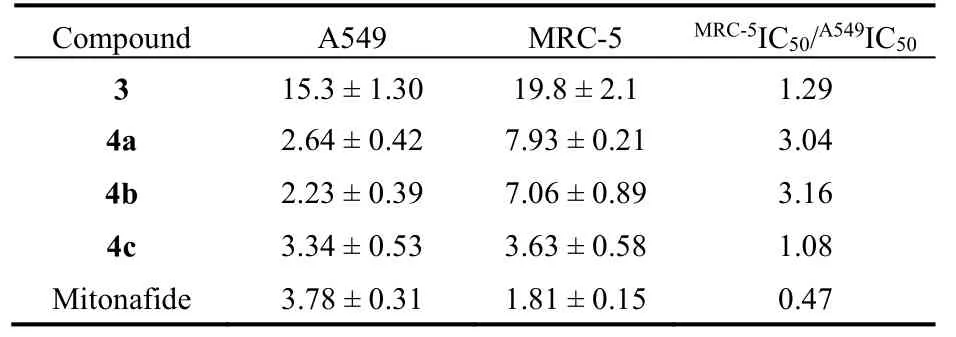
表3 萘酰亚胺衍生物对A549和MRC-5细胞的细胞毒性Table3 Data for the cytotoxicity (IC50,μmol·L-1) of naphthalimides against A549 and MRC-5 cells.
3.9 细胞毒性作用
文献报道能够稳定端粒 G-四链体 DNA的小分子化合物能够降低端粒酶的活性,从而抑制癌症细胞的无限增殖,因此好的 G-四链体稳定剂具有潜在的抗癌功效25–28。使用米托萘胺(Mitonafide)作为对照,通过MTT法测定3和4a–c对肺癌细胞A549的体外细胞毒性。经过72 h的孵育,3和4ac均表现出良好的抗癌活性(表 3和图 S20(Supporting Information))。化合物4a-c的 IC50值分别为 2.64、2.23 和 3.34 μmol·L-1,与临床药物米托萘胺(IC50= 3.78 μmol·L-1)相当,但它们对肿瘤细胞A549 的抑制作用明显强于 3 (IC50= 15.3 μmol·L-1),可能是由于含咪唑正离子的化合物能够更好的定位于细胞核(图8)。作为对照,我们也测定了这几种化合物对正常人胚肺成纤维细胞MRC-5的细胞毒性。化合物4a和4b对A549细胞比对非癌细胞MRC-5有更强的抑制作用,这表明4a和4b作为抗癌药物具有良好的应用前景。
4 结论
本文设计合成了含咪唑基团和咪唑阳离子的萘酰亚胺衍生物,所得化合物可通过疏水作用、氢键或静电作用等多种作用方式与人体端粒G-四链体 DNA结合,因而对 G-四链体具有较高的亲和性和选择性,并能够提高其熔解温度。咪唑修饰萘酰亚胺衍生物的化学结构对DNA结合,细胞毒性等性能有较大影响。化合物4a和4b可快速进入癌细胞A549的细胞核,表现出良好的细胞毒性。本文实验结果表明在酰胺位置上引入咪唑基团是增强萘酰亚胺衍生物与G-四链体等特定核酸序列结合能力的一个有效途径,并有望获得抗癌活性高、毒副作用小的药物。
Supporting Information: available free of charge via the internet at http://www.whxb.pku.edu.cn.

