锂离子电池归纳总结与典例解析
尉言勋 徐楠

电化学内容是高考的热点,新课标卷每年均会考查,题型以选择题为主,有时在原理科综合选择题或工艺流程题中以一小问的形式呈现。高考中的新型化学电源,一般具有高能环保、经久耐用、电压稳定、比能量高(单位质量释放的能量)等特点,因此,锂离子电池成了高考的高频考点。锂离子电池是一种理想的小型绿色电源,在生活中应用广泛,比如大家熟知的移动电话、笔记本电脑、小型摄像机等等。虽然题目情景较新,但落脚点往往还是离子的移动方向,电极方程式的书写判断等基础知识。解题原理仍然还是原电池的基本理论,只要细心分析,实际上得分相对比较容易。本文对锂电池及锂离子电池的考查进行归纳总结,希望对2020届的复习备考有所启发。
一、简介及电池组成
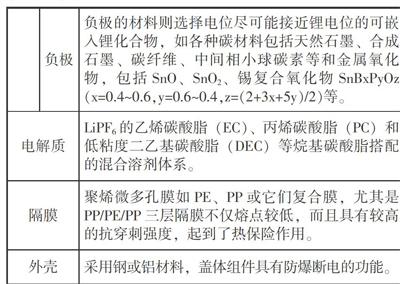
锂电池的负极材料是金属锂,正极材料是碳材、二氧化锰或亚硫酰氯等。比如:以前照相机里用的扣式电池。这种电池循环性能不好,在充放电循环过程中,容易形成锂结晶,造成电池内部短路,所以一般情况下是禁止充电的。
锂离子电池是由锂电池发展而来,以炭材料为负极、含锂化合物作正极,负极和正极材料均采用锂离子嵌入/脱嵌材料。在充放电过程中,没有金属锂存在,只有锂离子。当对电池进行充电时,正极的含锂化合物有锂离子脱出,锂离子经过电解液运动到负极。到达负极的锂离子嵌入到碳层的微孔中(负极的炭材料呈层状结构,有很多微孔),嵌入的锂离子越多,充电容量越高。当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。回正极的锂离子越多,放电容量越高。我们通常所说的电池容量指的就是放电容量。
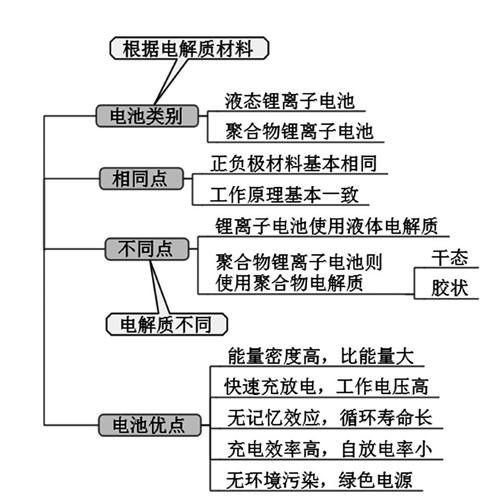
二、锂离子电池比较
三、典型锂电池及锂离子电池
1. LiFePO4电池(正极-LiFePO4,负极-Li,含Li+导电固体为电解质)。
负极:Li-e-=Li+
正极:FePO4+Li++e-=LiFePO4
总反应:FePO4+Li■LiFePO4
2. 锂硫电池(负极-Li,正极-S)。
负极:Li-e-=Li+
正极:S+2Li++2e- =Li2S
总反应:2Li+S■Li2S。
3. LiAlCl4电池(负极-Li,正极-石墨,电解液-LiAlCl4-SOCl2)。
负极:4Li-4e-=4Li+;
正极:2SOCl2+4e-=SO2↑+S+4Cl-。
电池总反应式:4Li+2SOCl2=SO2↑+4LiCl+S。
4. 常见的锂离子电极。
四、典例解析
1. 可充电锂-空气电池
【例1】(2018·新课标Ⅲ卷,11)(6分)一种可充电锂-空气电池如图1所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是
A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-■)O2
解析:A. 结合图中信息,电池放电时,O2得电子化合价降低,所以放电时,多孔碳材料电极为正极,故A错误;B.放电时,Li转化为Li+,电子经外电路从锂电极流向多孔碳材料,故B错误;C. 充电时,装置为电解池,原电池正负极分别接外电路阳极和阴极,Li+需得电子重新生成Li,所以电解质溶液中Li+向阴极移动,即向锂电极区迁移,故C错误;D. 根据图示和上述分析,电池的正极反应是O2与Li+得电子转化为Li2O2-X,电池的负极反应是Li失电子转化为Li+,所以总反应为:2Li+(1-■)O2=Li2O2-X,充电的反应与放电的反应相反,所以为Li2O2-X=2Li+(1-■)O2,选项D正确。
答案:D
点评:本题考查新型电池,锂做燃料在空气中燃烧,所以通氧气的为正极,单质锂为负极。要求学生明确原电池基本原理,以及阴、阳离子的定向移动方向。注意:放电时的原电池反应,逆向为电解池反应;放电的负极,充电时应该为阴极;放电的正极充电时应该为阳极。
2. 全固态锂硫电池。
【例2】(2017·课标Ⅲ,11)全固态锂硫电池能量密度高、成本低,其工作原理如图2所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中的Li2S2量越多
解析:A项,原电池电解质中阳离子移向正极,根据图示中Li+移动方向可知,电极a为正极,由总反应可知正极依次发生S8→Li2S8→Li2S6→Li2S4→Li2S2的还原反应,正确;B项,电池工作时负极电极方程式为Li-e-=Li+,当外电路中流过0.02 mol电子时,负极消耗的Li的物质的量为0.02 mol,其质量为0.14 g,正确;C项,石墨烯具有良好的导电性,故可以提高电极a的导电能力,正确;D项,充电时a为阳极,与放电时的电极反应相反,所以充電时间越长,电池中的Li2S2量就会越少,故D错误。
答案:D
点评:本题考查锂硫电池,涉及电极判断、电极反应式的书写、简单计算等知识点。根据离子的流向判断原电池的正负极,根据元素化合价的变化,判断放电时正负极发生的反应,再结合电解质书写电极反应方程式,侧重考查学生分析问题、解决问题的能力,读取图表信息的能力。
3. 钴酸锂(LiCoO2)锂离子电池。
【例3】(2016·四川,5)某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为
Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。
下列关于该电池的说法不正确的是
A. 放电时,Li+在电解质中由负极向正极迁移
B. 放电时,负极的电极反应式为LixC6-xe-=xLi++C6
C. 充电时,若转移1 mol e-,石墨C6电极将增重7x g
D. 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+
解析:A. 放电时,阳离子在电解质中向正极移动,故正确;B. 放电时,负极失去电子,故正确;C. 充电时,阴极反应为xLi++C6+xe-=LixC6,转移1 mol e-时,石墨C6电极将增重7g,故错误;D. 充电时阳极失去电子,为原电池的正极的逆反应,故正确。
点评:钴酸锂(LiCoO2)电池属于摇椅式电池,正极Li1-xCoO2和负极LixC6均为锂离子嵌入/脱嵌材料。电池通过正极产生的锂离子在负极碳材中的嵌入与迁出来实现电池的充放电过程。如下图所示:
答案:C
【例4】(2014·天津卷,6)已知:锂离子电池的总反应为LixC+Li1-xCoO2■C+LiCoO2锂硫电池的总反应2Li+S■Li2S,有关上述两种电池说法正确的是
A. 锂离子电池放电时,Li+向负极迁移
B. 锂硫电池充电时,锂电极发生还原反应
C. 理论上两种电池的比能量相同
D. 下图表示用锂离子电池给锂硫电池充电
解析:A. 电池工作时,阳离子(Li+)向正极迁移,A项错误;B. 锂硫电池充电时,锂电极上发生Li+得电子生成Li的还原反应,B项正确;C. 两种电池负极材料不同,故理论上两种电池的比能量不相同,C项错误;D. 根据电池总反应知,生成碳的反应是氧化反应,因此碳电极作电池的负极,而锂硫电池中单质锂作电池的负极,给电池充电时,电池负极应接电源负极,即锂硫电池的锂电极应与锂离子电池的碳电极相连,D项错误。
答案:B
点评:本题考查两种化学电源新型电池,体现了“起点高落点低”的特点。侧重考查原电池和电解池原理,明确各个电极上发生的反应及离子移动方向是解本题关键。注意:比能量指的是单位重量或单位体积的能量,电池的比能量就是参与电极反应的单位质量的电极材料放出电能的大小。
总之,通过分析近年高考化学试题我们发现,锂离子电池载体比较新颖,陌生度高,但实质还是原电池的基本原理、电极反应式的书写及简单计算。往往借助新的情景,考查电化学基础知识和基本技能。只要我们紧扣教材,明确锂离子电池的大致命题方向,對于典型试题进行适当地归类整理和总结,学生就能够有效掌握锂离子电池的相关知识,取得满意的效果。
责任编辑 李平安

