8周游泳运动对高脂饮食诱导胰岛素抵抗大鼠骨骼肌细胞自噬的影响
李 恩,叶 魁,孙君志,苏全生
胰岛素抵抗(Insulin Resistance,IR)是机体细胞无法对胰岛素产生正常反应的一种病理状态。骨骼肌是胰岛素抵抗发生的主要部位之一[1]。细胞自噬,又称“自体吞噬”,作为一种溶酶体依赖性降解途径广泛存在于真核生物内。细胞内蛋白质和细胞器出现衰老、损伤或变形时,细胞自噬被激活,自噬小体将其包裹吞噬并转运至溶酶体进行消化降解。因而,适宜的自噬水平对于维持骨骼肌形态完整性非常重要[2]。
胰岛素抵抗与细胞自噬密切相关。已有大量研究指出,长时间高脂饮食诱导的胰岛素抵抗小鼠骨骼肌mTORC1活性显著升高,细胞自噬水平明显下降[3-5]。运动可明显改变骨骼肌细胞自噬状态[6]。Yan等发现,C57BL/6小鼠进行28天自主转轮运动后,趾肌中细胞自噬标志蛋白Beclin-1、LC3-II和LC3-II/LC3-I分别增加了33%、43%和21%[7],许多研究发现2~7天耐力运动可使骨骼肌细胞自噬活性程度出现明显升高[8-9]。但尚未查到运动对胰岛素抵抗骨骼肌细胞自噬影响的相关报道。以高脂饮食诱导的胰岛素抵抗大鼠模型为研究对象,观察骨骼肌细胞的自噬情况和有氧运动干预对骨骼肌细胞自噬的影响,旨在为骨骼肌胰岛素抵抗的运动治疗提供理论依据和实践指导。
1 研究对象与方法
1.1 研究对象
雄性Sprague-Dawley大鼠36只(6周龄,体重200±30 g,SPF级),购于成都达硕生物科技有限公司(生产许可证号:SCXK(川)2015-30,合格证号:0000650)。饲养于成都体育学院运动医学与健康研究所动物房。室内温度控制在22~25℃,相对湿度40% ~70%,自然光照。用窗帘和灯光控制12:12h明暗循环,通风良好。
1.2 造模及分组
1.2.1 动物分组与胰岛素抵抗模型建立
适应性饲养一周后,用SPSS 17.0将雄性SD大鼠36只随机分为3组:正常饮食组(Normal Diet Group,ND, n=8)、高脂饮食组(High Fat Diet Group,HFD,n=12)和高脂饮食 +运动组(High Fat Diet+Exercise group, HFD+EXE, n=16)。
HFD和HFD+EXE组给予高脂饮食(普通饲料71.8%,猪油18%,胆固醇2%,蛋黄粉8%,胆酸钠0.2%)饲养,8周后取血检测空腹血糖、血清胰岛素和胰岛素抵抗指数判断胰岛素抵抗模型的建立;ND组正常饮食喂养。
1.2.2 运动方案
HFD+EXE组在实验前先进行3天适应性游泳练习。正式运动干预时,以无负重游泳15 min开始,每天递增10~20 min,经过1周增加至60 min,此后维持此运动量直至实验结束,每周运动6天。大鼠游泳池规格:150 cm×60 cm×70 cm,水温为30±2℃。必要时驱赶不游泳的大鼠以防其静止漂浮。
1.3 样本采集与指标检测
1.3.1 样本采集
禁食12小时后,2%戊巴比妥钠溶液2.3 ml/kg腹腔注射麻醉,新洁尔灭消毒皮肤,以腹部正中切口打开腹腔,腹主动脉取血,离心血清备用;取腓肠肌置于4℃生理盐水中反复漂洗后,滤纸吸干水分,部分组织置于3%戊二醛固定液中固定用于透射电镜超微结构观察;部分组织经液氮急冻后转移至-80℃冰箱备用。
1.3.2 空腹血糖测试
大鼠禁食12 h后,尾静脉取血,采用强生稳豪型血糖仪测量空腹血糖。
1.3.3 血清胰岛素测定
禁食12 h,尾部静脉取血后,离心分离血清,采用酶联免疫吸附实验(ELISA)试剂盒(96孔,Millipore,USA)检测。操作过程严格按照试剂盒说明书进行,酶标仪(Bio-Tek,USA)450 nm波长依序测试各孔的吸光度(0D值)。
1.3.4 HOMA-IR指数的计算
胰岛素抵抗指数(Homeostasis Model Assessment-IR Index,HOMA-IR)用于判断胰岛素抵抗水平变化。HOMA-IR指数越高,胰岛素抵抗程度越严重。HOMA-IR指数=FBG*FINS/22.5。
1.3.5 骨骼肌超微结构检测
每组选取3只大鼠同侧腓肠肌,用3%戊二醛固定,1%四氧化锇再固定,丙酮酸逐级脱水,环氧树脂812包埋,半薄切片光学定位,然后制成超薄切片,醋酸轴及枸橼酸铅双重染色,日立H-600IV型透射电镜观察并拍照。
1.3.6 蛋白免疫印迹
适量腓肠肌样品置于预冷的组织裂解液(Lysis Buffer)中匀浆,冰上放置1 h使组织充分裂解,4°C,13 000 rpm离心1h后取上清,BCA法定量蛋白。样品经10%SDS-PAGE凝胶电泳分离后,转移至PVDF膜上,封闭、孵育一抗(LC3-II,LC3-I, Beclin-1;abcam, USA)、孵育二抗、ECL 法显影和曝光。Image-J图像分析软件进行条带灰度分析。
1.4 数据分析
2 实验结果
2.1 各组大鼠的基本情况
ND组大鼠精神状态较好,进食与饮水正常,皮毛光泽且活泼好动;HFD组大鼠随着高脂饮食的时间增长,精神状态不佳,反应迟钝、皮毛粗糙和蜡黄,多出现脱毛现象,尿量较ND组增多,大便稀薄,且在实验过程中有4只大鼠出现严重感染(其中2只死亡);HFD+EXE组大鼠精神状态、反应速度、皮毛和二便情况与HFD组相比均有所改善,其中,造模过程中,3只大鼠严重感染死亡,游泳运动干预过程中有3只溺亡,2只未按预定运动方案完成全部运动干预被剔除。
排除试验过程中感染死亡和未完成既定运动干预方案的大鼠后,ND、HFD和HFD+EXE组大鼠样本量均为8只。
2.2 各组大鼠体重、FBG、FINS和HOMA-IR指数的变化
正式实验开始时,各组大鼠体重无明显差异(P>0.05)。高脂饲料喂养8周,与 ND组相比,HFD和HFD+EXE组大鼠体重明显升高(P<0.05)。8周游泳运动干预后,HFD+EXE组大鼠体重较HFD组显著性降低(P<0.05)(图1A)。
与ND组比较,HFD组大鼠FBG和HOMA-IR均明显升高(P<0.05);FINS非常显著性下降(P<0.01);而与HFD组相比,HFD+EXE组大鼠FBG和HOMA-IR出现明显下降(P<0.05),FINS显著上升(P <0.05)(图1B、C、D)。
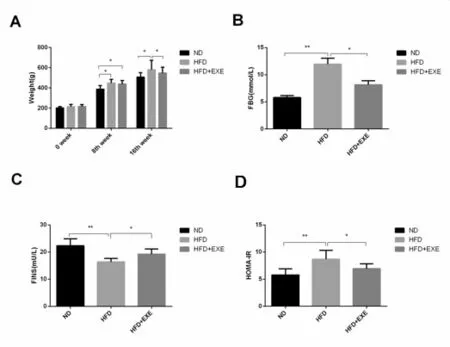
图1 各组大鼠体重、空腹血糖、空腹胰岛素和胰岛素抵抗指数的变化(*P<0.05,**P<0.01)A各组大鼠体重的变化情况;B各组大鼠空腹血糖的变化情况;C各组大鼠空腹胰岛素的变化情况;D各组大鼠胰岛素抵抗指数的变化情况。Figure 1 The difference of Body weight(BW),Fasting Blood Glucose(FBG),Fasting Insulin(FINS)and HOMA-IR among the Normal Diet group(ND),High Fat Diet group(HFD)and High Fat Diet+Exercise group(HFD+EXE)(*P<0.05,**P<0.01)A The changes of body weight after 8 weeks aerobic exercise training, B The changes of fasting blood glucose after 8 weeks aerobic exercise training, C The changes of fasting insulin after 8 weeks aerobic exercise training, D The changes of HOMA-IR after 8 weeks aerobic exercise training.
2.3 各组大鼠骨骼肌超微结构的变化
ND组肌纤维排列整齐,结构清晰;HFD组肌纤维排列较整齐,结构较清晰,线粒体出现明显损伤,部分线粒体可见空泡变性;HFD+EXE组肌纤维排列整齐,结构清晰,胞浆内线粒体轻度损伤。但各组均未发现自噬小体(图2)。
2.4 各组大鼠 LC3-II、LC3-I、LC3II/LC31 和 Beclin-1表达的变化
与ND组相比,HFD和 HFD+EXE组大鼠LC3-I未发生明显变化(P >0.05),LC3-II、LC3-II/LC3-I和Becline-1蛋白表达非常显著性下降(P<0.01);与 HFD组相比,HFD+EXE组LC3-II/LC3-I和 Becline-1明显升高(P<0.05),且LC3-II蛋白非常显著性增加(P<0.01)(图3)。

图2 各组大鼠骨骼肌超微结构变化情况(×10 000)Figure 2 The ultrastructure changes of skeletal muscle in rats in the Normal Diet group(ND),High Fat Diet group(HFD)and High Fat Diet+Exercise group(HFD +EXE)(×10 000)
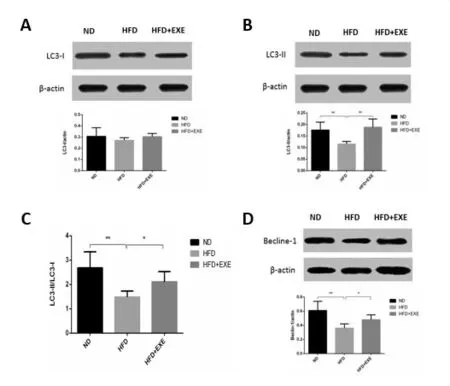
图3 各组大鼠骨骼肌 LC3-II、LC3-I、LC3-II/LC3-I和Becline-1的蛋白表达变化(*P<0.05,**P<0.01)A各组大鼠骨骼肌LC3-I蛋白表达变化情况;B各组大鼠骨骼肌LC3-II蛋白表达变化情况;C各组大鼠骨骼肌LC3-II/LC3-I变化情况;D各组大鼠骨骼肌Becline-1蛋白表达变化情况Figure 3 The difference of LC3-II, LC3-I, LC3-II/LC3-I and Becline-1 among the Normal Diet group(ND),High Fat Diet group(HFD)and High Fat Diet+Exercise group(HFD+EXE)(*P<0.05,**P<0.01)A The protein expression levels of LC3-II in gastrocnemius after 8 weeks aerobic exercise training,B The protein expression levels of LC3-I in gastrocnemius after 8 weeks aerobic exercise training,C The changes of LC3-II/LC3-I in gastrocnemius after 8 weeks aerobic exercise training,D The protein expression levels of Becline-1 in gastrocnemius after 8 weeks aerobic exercise training.
3 讨论
3.1 有氧运动对IR大鼠血糖代谢和胰岛素抵抗的影响
目前,胰岛素抵抗的非药物治疗手段主要采用饮食控制和运动干预。运动可明显减缓胰岛素抵抗已有大量研究报道。齐洁等对高脂饲料诱导的胰岛素抵抗SD大鼠进行为期8周的游泳运动干预后发现,无论是每天连续训练90 min还是上午与下午各训练45 min都能明显降低胰岛素抵抗,且二者之间无显著性差异[10]。同时,许国喜等也指出,有氧运动可明显提高胰岛素抵抗大鼠骨骼肌IRS-1表达,且IRS-1磷酸化水平也明显升高,胰岛素抵抗现象明显改善[11]。人体试验方面,刘鸥等发现,有氧运动能够明显改善肥胖患者的HOMA-IR指数水平,并在一定程度上保护患者的胰岛β细胞功能[12]。本实验中,SD大鼠经8周高脂饮食喂养后出现明显的胰岛素抵抗现象,8周游泳运动可明显降低胰岛素抵抗大鼠空腹血糖,且使胰岛素抵抗指数显著下降,进而明显改善骨骼肌胰岛素抵抗状态,和先前研究结果一致。
3.2 有氧运动对IR大鼠骨骼肌超微结构的影响
电子显微镜检测是当今观察细胞自噬形态学变化最直接、最经典的方法。Antonio等指出,用于检测细胞自噬时,电子显微镜可观察到细胞器的损伤情况、损伤细胞器周围出现的空泡状双层膜结构及后续形成的自噬体结构[13]。
研究发现,有氧运动干预后,小鼠骨骼肌细胞出现了C形的双层膜结构和少量的自噬小体[14-15]。本实验结果显示:ND组、HFD组和HFD+EXE组骨骼肌细胞未出现自噬小体,但其相应的自噬蛋白表达均明显增加。可能原因有:⑴本实验运动干预方式是无负重游泳运动,与负重的游泳运动或跑台运动相比,运动强度相对较低;⑵运动通过能量需求的增加模拟饥饿刺激促进细胞自噬,但运动的同时给予大鼠高脂饮食,自噬现象可能会出现相互抵消,从而表现为不明显或无特异性的变化;⑶运动干预时间较短(1 h/d),对骨骼肌刺激作用较小;⑷AMPK是骨骼肌细胞重要的调节因子[16],高脂饮食可抑制AMPK蛋白表达,抑制细胞自噬。
3.3 有氧运动对IR大鼠骨骼肌自噬相关蛋白表达的影响
自噬蛋白LC3是Atg8的同源物,可分为LC3-I和LC3-II两种。LC3-II定位在双层膜和自噬体上,是自噬体的特异性标志分子[16-18],其含量和细胞自噬数量呈正比。同时,LC3-II/LC3-I比值与自噬泡的数量呈明显正相关[19],LC3-II/LC3-I比值大小是判断自噬水平高低的依据。Beclin-1是自噬相关基因Atg6的同源物,不仅参与自噬体的形成过程,还有助于自噬体的成熟。Beclin-1一般不需要通过与 Bcl-2、mVps34、UVRAG、Bif-1、Barkor、Ambral等蛋白相互作用形成复合物就能发挥对细胞自噬的诱导作用[20]。
研究发现,小鼠进行高脂饮食饲养后,骨骼肌细胞LC3 mRNA表达显著下降,p62 mRNA表达明显上升,提示高脂饮食下骨骼肌细胞自噬水平下降[21]。Grumati等[22-23]研究发现C57BL/6小鼠一次性跑台训练1 h后,胫骨前肌LC3-II/LC3-I比值较对照组增加近4倍,提示一次性训练后自噬蛋白表达增加有利于受损细胞内容物的清除,从而维持细胞的稳态。同时,有研究发现,营养性肥胖小鼠骨骼肌LC3mRNA和LC3-II/LC3-I比值下调,通过耐力运动和膳食的改善,能够有效增加LC3-II的含量,缓解营养性肥胖机体细胞自噬水平的下降,从而使骨骼肌细胞自噬水平得以增加,维持细胞正常生理功能[24-25]。本实验结果显示:胰岛素抵抗大鼠LC3-II蛋白表达和LC3-II/LC3-I比值均下调,提示随着高脂饮食的持续喂养,骨骼肌细胞自噬水平不断降低;8周游泳运动干预后,Beclin-1蛋白、LC3-II蛋白和LC3-II/LC3-I比值显著上调,但并未达到空白对照组水平,提示适宜的运动训练能有效提高骨骼肌细胞自噬水平,且不会造成细胞自噬的过度激活,从而对细胞内损伤的细胞器和代谢废物进行清除。
运动强度可能是影响细胞自噬水平的重要因素。Feng等[26]研究指出,过度的运动训练可使Beclin-1、LC3表达显著升高,且肌肉出现萎缩,推测过度训练引起细胞自噬的过度激活,导致过量降解骨骼肌细胞中的蛋白质,引发肌肉萎缩和收缩能力下降,细胞的免疫功能也随之降低。Hussey等[27-28]也提出,自噬水平变化仅在一定程度上受能量消耗调控,且中低强度运动可诱导最佳自噬水平表达。本研究的无负重游泳运动干预结果也证实了这一点。中等运动强度耐力运动能有效上调Beclin-1、LC3-II和 LC3-II/LC3-I比值,增强骨骼肌细胞代谢能力;大强度长时间耐力运动会导致骨骼肌纤维受损,自噬体增多异常,Beclin-1、LC3出现过表达的现象,进而导致骨骼肌细胞受损。
4 结论
高脂饮食诱导胰岛素抵抗大鼠骨骼肌细胞自噬水平显著下降;有氧运动可明显增加的骨骼肌自噬水平,进而对受损的骨骼肌产生一定的保护作用。

