β-伴大豆球蛋白通过p38/JNK MAPK信号通路引起IPEC-J2细胞损伤
彭成璐,张 瑜,夏晓冬,贺濛初,舒迎霜,冯士彬,李 玉,王希春,李锦春,吴金节
(安徽农业大学 动物科技学院,安徽 合肥230061)
大豆作为优质的植物蛋白来源,一直被广泛应用于畜禽饲粮[1],大豆抗原蛋白是大豆中的主要致敏因子,依据蛋白质沉降系数可将大豆抗原蛋白分为2S、7S、11S等。7S是大豆中最易引起过敏的蛋白质[2-3],占大豆籽实总蛋白的25%[4],分子质量为140~180 ku,是由α’-(76 ku)、α-(72 ku)和β-(52 ku)三种亚基组成的三聚体,其中,α-亚基是一种糖蛋白,分子质量为57 ku,等电点为4.90,是大豆中主要的过敏原[5]。业已证实,豆粕发酵和大豆膨化等多种方法能使大豆制品的抗原活性低于生大豆[6-7],但因大豆抗原蛋白热稳定性高,目前市面上的方法依然不能使之充分灭活。前期体内试验得出,提前免疫7S或11S对仔猪有一定的免疫保护作用[8]。7S主要引起仔猪、犊牛等幼龄动物,特别是断奶仔猪的过敏反应,主要表现为免疫功能紊乱和肠道损伤[9]。根据动物肠道吸收蛋白的规律,7S在小肠中含量最高[10]。肠道是机体与外界环境接触最为密切的部位,不仅是消化、吸收营养物质的重要场所,也是机体的重要免疫屏障[11]。位于肠道第一层的肠上皮细胞,对隔离外界环境起着重要作用,IPEC-J2细胞是小肠的功能细胞,此细胞系来源于仔猪空肠上皮细胞,Schierack等[12]通过电子显微镜分析、组织化学染色及细菌感染等多种方法得出IPEC-J2是非转化的非致瘤性肠上皮细胞系,具有与体内活性相当的分化特征,适合用于体外模型。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号道路参与调节肠道的炎症、凋亡等病理机制[13]。细胞凋亡的众多途径最终都汇聚到Caspase-3的激活[14],Bcl-2家族在线粒体调控的凋亡途径中发挥重要作用,其主要包括促凋亡因子(Bax、Bak、Bad等)和抑制凋亡因子(Bcl-2等)[15]。
本研究构建小肠上皮细胞模型,通过ELISA、PCR和Western blot等方法在细胞及分子水平上研究不同浓度7S及p38和JNK抑制剂对仔猪肠上皮细胞存活率以及相关炎性因子、蛋白和mRNA表达量的影响,为探索β-伴大豆球蛋白引发仔猪肠道黏膜过敏损伤的分子机制提供理论依据。
1 材料与方法
1.1 实验材料
7S由中国农业大学食品工程学院提供(专利号:200,410,029,589.4,中国),再由安徽农业大学动物科技学院进一步提纯(7S纯度为91.3%)。IPEC-J2细胞购自武汉市农业科学院细胞库,RPMI 1640培养基购自美国Thermo公司,BCA蛋白浓度测定试剂盒购自biosharp,β-actin抗体购自北京锐抗生物科技有限公司,羊抗兔和羊抗鼠二抗购自biosharp,p-JNK抗体购自沈阳万类生物科技有限公司,p-p38抗体购自博士德生物工程有限公司,Bcl-2抗体购自proteintech,JNK抑制剂(SP600125)和P38抑制剂(SB202190)购自MEC,IL-6、NO、5-HT、IL-10 ELISA试剂盒购自江苏酶标生物有限公司。
1.2 实验分组
采用随机分组设计,取对数生长期的IPEC-J2细胞,以1×105CFU·mL-1的密度接种于6孔细胞培养板。置于37 ℃、5% CO2饱和湿度下培养至细胞贴壁,分为6组:A(对照组)、B(1 mg·mL-17S)、C(5 mg·mL-17S)、D(10 mg·mL-17S)、E(5 mg·mL-17S+1 μmol·L-1SP600125)、F(5 mg·mL-17S+1 μmol·L-1SB202190),每个浓度组均设置3个重复。
1.3 浓度摸索
在各组细胞中添加不同浓度的7S,后向每孔中加入10 μL CCK-8试剂,放入细胞培养箱中继续培养,直至出现明显的颜色反应。在酶标仪450 nm下读取D值,计算细胞存活率。在各组细胞中加入5 mg·mL-17S和不同抑制剂,培养12、24和48 h,计算细胞的存活率。
1.4 CCK-8法检测细胞存活率
添加不同浓度的7S和抑制剂后将IPEC-J2细胞置于培养箱中继续培养24 h,之后再向每孔中加入10 μL CCK-8试剂,放入细胞培养箱中继续培养,直至出现明显的颜色反应。在酶标仪450 nm下读取D值,计算细胞存活率。
1.5 ELISA法检测IPEC-J2细胞NO、IL-6、5-HT和IL-10的含量
收集IPEC-J2细胞,1 000 r·min-1转速下离心5 min,用PBS洗涤3次。之后向每个样品中加入500 μL含0.1% Triton X-100的0.1 mol·L-1Tris-HCl(pH 7.4),将样品放入冰水中进行超声裂解。将细胞裂解液以l 000 r·min-1离心l0 min,收取上清液,按照ELISA试剂盒说明书中详细操作步骤进行测定,计算NO、IL-6、5-HT和IL-10的含量。
1.6 Western blot法检测p-JNK、p-p38、Bcl-2蛋白表达量
弃去废液,收集细胞沉淀,加入混有蛋白酶抑制剂以及蛋白磷酸酶抑制剂的RIPA裂解液,
充分裂解之后14 000g离心10 min,收集上清液。将提取的蛋白质样品煮沸5 min,在SDS-PAGE凝胶中电泳,然后转移到PVDF膜。用含有0.05%Tween-20和5%牛血清白蛋白(BSA)的TBST在室温下封闭膜4 h,然后用一抗在4 ℃孵育过夜。将膜洗涤3次,并放入二抗在室温下振荡孵育45 min,洗膜后放入凝胶成像系统(Bio-Rad)中成像。
1.7 qPCR法检测Bad、Bax、Bcl-2和Caspase-3 mRNA相对表达量的检测
目的基因及β-actin内参引物序列参照GenBank,由生工生物工程(上海)股份有限公司合成,引物序列及参数见表1。
1.8 数据处理
2 结果与分析
2.1 7S及抑制剂对IPEC-J2细胞存活率的影响
由图1可知,1、5、10 mg·mL-17S对IPEC-J2细胞的作用效果极显著,添加15 mg·mL-17S时,细胞存活率过低。由图2可知,添加抑制剂培养24 h时对7S致敏作用的抑制效果最好。由图3可知,IPEC-J2细胞的存活率随着7S浓度的增加而降低,与A组相比,B组细胞存活率无显著差异(P>0.05),C、D组细胞存活率极显著降低(P<0.01);与C组相比,E、F组细胞存活率显著增加(P<0.05)。
表1基因引物参数
Table1Primer parameters of the genes

基因Gene登录号Accession number引物Primer序列Sequences (5′→3′)产物Product/bpBadXM_021082883.1ForwardGCCGAGATTAACCCTAACGC98ReverseCACACACGCGGGCTTTATTABaxXM_003127290ForwardCCGAAATGTTTGCTGACG154ReverseAGCCGATCTCGAAGGAAGTBcl-2NM_214285ForwardACCTGAATGACCACCTAGAGC180ReverseTCCGACTGAAGAGCGAACBcl-xlNM_214285.1ForwardTATTGGTGAGTCGGATCGCA127ReverseCTCTCAGCTGCTGCATTGTTCaspase-3NM_214131ForwardGTGGGACTGAAGATGACA190ReverseACCCGAGTAAGAATGTGactin414396ForwardCTGGACTTCGAGCAGGAGATGG168ReverseTTCGTGGATGCCGCAGGATTC

**表示与对照组相比差异极显著(P<0.01)。** showed significant difference compared with the control group (P<0.01).图1 不同浓度7S对IPEC-J2细胞活性的影响Fig.1 Effects of different concentrations of 7S on the activity of IPEC-J2 cells
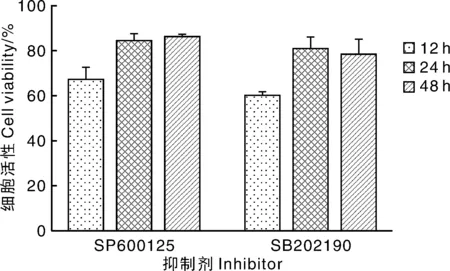
图2 抑制剂作用不同时间对IPEC-J2细胞活性的影响Fig.2 Effects of inhibitors on the activity of IPEC-J2 cells at different time
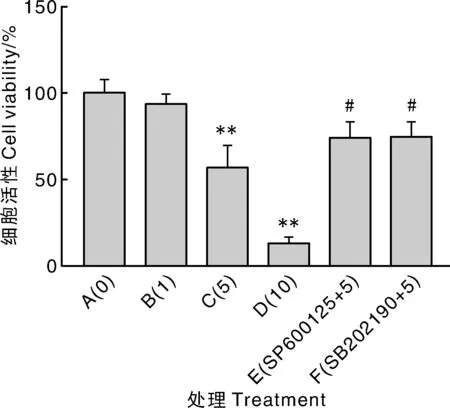
A,对照;B,1 mg·mL-1 7S;C,5 mg·mL-1 7S;D,10 mg·mL-1 7S;E,5 mg·mL-1 7S+1 μmol·L-1 SP600125;F,5 mg·mL-1 7S+1 μmol·L-1 SB202190。**表示与A组相比差异极显著(P<0.01);#表示与C组相比差异显著(P<0.05)。下同。A, Control group; B, 1 mg·mL-1 7S; C, 5 mg·mL-1 7S; D, 10 mg·mL-1 7S; E, 5 mg·mL-1 7S+1 μmol·L-1 SP600125; F, 5 mg·mL-1 7S+1 μmol·L-1 SB202190.** showed significant difference compared with group A (P<0.01);# showed significant difference compared with group C (P<0.05). The same as below.图3 IPEC-J2细胞活性Fig.3 IPEC-J2 cell activity
2.2 7S对IPEC-J2细胞NO、5-HT、IL-6和IL-10含量的影响
由图4-a可知,与A组相比,B组细胞NO含量无显著差异(P>0.05),C、D组细胞NO含量极显著增加(P<0.01)。与C组相比,E、F组细胞NO含量显著降低(P<0.05)。由图4-b可知,与A组相比,B组细胞5-HT含量无显著差异(P>0.05),C、D组细胞5-HT含量极显著增加(P<0.01)。与C组相比,E、F组细胞5-HT含量显著降低(P<0.05)。由图4-c可知,与A组相比,B组细胞IL-6含量无显著差异(P>0.05),C、D组细胞IL-6含量极显著增加(P<0.01)。与C组相比,E、F组细胞IL-6含量显著降低(P<0.05)。由图4-d可知,与A组相比,B组细胞IL-10含量无显著差异(P>0.05),C、D组细胞IL-10含量极显著降低(P<0.01)。与C组相比,E、F组细胞IL-10含量显著增高(P<0.05)。
2.3 7S对IPEC-J2细胞p-JNK、p-p38和Bcl-2蛋白表达量的影响
由图5-b可见,与A组相比,B组细胞p-JNK蛋白表达量显著增加(P<0.05),C、D组细胞p-JNK蛋白表达量极显著增加(P<0.01),与C组相比,E、F组细胞p-JNK蛋白表达量极显著降低(P<0.01)。由图5-c可见,与A组相比,B组细胞p-p38蛋白表达量显著增高(P<0.05),C、D组细胞p-p38蛋白表达量极显著增加(P<0.01),与C组相比,E、F组细胞p-p38蛋白表达量极显著降低(P<0.01)。由图5-d可见,与A组相比,B组细胞Bcl-2蛋白表达量差异不显著(P>0.05),C、D组细胞Bcl-2蛋白表达量极显著降低(P<0.01),与C组相比,E组细胞Bcl-2蛋白表达量显著增高(P<0.05),F组细胞Bcl-2蛋白表达量极显著增高(P<0.01)。
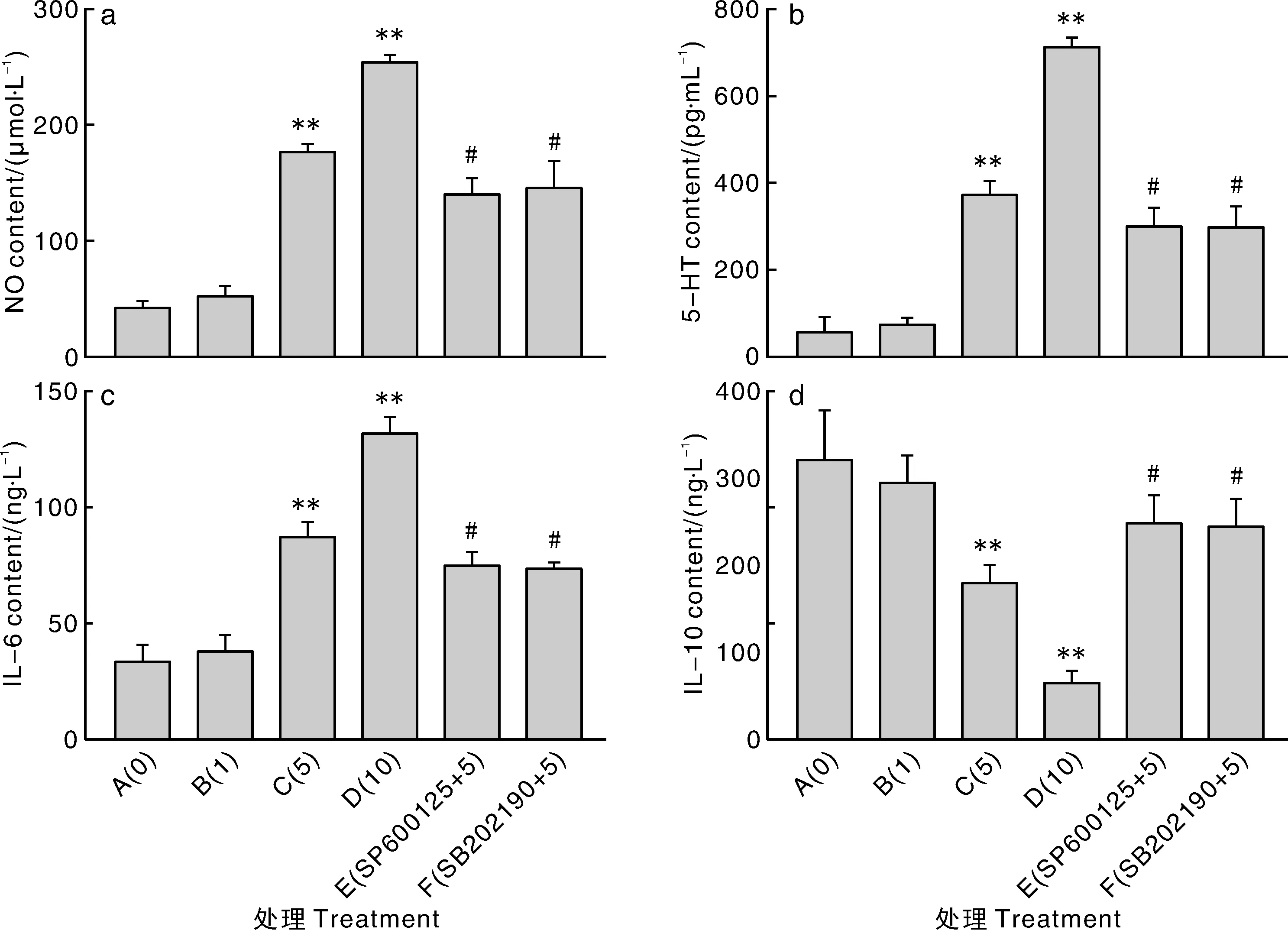
图4 7S对IPEC-J2细胞NO、5-HT、IL-6和IL-10含量的影响Fig.4 Effect of 7S on NO, 5-HT, IL-6 and IL-10 contents in IPEC-J2
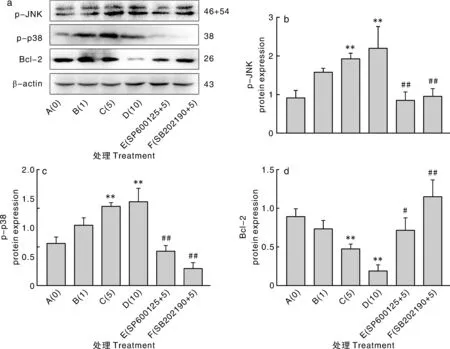
##表示与C组相比差异极显著(P<0.01)。## showed significant difference compared with group C (P<0.01)图5 7S对p-JNK、p-p38和Bcl-2蛋白表达量的影响Fig.5 Effect of 7S on the expression of p-JNK, p-p38 and Bcl-2 proteins
2.4 7S对Bcl-2/Bax比值、Bax/Bcl-xl比值、Bad mRNA和Caspase-3 mRNA相对表达量的影响
由图6-a可知,与A组相比,B组细胞Bcl-2/Bax比值无显著差异(P>0.05),C、D组细胞极显著降低(P<0.01)。与C组相比,E、F组细胞Bcl-2/Bax比值极显著增高(P<0.01)。由图6-b可知,与A组相比,B组细胞Bax/Bcl-xl比值无显著差异(P>0.05),C、D组细胞Bax/Bcl-xl比值极显著增高(P<0.01)。与C组相比,E、F组细胞Bax/Bcl-xl比值极显著降低(P<0.01)。由图6-c可知,与A组相比,B组细胞BadmRNA相对表达量无显著差异(P>0.05),C、D组细胞BadmRNA相对表达量极显著增高(P<0.01)。与C组相比,E组细胞BadmRNA相对表达量显著降低(P<0.05),F组细胞BadmRNA相对表达量极显著降低(P<0.01)。由图6-d可知,与A组相比,B组Caspase-3 mRNA相对表达量无显著差异(P>0.05),C、D组Caspase-3 mRNA相对表达量极显著增高(P<0.01)。与C组相比,E、F组Caspase-3 mRNA相对表达量显著降低(P<0.05)。
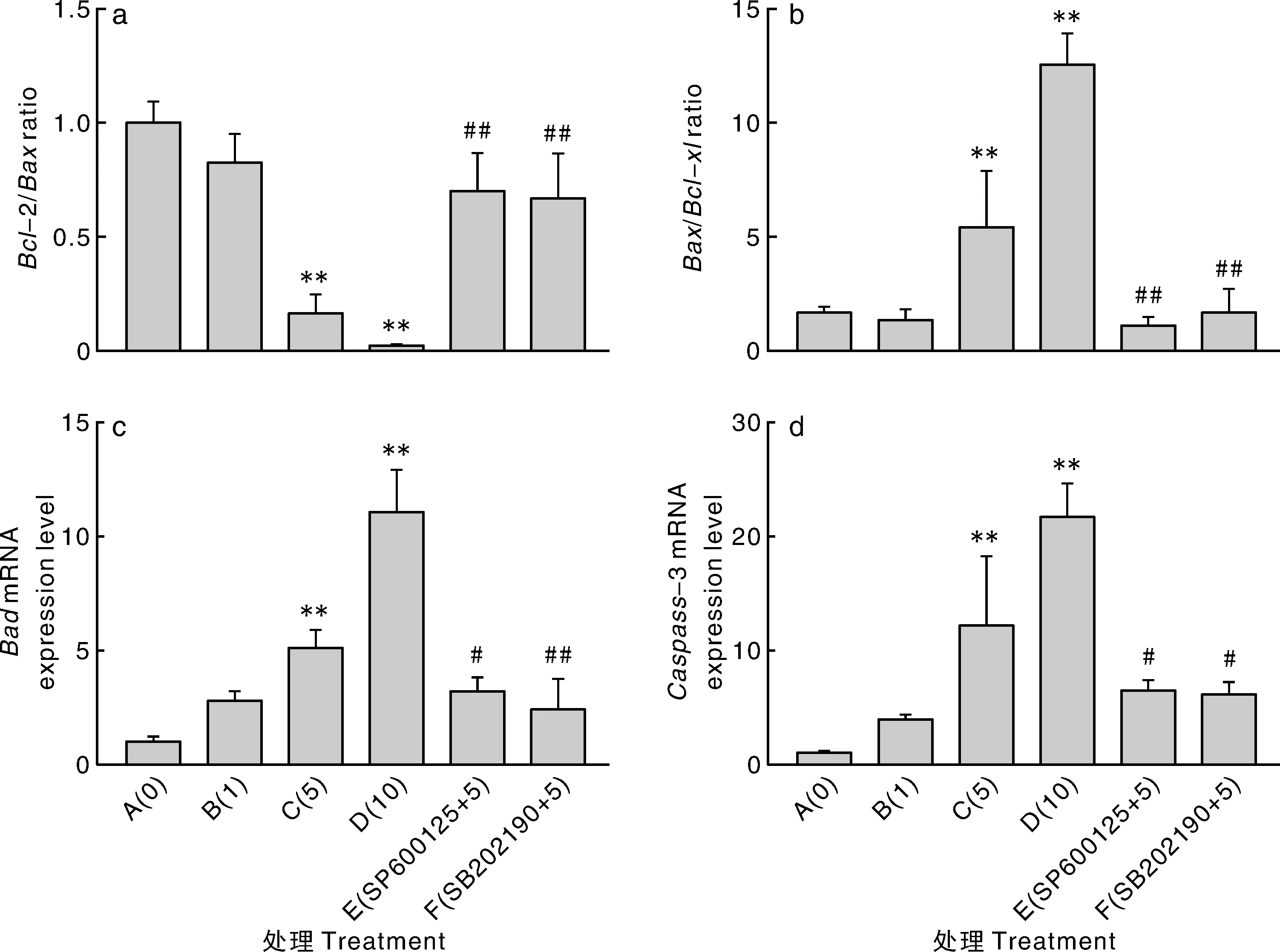
图6 7S对Bcl-2/BAX、BAX/Bcl-xL、Bad mRNA和caspase-3 mRNA的影响Fig.6 Effect of 7S on the relative expression of Bcl-2/BAX, BAX/Bcl-xL, Bad mRNA and caspase-3 mRNA
3 讨论
Chen等[16]评估了不同浓度β-伴大豆球蛋白(0~1 500 μg·mL-1)和培养时间(48或72 h)对猪小肠上皮细胞增殖和蛋白质组的影响,发现β-伴大豆球蛋白通过抑制肠细胞生长直接诱导肠损伤,破坏细胞骨架并导致仔猪肠道细胞凋亡。Zhao等[17]使用IPEC-J2模型评估β-伴大豆球蛋白诱导的上皮渗透性,完整性,代谢活性,紧密连接(TJ)分布和表达的变化,7S能抑制肠上皮细胞增殖和促进肠上皮细胞凋亡。随着7S的增加,发现紧密连接occludin和ZO-1 mRNA表达线性下降。本实验发现,IPEC-J2细胞的存活率随着7S浓度的增加而降低,并且与同浓度7S(5 mg·mL-1)而未添加抑制剂的细胞相比,添加JNK/P38抑制剂可以减弱7S对IPEC-J2细胞的损伤作用。
Wu等[18-19]通过给断奶仔猪饲喂7S,发现7S诱导过敏反应,损伤肠黏膜,增加肠道通透性和促进断奶仔猪的sIgA合成,增加仔猪血清IL-6和5-HT等炎性因子水平,引起仔猪体液和细胞免疫应答,本研究通过体外实验进一步证明7S促进IPEC-J2分泌IL-6、5-HT、NO等炎性因子。与添加5 mg·mL-17S的细胞相比,添加5 mg·mL-17S和1 μmol·L-1p38或JNK抑制剂组的猪小肠上皮细胞分泌IL-6、NO和5-HT量均受到抑制,栾兆双等[13]通过腹腔注射p38和JNK抑制剂发现在断奶应激致仔猪小肠黏膜屏障受损过程中,抑制p38和JNK通路后,肠屏障得到改善,与本实验结果相符合,刘欣[20]通过用11S和7S灌胃小鼠,发现11S和7S使小鼠小肠组织中IL-10 mRNA的表达量降低,与本实验ELISA结果相符合。Western blot实验结果发现,7S可以促进p-p38和p-JNK蛋白的磷酸化,与添加5 mg·mL-17S的细胞相比,添加5 mg·mL-17S和1 μmol·L-1p38或JNK抑制剂后,p-p38 MAPK和p-JNK蛋白表达量降低,说明7S通过p38/JNK MAPK信号通路引起仔猪小肠上皮细胞损伤,并且p38和JNK抑制剂可以降低小肠上皮细胞过敏反应。
Markou等[21]通过成人心机细胞模型验证JNK和p-38信号通路通过调节Bcl-2家族诱导线粒体介导的细胞凋亡,结果发现抑制p38-MAPK导致Bcl-2磷酸化水平降低。Bcl-2和Bax表达的高低与凋亡调控直接相关,Bcl-2与Bax比率决定细胞在受刺激后是启动抑制凋亡机制还是促凋亡机制[15,22]。本实验结果显示,Bcl-2/Bax比值随7S浓度增加而降低,说明7S刺激猪肠上皮细胞细胞启动促凋亡机制。已知Bad通过与Bax和Bcl-2形成异源二聚体来调节细胞凋亡[23],本实验中,随着7S浓度增加,BadmRNA相对表达量增加,说明7S刺激猪肠上皮细胞凋亡。Bax/Bcl-xl比值的增高使Bax可以通过内在的细胞凋亡途径发出凋亡信号,触发线粒体孔隙向细胞质释放促凋亡因子Bax,导致Caspase-3激活[24]。本实验中Bax/Bcl-xl比值随7S浓度增加而升高,Caspase-3 mRNA相对表达量随7S浓度增加而升高,表明7S激活了细胞凋亡的线粒体和死亡受体凋亡途径,添加5 mg·mL-17S和1 μmol·L-1p38或JNK抑制剂的细胞,与添加5 mg·mL-17S的细胞相比Caspase-3、BadmRNA相对表达量显著降低,Bcl-2/Bax比值增高,Bax/Bcl-xl比值降低。说明7S通过p38/JNK MAPK信号通路诱导猪肠细胞凋亡,p38或JNK抑制剂可以抑制7S诱导的猪肠上皮细胞凋亡。

