脓毒症患儿病情与血管内皮细胞功能障碍的相关性分析
莫连芹, 汪娟, 黄栋, 王予川
脓毒症作为一种临床综合征,是重症监护病房患者死亡的第一大原因,居所有死亡原因的前10位[1]。脓毒症的发病机制包括凝血功能失调、异常介质的产生、超炎症反应应答、内皮细胞损伤及其他细胞凋亡等。近年来研究认为,血管内皮细胞是参与炎症应答的主要靶细胞之一[2-3],同时内皮细胞不仅是炎症反应中被动的靶细胞,也是一种效应细胞[4]。通过查阅相关文献发现,内皮细胞损伤时产生的一些物质,如血浆内皮素1(endothelin-1,ET-1)、血管性血友病因子(vonwillebrand factor,vWF)、可溶性血栓调节蛋白(soluble thrombomodulin,sTM)以及内皮细胞微粒等。而目前儿童脓毒症引起内皮细胞损伤方面的报道甚少,本研究对我院PICU及小儿外科收治的脓毒症患儿,根据脓毒症病情严重程度及预后进行分组,通过对炎症指标和内皮细胞损伤标志物的相关性研究,探讨内皮细胞损伤对脓毒症病情、预后评估的意义。
1 资料与方法
1.1 临床资料 选择2017年5月至2018年1月贵州省人民医院PICU及小儿外科收治24 h以上的脓毒症患儿68例为研究对象,根据患儿病情严重程度分为脓毒症组41例和脓毒性休克组27例。脓毒症组中男23例,女18例;年龄6.5~54个月,平均19.0个月。脓毒性休克组中男11例,女16例;年龄31~78个月,平均47个月。68例患儿中肺部感染26例[5],为最主要感染部位,与相关报道一致,颅脑外伤并感染1例,腹腔感染29例,胸腔感染1例,中枢神经系统感染3例,软组织感染2例,骨髓炎2例,泌尿系感染1例,其他部位感染3例。同期选择门诊健康体检者39例作为对照组,其中男25例,女14例;年龄2~96个月,平均36个月。3组研究对象在性别、年龄方面比较差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准 符合2016年《脓毒症与感染性休克的第三次国际共同定义》中脓毒症3.0的定义[6]。
1.3 纳入标准 (1)符合脓毒症和脓毒性休克的诊断标准;(2)年龄≤8岁;(3)患儿家属知情同意,并经我院医学伦理委员会批准。
1.4 排除标准 (1)合并有原发性肝脏疾病、血液系统疾病及恶性肿瘤者;(2)大量输注血液及血制品、入院前使用抗凝药物者;(3)入院24 h内死亡者;(4)病历资料不全,放弃治疗者。
1.5 观察指标 入院24 h内炎症指标[血白细胞计数(white blood cell,WBC)、C反应蛋白(C-reactive protein,CRP)、白细胞介素-6(interleukin-6,IL-6)、降钙素原(procalcitonin,PCT)]和内皮细胞损伤标志物[ET-1、vWF、sTM,人vWF(bJK08758)、sTM(bJK038102)、ET-1(bJK038103)]。ELSIA检测试剂盒均购自上海晶抗生物科技有限公司。

2 结果
2.1 3组研究对象实验室指标比较 见表1。
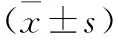
表1 3组研究对象实验室指标比较
注:与正常对照组比较,aP<0.05;与脓毒症组比较,bP<0.05。
表1结果表明,3组间WBC、CRP、IL-6、PCT、vWF、STM、ET-1比较,差异均有统计学意义(P<0.05);其中CRP、IL-6、PCT、vWF、STM、ET-1指标在脓毒性休克组中最高,在脓毒症组中次之,而在正常对照组中最低;WBC在脓毒症组、脓毒症休克组间比较差异无统计学意义(P>0.05),但均高于正常对照组,差异有统计学意义(P<0.05)。
2.2 脓毒症患儿存活组与死亡组间单因素变量比较及相关性分析 根据28 d预后,68例患儿中存活53例,死亡15例,其中WBC、vWF、sTM、ET-1两组间比较差异有统计学意义(P<0.05),具体表现为WBC在死亡组明显低于存活组,且与脓毒症患儿预后呈正相关。而vWF、sTM、ET-1在死亡组均明显高于存活组,且与脓毒症患儿预后呈显著负相关。分别见表2、3。
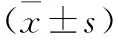
表2 脓毒症患儿存活组与死亡组间单因素变量比较
注:与存活组比较,at=-2.175,2.481,2.992,4.745,P<0.05。
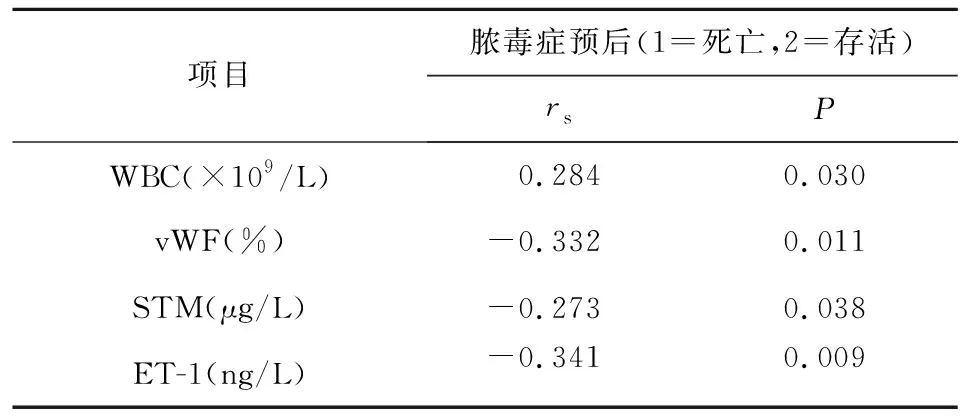
表3 脓毒症预后相关因素单因素分析
3 讨论
内皮细胞是脓毒症发生发展中起关键性作用的细胞。研究显示,内皮细胞在脓毒症早期可显著降低肺循环压力;尽快恢复下跌的WBC数目,增加抵抗力;改善体内炎症水平。因此,内皮细胞对脓毒症有保护作用,可能是内皮细胞使体内产生更多的活化蛋白C,起到抗炎、抗凝和抗细胞凋亡的作用[7-9];另外,通过输注外源性的内皮细胞也可生成内皮源性的一氧化氮合成酶和前列环素来调节血管舒缩、抑制炎症和凝血;还可调节细胞因子的生成,维持促炎因子和抗炎因子的平衡,起到免疫调节作用等。
本研究显示脓毒性休克组患儿,内皮细胞损伤标志物水平(sTM、vWF、ET-1)与炎症指标水平(PCT、IL-6、CRP)均随脓毒症病情加重而升高;而炎症指标水平(PCT、IL-6、CRP)高低与脓毒症患者死亡率无显著相关性。本研究的原发病以腹腔及肺部感染为主,与国内相关资料一致[10];国内有研究提示年龄是严重脓毒症的保护因素[11],而在此研究中脓毒症患者病情严重程度及预后均与年龄无明显差异,这与亚洲多中心研究[12]结果一致。可以看出感染(特别是细菌感染)越重,其对内皮损伤越重。因此,动态监测内皮细胞损伤标志物对脓毒症患者病情、预后评价有重要临床参考价值。
血栓调节蛋白(thrombomodulin,TM)是血管内皮细胞表达的一种糖蛋白,主要分布于内皮细胞表面,内皮细胞损伤后,TM大量释放入血成为sTM,内皮细胞上的TM减少,抗凝作用减弱,血液向促凝状态偏移,导致血栓形成;sTM水平反映血管,尤其是小血管和毛细血管内皮细胞受损的程度,是内皮细胞受损的特异分子标志物之一,其水平升高幅度与血管内皮细胞损伤程度成正比[13];其变化可用于判断血管内皮细胞受损程度,在一定程度上可预测病情的转归[14];有研究报道在过敏性紫癜患儿肾脏血管损伤的研究中发现,血浆sTM在一定程度上可以反映血管内皮细胞受损的程度[15-16];本研究得出sTM水平在脓毒性休克组与脓毒症组比较有显著差异,其与炎症指标(CRP、IL-6、PCT)变化相一致,相关性分析得出sTM水平越高,发生脓毒性休克的风险越高;在脓毒症死亡组sTM明显增高。此结果与上述研究结果相符。同样,脓毒症患儿出现凝血功能紊乱后,循环血液中sTM是升高的,且sTM水平随脓毒症病情加重升高,提示血管损伤越严重,可能导致凝血级联反应进一步扩大,明显加重病情,进一步加重微循环障碍及各器官组织的缺血缺氧,甚至诱发弥漫性血管内凝血及器官功能衰竭[17-18]。因此,在脓毒症患儿出现凝血功能紊乱后有效控制血浆sTM含量,可能是防治脓毒症进一步恶化的有效方法之一。
ET-1是唯一由血管内皮细胞生成的多肽,具有强力收缩血管作用,ET是迄今发现最强最持久的缩血管活性多肽[19]。当内皮损伤后,引起ET水平增加,导致血管痉挛和增生,促进血栓形成,参与血管内皮功能障碍形成,在一定程度上,ET的升高可反映血管内皮细胞损伤的程度。本研究中ET-1水平随脓毒症患儿病情加重而增高,死亡组中ET-1水平较存活组高;在体外循环动物实验研究显示术后3 h,实验组血清ET-1水平开始上升,到术后12 h达峰值,在24 h稍有下降,但仍处于较高水平,明显高于对照组,提示ET-1是内皮细胞损伤的标志,此时内皮素的缩血管效应导致组织器官缺血缺氧性损害;本研究与上述动物研究结论一致。并且提示当发生脓毒症时是通过介导内皮损伤,引起ET水平增加,导致血管痉挛和增生。
vWF是由血管内皮细胞或巨核细胞合成的一种多聚体高分子蛋白质,广泛存在于血管内皮细胞Weibel-Palade小体、血小板cc颗粒和血浆内[20]。vWF由血管内皮细胞合成并释放,其水平升高[21]被认为是内皮损伤和功能障碍的标志,其水平高低可反映血管内皮受损的严重程度。许雅萍等[22]研究发现不同中医证型的脓毒症患儿血清中vWF也明显升高;体外实验中应用脓毒症血浆刺激人脐静脉内皮细胞,检测到vWF明显升高[23],上述结果均表明,在脓毒症中炎症介质的过度释放可导致内皮损伤;有资料显示,在急性肺损伤死亡患儿中vWF明显高于存活患者[24];Claus等[25]研究发现,脓毒症休克时患者血浆中vWF明显增加,与患者病情严重程度和器官功能衰竭呈正相关,说明vWF水平与病情严重程度相一致。因此通过监测vWF水平来反应脓毒症患者病情意义可靠。本研究亦显示,脓毒性休克组患者vWF以及炎症指标(CRP、IL-6、PCT等)较脓毒症组明显升高,且与病情严重程度呈正相关;在脓毒症存活组vWF水平低于死亡组;这与上述体内及体外研究结果相一致;其机制可能是vWF介导血管损伤使血小板与血管壁黏附及血小板聚集,同时通过与凝血因子Ⅷ结合点相结合,逃避蛋白酶的影响,从中稳定其活性[26];vWF还与血小板膜糖蛋白Ⅱb/Ⅲa结合,使血小板活化,介导血小板黏附和聚集,与受损的血管内皮或内膜形成血小板血栓,稳定和加强凝血因子Ⅷ的功能。从我们的研究结果可推断,炎症介质造成血管内皮细胞损伤,当内皮受损时,vWF由内皮细胞释放入血,使血中vWF水平增高[27],分泌到血浆或血管内皮下的大量vWF参与血小板的黏附和聚集,激活凝血系统,导致凝血功能失调[28]。因此,我们可得出vWF不仅是凝血系统的启动因子,也是反映细胞损伤敏感的分子标记物。
本研究的不足之处和局限性:(1)未动态监测脓毒症不同时期炎症指标与血管内皮损伤标志物水平的动态变化;(2)本研究纳入样本量较少,可能对本文结果产生影响。

