心外膜脂肪组织对2型糖尿病心血管事件和死亡的预测价值
吴金枝 郑桂安 赖鹏斌 谢良孝 查小云
2型糖尿病患者尽管经过积极的治疗与管理,其心血管并发症仍然高发[1]。因此,如何早期识别糖尿病患者心血管疾病的风险尤为重要。心脏脂肪组织包括心外膜脂肪组织(epicardial adipose tissue,EAT)和心包脂肪组织(pericardial adipose tissue,PAT),而EAT 和PAT 两者相加称为总心脏脂肪组织(total cardiac adipose tissue,CAT)。研究表明,心脏脂肪组织与心肌、冠状动脉的关系密切,可以作为预测普通人群和稳定型心绞痛患者心血管疾病风险的生物学标志物[2,3]。研究进一步发现,与非糖尿病患者相比,2型糖尿病患者的心脏脂肪组织更多[4]。然而,在2型糖尿病患者中,心脏脂肪组织与心血管事件的临床相关性国内外均未见报道。本研究应用超声心动图对心脏脂肪组织进行测量,探讨心脏脂肪组织对2型糖尿病患者心血管事件和死亡的预测价值。
1 材料与方法
1.1 一般资料采用前瞻性队列研究设计,连续性入选2010年4月~2014年1月在我院内分泌科就诊的2型糖尿病患者。纳入标准:①年龄18~75 岁;②符合1999年世界卫生组织制定的2型糖尿病诊断标准[5]。排除标准:①超声心动图图像质量差无法进行分析;②患者失访、不同意或中途退出研究。共有2 964 例2型糖尿病患者被邀请参加,其中1 080 例同意加入研究。在纳入患者时,记录患者体质指数(BMI)、当前用药情况、冠状动脉性心脏病史(包括心肌梗死、经皮冠状动脉介入治疗、冠状动脉旁路移植术、充血性心力衰竭和心房颤动)和相关心血管疾病危险因素(脑卒中、高血压、外周动脉疾病、冠心病家族史和吸烟状况),并检测患者相关血生化指标,包括胆固醇、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯、糖化血红蛋白(HbA1c)和白蛋白尿。该研究方案获得我院伦理委员会批准,所有入选患者均签署知情同意书。
1.2 心脏脂肪组织的超声测量采用美国GE 公司Vivid E9 彩色多普勒超声诊断仪,M5SC-D 探头,频率为1.5~4.6MHz。超声心动图测量数据取3 个心动周期的平均值。取垂直于主动脉瓣环的胸骨旁长轴切面,收缩末期右心室游离壁前方的无回声区至心外膜之间的距离为EAT 厚度[6]。EAT 前方低回声区至外层心包之间的距离为PAT 厚度[6]。将EAT 厚度和PAT 厚度两者相加即CAT 厚度。以上检查分别由两位超声科医师采用盲法测量,防止测量结果偏倚。
1.3 随访对所有入选患者进行门诊或电话随访,每半年随访一次,随访时间为5年,随访复合终点包括全因死亡和非致命性心血管事件(包括冠状动脉血运重建、心肌梗死、因心力衰竭而住院和脑卒中)。
1.4 统计学方法使用SPSS 21.0 和SAS 9.3 统计软件进行数据分析。正态分布的连续性变量用±s表示,非正态分布的连续性变量用中位数(四分位数间距)表示。分类变量用例(n)和百分比(%)表示。连续性变量组间均数比较采用独立样本t检验或Mann-Whitney U 检验,分类变量比较采用卡方检验。将EAT、PAT 和CAT 数据同时作为连续性变量和二分类变量(通过中位心脏脂肪组织水平分类)进行分析。采用Cox 比例风险回归模型分析每毫米心脏脂肪组织增量所对应的随访复合终点的风险比(HR)。Cox 回归模型1 为未经校正,模型2 根据年龄和性别进行校正,模型3 根据传统心血管疾病危险因素(包括年龄、性别、收缩压、LDL-C、BMI、吸烟、糖尿病病程和HbA1c)进行校正。将心脏脂肪组织的平方作为协变量添加到模型中进行非线性检测。用C-统计(C-statistics)和净重新分类指数(Net Reclassification Index,NRI)检测EAT、PAT 和CAT 的附加预测值[7]。P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料特征至随访结束共15 例患者中途退出研究,12 例患者失访,23 例患者因超声图像质量差无法进行图像分析,最终纳入1 030 例患者。非致死性心血管事件和全因死亡复合终点的中位随访时间为4.7年。本研究患者平均年龄(59.5±8.3)岁,638 例(61.94%)为男性,216 例(20.97%)经历了复合终点。吸烟151 例(14.66%),糖尿病病程11(6,17)年,缺血性心脏病192 例(18.64%),收缩压(138 ±17)mmHg,总胆固醇4.1(3.5,4.8)mmol/L,低密度脂蛋白2.0(1.2,2 .8)mmol/L,高密度脂蛋白0.8(0.6,1.2)mmol/L,甘油三酯1.8(1.2,2.5)mmol/L,糖化血红蛋白7.2(6.5,8.2)%,血肌酐89 (66,128)μmol/L, CAT(11.9±3.6)mm,EAT(5.0±1.8)mm,PAT(6.9±2.8)mm。
2.2 EAT 与复合终点的相关性当EAT 作为连续性变量时,EAT 与模型1 的复合终点发生率呈相关趋势(HR=1.06,95%CI 1.00~1.14,P=0.057),见表1。 EAT 与非线性分析的复合终点无关(HR=1.00,95%CI 0.99~1.00,P=0.55)。以EAT 中位数4.6(3.5~5.8)mm作为分界点,将ETA 分为高水平(高于中位数)和低水平(等于或低于中位数)。在模型1 中,高水平EAT 患者其复合终点发生的风险明显增加(HR=1.46,95%CI 1.13~1.88,P=0.004),该关联在模型2 中仍具有显著性(HR=1.31,95%CI 1.01~1.69,P=0.038),在模型3 中趋向显著性(HR=1.32,95%CI 0.99~1.78,P=0.057),见表2、图1。
2.3 PAT 与复合终点的相关性PAT 与模型1、2、3 的复合终点均无明显相关,见表1。在非线性分析中PAT 与复合终点无关(HR=0.99,95%CI 0.98~1.00,P=0.31)。PAT 的中位数为6.3(4.8~8.6)mm。高水平PAT(高于中位数)的患者在模型1、2、3 中未增加复合终点发生的风险,见表2。
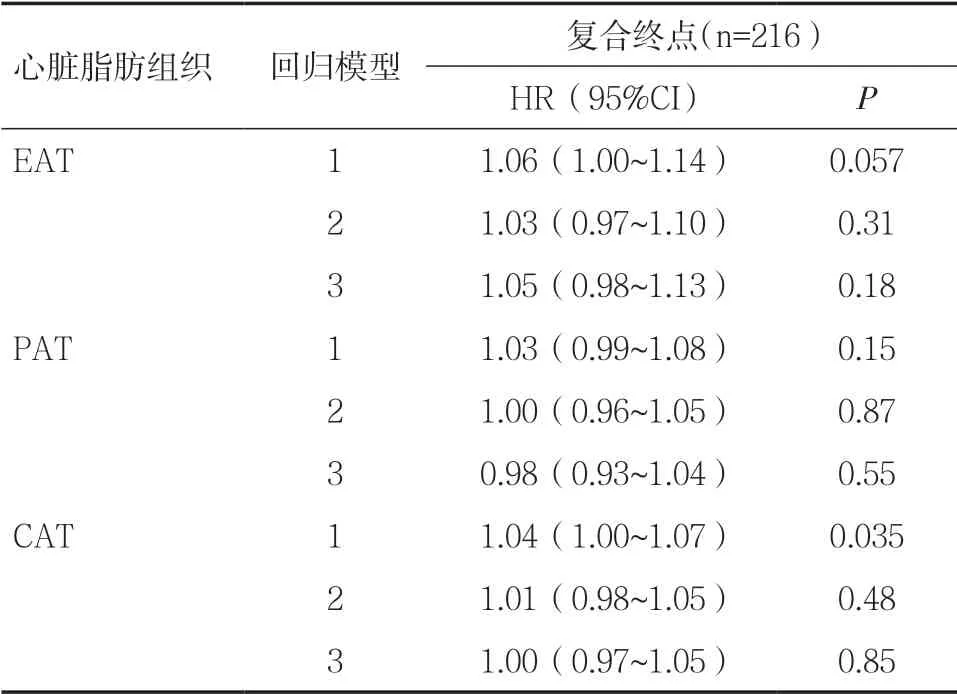
表1 心脏脂肪组织与随访复合终点发生率的相关性
2.4 CAT 与复合终点的相关性在模型1 中,CAT与复合终点发生的风险呈明显相关(HR=1.04,95%CI 1.00~1.07,P=0.035),见表1。非线性分析中CAT 与复合终点无关(HR=1.00,95%CI 0.97~1.01,P=0.44)。CAT 中位数为11.5(9.2,14.3)mm。高水平CAT(高于中位数)的患者在模型1、2、3 中未增加复合终点发生的风险,见表2。
2.5 心脏脂肪组织对复合终点风险的预测价值使用C 统计检验模型性能时,将EAT(作为连续变量和二分类变量)加入模型1 和模型3 前后均得到相似的结果。NRI 分析显示,在模型3 中加入EAT(作为连续变量)和高水平EAT(作为二分类变量),均可提高模型的预测能力(分别为19.6%,P=0.035;20.8%,P=0.026),见表3。
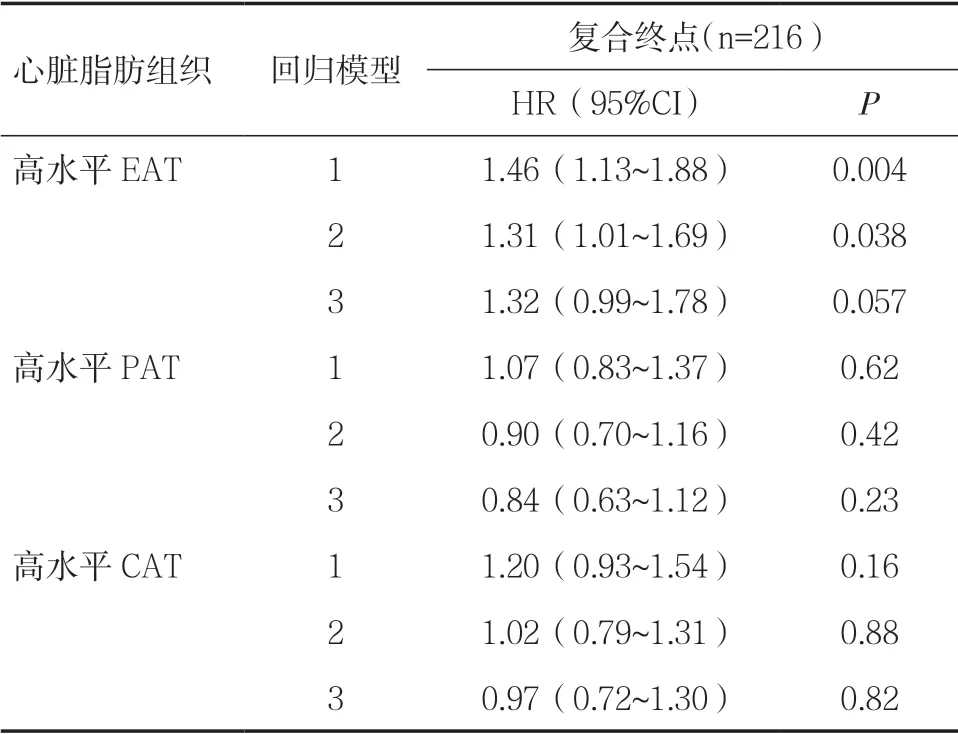
表2 高水平心脏脂肪组织与随访复合终点发生率的相关性
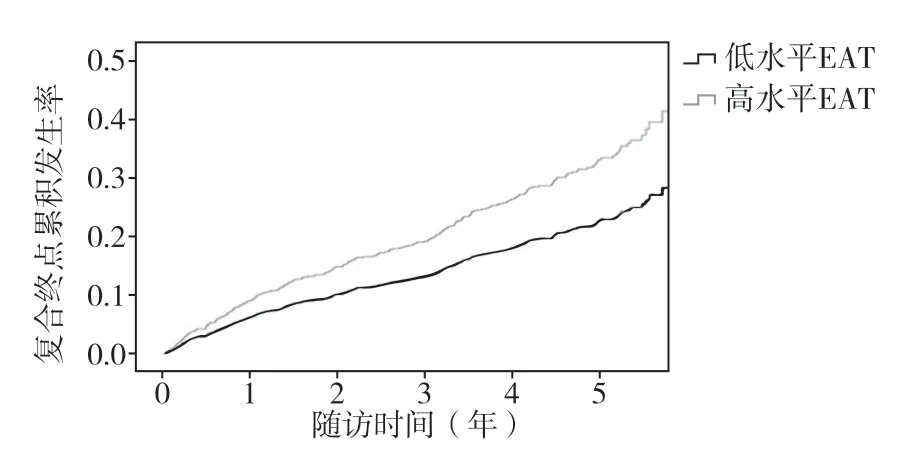
图1 高水平和低水平EAT 的Kaplan-Meier 生存曲线
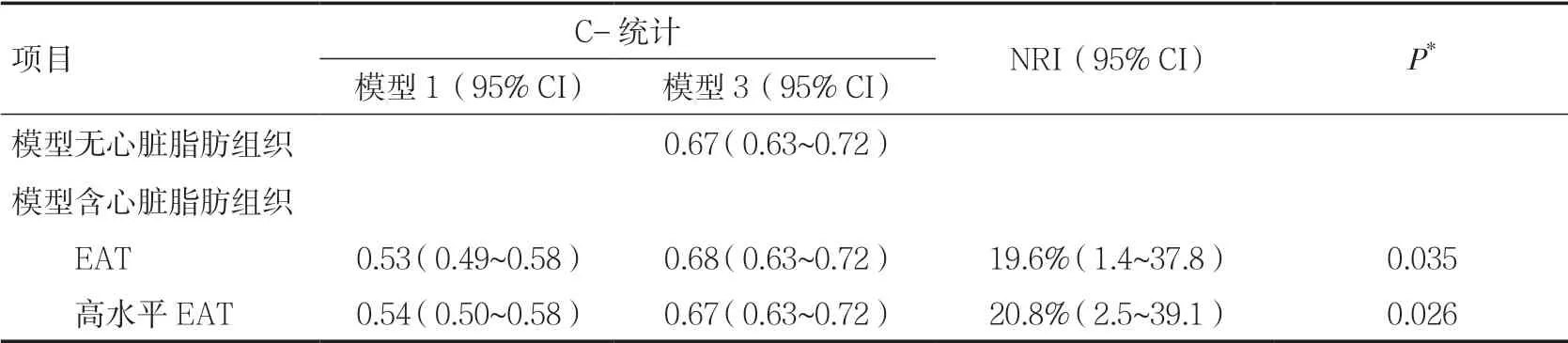
表3 高水平心脏脂肪组织与随访复合终点发生率的相关性
3 讨论
EAT 是一种位于心肌和心包膜脏层之间的脂肪组织,与冠状动脉和心肌组织紧密相邻[8]。EAT的异常增厚和功能失调与冠状动脉粥样硬化的发生和进展密切相关[2]。一项荟萃分析显示,EAT 与亚临床动脉粥样硬化、心肌缺血和主要不良心血管事件(MACE)明显相关[9]。但纳入该荟萃分析的所有研究中,只有少数研究对EAT 作为心血管疾病影像生物学标志物的预测能力进行评估。Cheng 等[10]对2 751 例无症状冠心病患者长达4年的随访发现,把EAT 加入Framingham 风险评分和冠状动脉钙化评分时,可以提高上述评分对MACE 的预测能力。队列研究进一步发现,高水平的EAT 与确诊或疑似冠心病患者心血管疾病风险的增加有关[11,12]。本研究将上述研究结果扩展到2型糖尿病患者,即高水平的EAT 与5年随访期间发生的心血管事件和死亡的风险增加相关。
传统心血管疾病风险预测模型主要建立在年龄、性别、血压、血脂水平、糖尿病和吸烟等危险因素的基础上[13]。Zhou 等[3]对稳定型心绞痛患者的研究发现,将EAT(作为二分类变量)加入基于传统心血管疾病危险因素和冠状动脉钙化积分建立的模型时,新的模型能更加准确和有效地预测冠状动脉闭塞的风险。研究表明,经冠状动脉CT 成像测量得到的EAT/EAT 衰减可以提高冠心病患者传统心血管风险模型的预测能力[14]。在本研究中,我们将经超声心动图测量的EAT(作为二元和连续标记物)加入基于年龄、性别、BMI、吸烟、LDL-C 和糖尿病病程等因素的预测模型中。净重新分类指数分析显示,与未含EAT 的模型相比,含EAT 的模型能更有效地预测2型糖尿病患者发生心血管事件和死亡的风险。
既往研究认为,EAT、PAT 和CAT 均与心血管疾病风险的增加呈独立相关[15]。但在本研究中,PAT 与心血管事件和死亡风险的增加无关。而且,Oikonomou 等[14]研究进一步指出,与EAT 的生理状态(如炎症与非炎症的EAT)相比,EAT 的质量是预测心血管疾病风险的一个更好指标。因此,今后需要更多的研究来明确心脏脂肪组织的类型、质量、功能特性与心血管疾病风险的相关性。
本研究通过超声心动图测量心脏脂肪,没有用“金标准”磁共振成像(MRI)或冠状动脉CT 成像(CTA)测量,在一定程度上限制了研究结论。但是我们按照Iacobellis 等[6]提出的EAT 标准超声测量方法,即于收缩末期胸骨旁长轴切面,将测量线置于右心室游离壁水平进行测量,从而最大程度地保证心脏脂肪测量的准确度。
综上所述,高水平EAT 与2型糖尿病患者心血管事件和死亡复合终点的增加有关。当EAT 加入传统心血管疾病危险因素模型时,高水平EAT 能明显提高模型心血管疾病风险的预测能力。

