生理盐水实验性干预对肉鸡盲肠微生物区系和短链脂肪酸含量的影响
宫玉杰,邹晓庭,肖英平,夏文锐,温雪婷,杨华*
(1. 浙江大学动物科学学院,浙江省饲料与动物营养重点实验室,农业部(华东)动物营养与饲料重点实验室,浙江大学动物分子营养学教育部重点实验室,杭州 310058; 2. 浙江省农业科学院农产品质量标准研究所,杭州 310021)
动物肠道内栖居着大量的、种类丰富的细菌群落,这些细菌可以阻止潜在病原体在肠道内定植,维持机体免疫系统发育并为宿主提供营养[1]。动物出生前,一般认为其肠道几乎是无菌的,出生后前几天,其所处的环境可能在肠道菌群的形成中起着重要作用[2-3]。对初出壳的肉仔鸡而言,孵化后的一周内其肠道微生物群表现出极低的多样性和高度的不稳定性,这为后期微生物的塑造创造了一个宝贵的机会[4]。肠道内优先定植的微生物对人类和禽类肠道微生物群落的演变起着决定性作用,当肠道微生物成熟后,就可以作为稳定的群落来抵抗外界的干预手段[5]。
因此,研究者试图通过早期干预手段,在生命早期阶段,对肉仔鸡肠道菌群进行定向调控。Yin等[6]通过对刚孵化的小鸡灌胃盲肠发酵液来研究早期肠道环境对肠道微生物定植的影响;也有研究通过给早期肉鸡灌胃酵母菌多糖来研究其对肉用仔鸡肠道菌群的影响[7]。这些研究均以灌胃生理盐水作为试验对照组,但是关于生理盐水实验性干预本身是否会对肉仔鸡产生影响却至今没有过报道。所以我们设计本试验,拟以初出壳的小鸡为实验动物,采用高通量测序对早期生理盐水灌胃处理的肉鸡盲肠微生物进行深入探究,并用气相色谱法比较其与未处理组之间盲肠内容物中短链脂肪酸的含量差异,以探明早期生理盐水实验性干预对肉鸡盲肠微生物区系及短链脂肪酸含量的影响,为肉鸡早期干预技术的研究提供更多依据,同时也为肉鸡早期肠道微生物的菌群结构研究提供更多可参考数据资料。
1 材料与方法
1.1 实验动物与分组
实验动物选用普通级的1日龄白羽肉鸡80只,平均体重约45 g,购自江苏镇江腾达孵化厂。将购买的80只肉仔鸡随机分为2组,每组40羽,分别为对照组(C组)和生理盐水组(S组)。在1日龄和2日龄,连续每天给S组小鸡灌胃0.5 mL灭菌的生理盐水,C组不做处理。
1.2 饲养管理
将肉仔鸡饲养在浙江省农业科学院动物实验房。实验前一周对动物实验房及饲养设备进行严格消毒。肉鸡采用平养的方式,实验期间采用人工投料,全期自由采食和饮水。在实验过程中,用白炽灯和空调控制实验房温度,使温度保持在35 ~ 37℃。在实验期间,不使用任何抗生素和商业疫苗。
1.3 样品采集与保存
饲养至第3天、第7天时,于S组和C组各随机挑选8只鸡,测定其体重后屠宰取其盲肠内容物,液氮保存,随后转移到 -80℃冰箱待测。样品共分为2组,第3天的样品编号为3D-C1,…,3D-C8;3D-S1,…,3D-S8。第7天的样品编号为7D-C1,…,7D-C8;7D-S1,…,7D-S8。
1.4 DNA 提取与16S rRNA基因扩增
采用QIAamp DNA Stool Mini Kit(QIAGEN,CA)试剂盒提取各盲肠内容物样品中总基因组DNA,使用引物515F(GTGCCAGCMGCCGCGG)和907R(CCGTCAATTCMTTTRAGTTT)对细菌16S rRNA基因V4-V5区进行扩增。通过Illumina Miseq平台对扩增区域进行测序。测序由杭州利贞生物医药科技有限公司完成,每组高通量测序样本数为8。
1.5 短链脂肪酸的测定
准确称取0.1 g盲肠内容物于离心管中,然后加入1 mL PBS溶液涡旋混匀。8000 r/min离心10 min后取上清500 μL,再加入100 μL偏磷酸巴豆酸,震荡均匀后于-20℃冰箱保存过夜。24 h后解冻,14 000 r/min离心20 min,用1 mL注射器取全部上清液通过0.22 μm针式过滤器,过滤后的样品入进样瓶,用气相色谱仪测定乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸含量。色谱柱采用逐渐升温的方法(80 ~ 170℃),汽化室和检测室温度均为180℃,载气类型为氮气。各酸保留时间约为:乙酸7.50 s,丙酸9.15 s,异丁酸9.77 s,丁酸11.03 s,异戊酸11.88 s,戊酸13.33 s,巴豆酸14.2 s。
1.6 统计学方法
2 结果
2.1 早期生理盐水干预对肉鸡生长性能的影响
由图1可知,在1~3日龄和3~7日龄两个阶段,S组和C组的平均日增重无显著差异(P> 0.05),说明生理盐水实验性干预对肉鸡的平均日增重无明显影响。
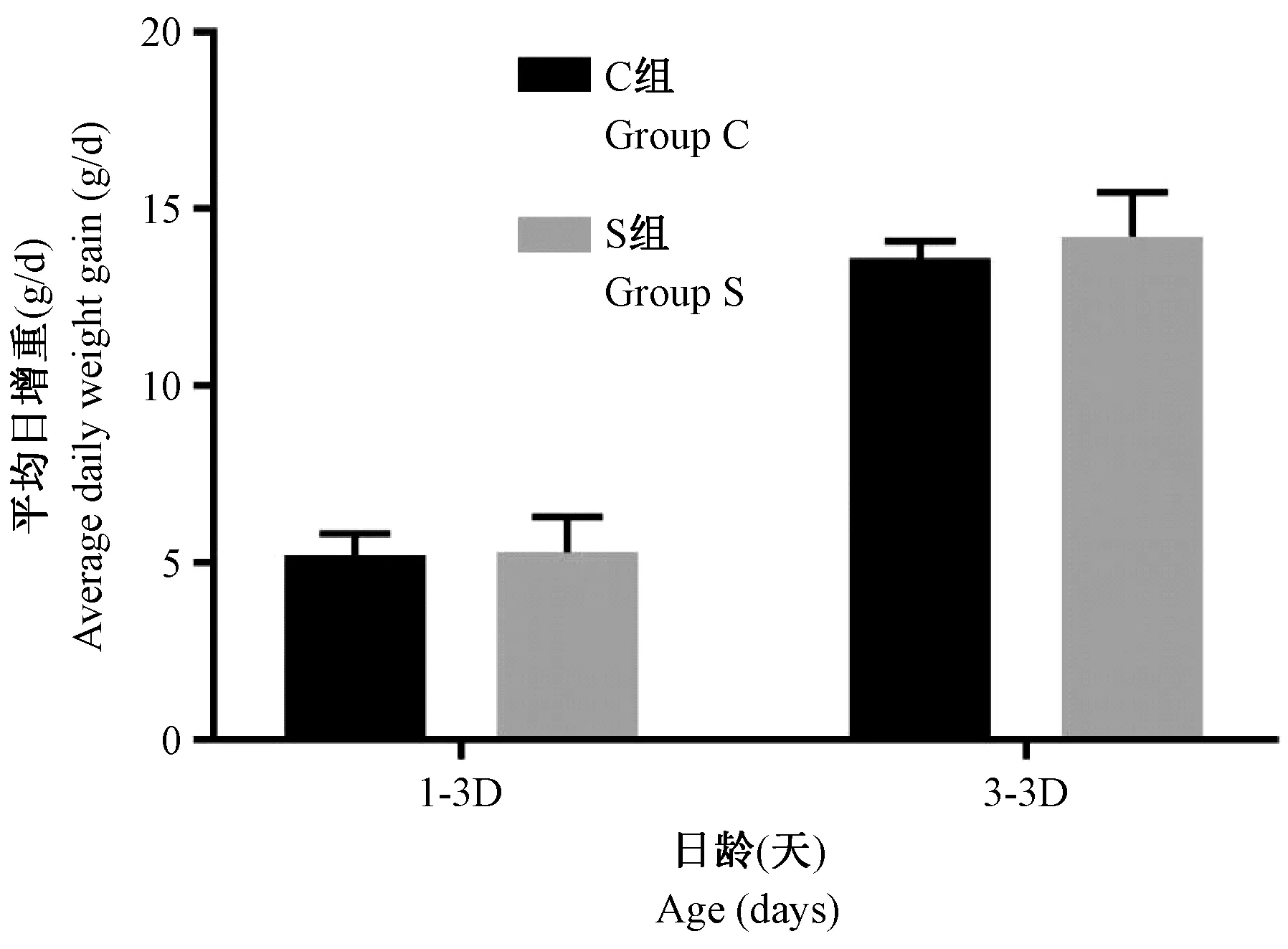
图1 两个年龄段肉鸡的平均日增重Figure 1 Average daily weight gain of the broilers in two age stages
2.2 盲肠微生物物种丰度及多样性
每组高通量测序重复数为8个样本,各指标取平均值后的测序信息如表1所示。测序采用抽平的原则,使每个实验样本产生33 496条序列。覆盖指数均大于0.97,说明测序量合理,已基本覆盖所有微生物群落的多样性。第3天、第7天S组和C组操作分类单元(operational taxonomic units,OTU)数量无显著差异,说明两组间的菌群丰度差异不大。Alpha多样性分析表明,相同日龄S组和C组的ACE值、Chao 1值、Shannon指数以及Simpson指数均没有显著差异,说明生理盐水实验性干预未对肉鸡盲肠微生物多样性产生影响。但与第3天相比,第7天ACE指数和Chao 1指数升高,说明随着日龄增加,肉鸡盲肠中菌群丰度增加;此外,Shannon指数增加,同时Simpson指数降低,说明随着日龄增加,肉鸡盲肠中菌群多样性增加。
2.3 肉鸡盲肠菌群结构分析
两组样品在门水平上的菌群结构如图2所示。可以看出,肉鸡盲肠中的细菌隶属10个门,其中厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)三者相对丰度之和在3D-C、3D-S和7D-C、7D-S四组中分别为83.14%、80.20%、74.21%和80.04%,是构成盲肠菌群的主要菌门。进一步从属的水平分析可以更清晰地反映出两组肉鸡盲肠菌群结构的变化。第3天时,埃希氏杆菌属(Escherichia-Shigella),拟杆菌属(Bacteroides),瘤胃球菌属([Ruminococcus]_torques_group)和肠杆菌属(Enterobacteriaceae_unclassified)为主要菌属;第7天时,肉鸡盲肠内容物中主要的优势菌属分别为拟杆菌属(Bacteroides)、厌氧芽孢杆菌属(Anoxybacillus)、瘤胃球菌属(Ruminococcaceae_uncultured)和蓝细菌属(Cyanobacteria_norank)(图3)。选取相对丰度较高的前10个属进行显著性差异分析,结果发现(表2),与C组相比,早期生理盐水干预使得第3天S组肉鸡盲肠中拟杆菌属(Bacteroides)和蓝细菌属(Cyanobacteria_norank)的相对丰度分别提高了160%和143%(P< 0.05);第7天时,两组间盲肠菌属的相对丰度无显著差异。
2.4 盲肠菌群结构的聚类分析
依照各组样品OTU的种类及相对丰度,采用非加权配对平均法对各组样品进行层次聚类。由图4可以看出,3D-S和3D-C聚成1簇,7D-S和7D-C聚成1簇,说明日龄对肉鸡盲肠细菌的影响效果大于早期生理盐水的干预作用。根据测序结果绘制PCA分析图,进一步从宏观角度了解肉鸡盲肠菌群结构差异。如图5所示,第3天和第7天两组之间没有明显的聚类,说明在这两个日龄,生理盐水实验性干预没有对肉鸡盲肠菌群结构产生显著影响。
2.5 肉鸡盲肠内容物中短链脂肪酸的含量
由图6可知,从短链脂肪酸的组成来看,第3天和第7天两组肉鸡盲肠内容物中含量最高的短链脂肪酸均为乙酸,其次是丁酸和丙酸,而异丁酸,戊酸和异戊酸所占比例较小。此外,与C组相比,生理盐水实验性干预可极显著降低3日龄肉鸡盲肠内容物中乙酸、丁酸和异戊酸的含量(P< 0.01)。但随着日龄的增长,第7天时,两组肉鸡盲肠内容物中短链脂肪酸含量无显著差异。

表1 盲肠微生物的物种丰富度和多样性Table 1 Species richness and diversity of the broiler cecal microbes

图2 在门水平上的肠道菌群结构Figure 2 Relative abundance of the broiler intestinal flora at the phylum level

图3 在属水平上的肠道菌群结构Figure 3 Relative abundance of intestinal flora at the genus level

日龄(天)菌属C组S组标准误P值Age (days)Bacterial genusC GroupS GroupSEMP-value3Escherichia-Shigella埃希氏杆菌属0.12550.16720.28250.479Bacteroides拟杆菌属0.04930.12840.01650.011*[Ruminococcus]_torques_group瘤胃球菌属0.05420.05190.01280.931Enterobacteriaceae_unclassified肠杆菌属0.05200.03970.01400.675Erysipelatoclostridium红球菌属0.06320.02300.01590.217Clostridium_sensu_stricto_1梭菌属0.04370.02210.00870.225Lachnospiraceae_unclassified毛螺菌属0.03870.02290.00770.320Anoxybacillus肠杆菌属0.02680.03150.00490.639Cyanobacteria_norank蓝细菌属0.01620.03930.00550.031*Bacteroidales_S24-7_group_norank拟杆菌目S24-7组0.02950.02530.00520.7047Bacteroides拟杆菌属0.10070.10210.01140.955Anoxybacillus肠杆菌属0.07440.06850.00770.714Ruminococcaceae_uncultured瘤胃菌属0.03790.04700.01000.667Cyanobacteria_norank蓝细菌属0.04260.03530.00290.216Acidobacteria_norank酸杆菌属0.02980.02700.00330.686Bacteroidales_S24-7_group_norank拟杆菌目S24-7组0.03190.02300.00320.178Faecalibaculum肠球棒状菌属0.03000.02430.00250.269Lactobacillus乳酸杆菌属0.02760.02450.00270.586Lachnospiraceae_unclassified毛螺菌属0.01650.02960.00500.202[Ruminococcus]_torques_group瘤胃球菌属0.01900.02490.00480.557
注:*表示差异显著,P< 0.05。
Note. * indicates significant difference,P< 0.05。

图4 盲肠微生物的聚类分析图Figure 4 Cluster analysis chart of the flora in cecal contents
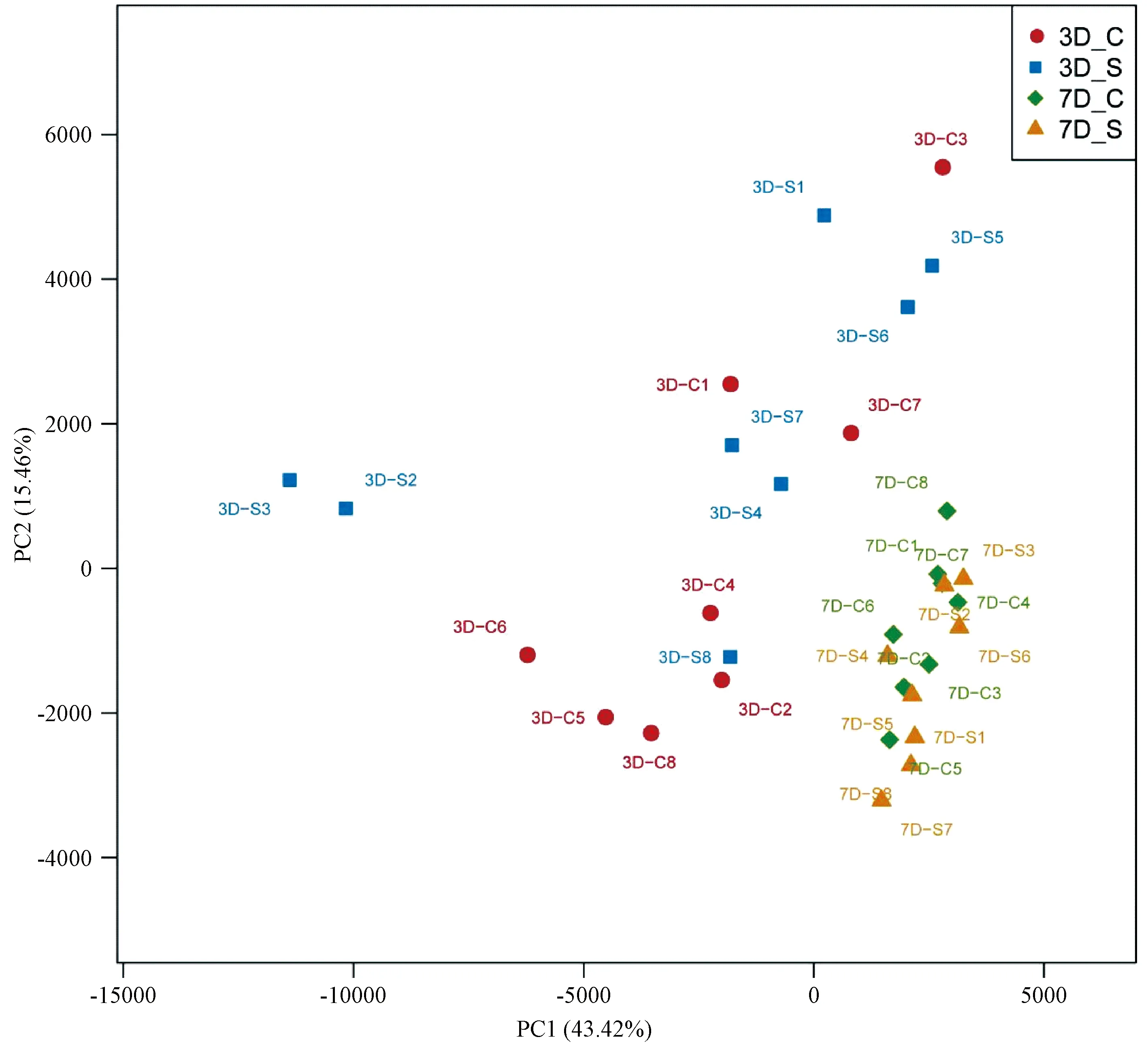
图5 盲肠微生物的主成分分析Figure 5 Principal component analysis (PCA) plot of the cecal microbes

注:**P< 0.01表示同一日龄两组之间差异极显著。图6 盲肠内容物中短链脂肪酸的含量Note:**P< 0.01 indicates that there is an extremely difference between the two groups at the same age.Figure 6 Content of short-chain fatty acids in cecal contents
3 讨论
动物肠道可以看作是机体最大的免疫器官,在动物生长发育以及疾病防控等许多方面都发挥着至关重要的作用[8]。鸡被认为是最有效的农业物种之一,是全球蛋白产业的基础,每年为我们提供大量的肉产品[9]。鸡在出壳后,其肠道微生物的建立易受肠道环境等外界因素的影响。因此,研究人员寻求开发替代营养策略,以刺激动物肠道有益微生物群的定植,进而改善动物健康和提高生产效率[10]。在研究性实验中,不论是给鸡口腔灌服益生菌或是来自健康供体的粪菌悬液,都会以生理盐水作为对照组来探明肠道微生物的变化。但是关于生理盐水这一溶剂是否会对肉鸡肠道微生物造成一定的调节却不得而知,所以本次实验,我们主要研究生理盐水实验性干预对肉鸡肠道微生物及短链脂肪酸含量的影响。
随着日龄的增长,鸡肠道渐渐成熟,肠道微生物也由单一结构向复杂体系逐渐演变。由表1可知,从3日龄到7日龄,丰度指数ACE和多样性指数Shannon的值增大,表明随着年龄的增长,肠道微生物的物种丰富度和多样性会随着增加,这也预示着动物对营养物质的消化吸收、肠屏障功能以及免疫系统开始逐渐完善。
有研究表明,肉鸡盲肠中的优势菌门为厚壁菌门、拟杆菌门和变形菌门[11]。在本研究中,3日龄和7日龄两组肉鸡盲肠中主要的微生物是厚壁菌门、变形菌门和拟杆菌门,三者相对丰度之和在各组所占的比例均超过70%,与前人研究结果一致[12-13]。在属的水平,早期生理盐水干预可以使3日龄肉鸡盲肠中拟杆菌属和蓝细菌属的相对丰度显著增加。其中拟杆菌属是一种存在于动物肠道内的正常菌群,但是当机体免疫功能异常或产生炎症反应时,体内拟杆菌属含量就会增加,成为导致内源性感染的条件致病菌[14-15]。而蓝细菌属是一种古老而多样的可产氧、能光合作用的细菌系,对人及动物体的能量代谢和物质循环起着至关重要的作用[16-17]。比较肠道菌群的丰度差异可发现,7日龄时两组肉鸡盲肠菌属的构成和占比基本相似,说明早期生理盐水干预技术对3日龄肉鸡肠道微生物有一定影响,但随着日龄增加,这种影响作用做逐渐减弱,甚至消失。
家禽微生物消化主要发生场所是盲肠,消化产物主要包括短链脂肪酸、维生素和氨基酸[18]。其中,短链脂肪酸是菌群代谢的主要产物和重要信息分子,有助于维持肠道弱酸性环境,抑制一些有害菌的生长繁殖[19]。本研究中,测定肉鸡3日龄和7日龄盲肠内容物中短链脂肪酸含量,结果发现乙酸是含量最高的短链脂肪酸,其次是丁酸和丙酸。其中乙酸和丙酸能够作为能量物质被机体吸收,丁酸可提供50%以上的能量供胃肠道黏膜代谢需要,而且在肠道上皮细胞的增殖与分化过程中发挥重要作用[20]。值得注意的是,我们的研究还发现早期生理盐水干预可极显著降低3日龄肉鸡盲肠内容物中乙酸、丁酸和异戊酸的含量。众所周知,短链脂肪酸的生成受多种因素的影响,如日粮类型、肠道内微生物的结构或是体内酶的活性等。刚出生的肉仔鸡肠道微生物种类单一且含量极少,在这种情况下,连续两天灌服生理盐水会使其产生一定应激,肠道中拟杆菌属和蓝细菌属含量增高也说明肠道内可能产生了轻微的炎症反应。因此与C组相比,S组肉鸡肠道内短链脂肪酸的含量有所下降,然而随着日龄的增加,肠道微生物的建立逐步完善,动物具备一定的的调节能力,所以7日龄时两组肉鸡盲肠内容物中短链脂肪酸的含量无显著差异。
本文对肉鸡盲肠微生物区系和短链脂肪酸的含量进行测定,发现早期生理盐水干预会对3日龄肉鸡盲肠菌群结构及短链脂肪酸含量产生一定的影响,但7日龄时,两组间并无显著差异,说明早期生理盐水干预对肉鸡产生的影响不具有持续性,随着日龄的增加,动物自身可以调节这一溶剂干预所造成的影响,因此,用生理盐水这一溶剂作为实验的对照组是较为合适的选择。
参考文献
[1] Mead GC. Prospects for ‘competitive exclusion’ treatment to control salmonellas and other foodborne pathogens in poultry [J]. Vet J, 2000, 159(2):111-123.
[2] Turnbaugh PJ, Hamady M, Yatsunenko T, et al. A core gut microbiome in obese and lean twins [J]. Nature, 2009, 457(7228):480-484.
[3] Thompson CL, Wang B, Holmes AJ. The immediate environment during postnatal development has long-term impact on gut community structure in pigs [J]. ISME J, 2008, 2(7):739-748.
[4] Baldwin S, Hughes RJ, Hao Van TT, et al. At-hatch administration of probiotic to chickens can introduce beneficial changes in gut microbiota [J]. PLoS One, 2018, 13(3): e0194825.
[5] Stanley D, Geier MS, Hughes RJ, et al. Highly variable microbiota development in the chicken gastrointestinal tract [J]. PLoS ONE, 2013, 8: e84290.
[6] Yin Y, Lei F, Zhu L, et al. Exposure of different bacterial inocula to newborn chicken affects gut microbiota development and ileum gene expression[J]. ISME J, 2010, 4(3):367-376.
[7] 高天舒,吴纪经,吴英华.酵母菌多糖对肉用仔鸡肠道菌群的影响 [J]. 中国比较医学杂志, 1997(4): 231-234.
Gao TS,Wu JJ,Wu YH. Effects of yeast polysaccharides on intestinal flora of broiler chickens [J]. Chin J Comp Med, 1997(4):231-234.
[8] Cho I, Yamanishi S, Cox L, et al. Antibiotics in early life alter the murine colonic microbiome and adiposity [J]. Nature, 2012, 488(7413):621-626.
[9] Mancabelli L, Ferrario C, Milani C, et al. Insights into the biodiversity of the gut microbiota of broiler chickens [J]. Environ Microbiol, 2016, 18(12): 4727-4738.
[10] Stanley D, Hughes RJ, Moore RJ. Microbiota of the chicken gastrointestinal tract: influence on health, productivity and disease [J]. Appl Microbiol Biotechnol, 2014, 98(10): 4301-4310.
[11] Qu A, Brulc JM, Wilson MK, et al. Comparative metagenomics reveals host specific metavirulomes and horizontal gene transfer elements in the chicken cecum microbiome [J]. PLoS One, 2008, 3(8): e2945.
[12] Wei S, Morrison M, Yu Z. Bacterial census of poultry intestinal microbiome [J]. Poult Sci, 2013, 92(3): 671-683.
[13] Oakley BB, Lillehoj HS, Kogut MH, et al. The chicken gastrointestinal microbiome [J]. FEMS Microbiol Lett, 2014, 360(2): 100-112.
[14] 陈孝天,彭三妹,王博林,等.PCR-DGGE检测溃疡性结肠炎大鼠胃肠道中细菌多样性研究 [J]. 浙江临床医学, 2014(4): 512-515.
Chen XT,Peng SM,Wang BL,et al. Detection of bacterial diversity in the gastrointestinal tract of rats with ulcerative colitis by PCR-DGGE [J]. Zhejiang Clin Med J, 2014(4): 512-515.
[15] 蒋曼,姚萍,杨涛,等.实时荧光定量PCR法研究溃疡性结肠炎患者肠道双歧杆菌属、柔嫩梭菌属及拟杆菌属量的变化 [J]. 中国微生态学杂志, 2013, 25(11): 1245-1249+1254.
Jiang M,Yao P,Yang T,et al. Real-time fluorescence quantitative-PCR analysis of the variation ofBifidobacteriumspp,FaecalibacteriumprausnitziiandBacteroidesin patients with ulcerative colitis [J]. Chin J Microecol, 2013, 25(11):1245-1249+1254.
[16] Perkerson Iii RB, Johansen JR, Kovácik L, et al. A unique pseudanabaenalean (cyanobacteria) genus nodosilinea gen. nov. based on morphological and molecular data [J]. J Phycol, 2011, 47(6):1397-1412.
[17] Amin A, Ahmed I, Salam N, et al. Diversity and distribution of thermophilic bacteria in hot springs of Pakistan [J]. Microb Ecol, 2017, 74(1):116-127.
[18] Marounek M, Suchorska O, Savka O. Effect of substrate and feed antibiotics on in vitro production of volatile fatty acids and methane in caecal contents of chickens [J]. Anim Feed Sci Technol, 1999, 80(3-4): 223-230.
[19] Eswaran S, Muir J, Chey WD. Fiber and functional gastrointestinal disorders [J]. Am J Gastroenterol, 2013, 108(5):718-727.
[20] 蒋小丰,方热军.丁酸在动物体内的作用 [J]. 饲料工业, 2008, 29(20):51-54.
Jiang XF,Fang RJ. The role of butyric acid in animals [J]. Feed Ind, 2008, 29(20):51-54.

