原花青素联合维生素E对动脉粥样硬化大鼠的抗氧化作用*
师 豪 黄世龙 张孟柯 李 颍 胡文玉 牛美兰
黄河科技学院医学院,河南省郑州市 450000
近年来以动脉粥样硬化(Atherosclerosis,As)为基础的缺血性心脑血管病(包括冠心病和脑卒中)发病率逐年升高,心脑血管病已成为我国居民死亡的主要原因[1]。西药在治疗As中机制明确,取得显著作用,但往往效果单一,且副作用较大,不良反应多。中药以中医理论为指导,宏观着手,整体施治,对As这类复杂的疾病具有独特优势,且其有效成分不易散失,副作用小,越来越受人们的青睐。
葡萄籽原花青素(Grape seed procyanidine,GSP)作为一种提取物,具有清除氧自由基、防止细胞老化和脂质过氧化对细胞膜损伤、对抗血小板活化因子等多种药理作用[2],所以其防治As的机制可能包括多个方面。维生素E(Vitamin E,VE)是主要的抗氧化剂之一,它本身的结构可以清除氧自由基和过氧化物,可被维生素C或氧化还原系统复原,继续发挥作用[3]。通过GSP与VE的联合抗氧化作用,进一步探究其防治大鼠As的作用机制,为今后临床用药以防治动脉粥样硬化并减少西药的毒副作用提供理论和科学依据。
1 实验材料
1.1 实验动物 SPF级6~8周龄雄性Sprague-Dawley(SD)大鼠60只,体重180~220g,购自南京市江宁区青龙山动物繁殖场,许可证编号(SCXK苏2017-0001),存放在黄河科技学院动物房,光照12h/d,温度20~23℃,相对湿度40%~60%,自由饮水和摄食。
1.2 饲料 基础饲料,高脂饲料配方(以下均为质量分数):3%胆固醇、0.2%胆盐、20%猪油、10%白糖及高蛋白基础饲料(批号:201733,南京盛民科研动物养殖场)。
1.3 试剂及药品 血清TC、TG试剂盒(批号:20171216)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)试剂盒(批号:20171207)、低密度脂蛋白胆固醇(Low densitylipoprotein cholesterin,LDL-C)试剂盒(批号:20171201)、一氧化氮(NO)试剂盒、血清超氧化物歧化酶[(Superoxide Dismutase,SOD (批号:20171218)]、抗超氧阴离子O2-试剂盒(批号:20171220)、抗羟自由基-OH试剂盒(批号:20171219)、丙二醛(Malondialdehyde,MDA)试剂盒(批号:20171214),均购自南京建成生物工程研究所。免疫组化试剂盒(平顶山市慧众源生物科技有限公司),葡萄籽原花青素(批号:20170704,河南明瑞食品添加剂有限公司),维生素E软胶囊(批号:170817Q,山东盛海保健品有限公司),维生素D3注射液(批号:20170903,哈尔滨市宏达动物药品厂),氯化钠注射液(批号:1705020726,辰欣药业股份有限公司),阿托伐他汀钙片(规格10mg,郑州大学第一附属医院)。
1.4 实验仪器及设备 电子天平(XJ320M,上海精科天美科学仪器有限公司)、离心机(GT16-3A , 北京时代北利离心机有限公司)、分光光度计(UV-8000, 上海元析仪器有限公司)、漩涡混匀器(DH300 , 杭州瑞诚仪器有限公司)、恒温水浴槽(NKSY-15,常州诺基仪器有限公司)。
2 实验方法
2.1 造模方法 将实验大鼠用基础饲料喂养1周,适应环境后,将其分为空白组喂养基础饲料和造模组喂养高脂饲料,空白组10只、造模组50只,早晚各添加1次饲料,自由饮水,观察记录饮食、二便、毛发、活动、对外界刺激的敏感度等状况。造模期间,第1周内腹腔注射VD360万IU/kg,之后的第3、6、9周分别注射10万IU/kg[4],每周测1次大鼠体质量。实验9周后,空白组和模型组各随机抽出2只,腹腔静脉采血测血清血脂水平及抗氧化指标。
2.2 分组给药方法 在建立高血脂模型基础4周后,将造模组分五组:模型组;GSP+VE低、中、高剂量组;阿托伐他汀组(西药组),每组10只,继续高脂饲料喂养。GSP+VE低、中、高剂量组分别给予GSP[45mg/(kg·d)]和VE[15mg/(kg·d)]、GSP[90mg/(kg·d)]和VE[5-6][30mg/(kg·d)]、GSP[180mg/(kg·d)]和VE[60mg/(kg·d)]灌胃;阿托伐他汀组给予研磨碎的阿托伐他汀钙片[7-8][1.05mg/(kg·d)]灌胃,以上药物均加用生理盐水[1.33ml/(kg·d)];模型组灌胃同剂量的生理盐水,连续干预4周。
2.3 样品采集与指标测定 其他条件不变,各组大鼠于第10周称重,腹腔注射10%水合氯醛溶液麻醉,固定四肢,打开腹腔,促凝真空管腹腔静脉取血,3 500r/min离心10min,分离血清于-4℃冰箱保存;采血后取肝脏组织在冷的生理盐水中漂洗,除去血液,滤纸拭干,称重。根据试剂盒说明测其血清中TC、TG、LDL-C、HDL-C的含量,用分光光度计法测其超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Malondialdehyde,MDA)、NO的含量、抗超氧阴离子O2-、抗羟自由基-OH的能力并进行对比,按照公式计算主要脏器系数和动脉硬化指数[9](Atherogenic index,AI),分析原花青素联合VE对脏器系数和AI的影响。

3 结果
3.1 大鼠的一般状况 实验过程中,模型组3只,逐渐厌食、消瘦,还有突发的急性死亡,考虑与高脂饲料和注射大剂量维生素D3有关;GSP+VE低剂量组3只,大鼠状况、死亡原因与模型组相似;GSP+VE中剂量组1只,状况同模型组,因疑似肺炎,直接处死;西药组4只,考虑到个体差异,不能耐受药物副作用,死亡4只。
3.2 GSP联合VE对造模大鼠脏器系数和动脉硬化指数的影响 与空白组相比,模型组大鼠的肝脏指数、AI1、AI2均显著升高(P<0.01),各给药组的肝脏指数、AI1、AI2高于空白组;与模型组相比,GSP+VE各剂量组大鼠的肝脏指数有所降低(P<0.05),AI1、AI2均依次降低,其中高剂量组降低显著(P<0.01),西药组肝脏指数升高(P<0.05),AI1、AI2均显著降低(P<0.01),见表1。

表1 GSP联合VE对大鼠肝脏指数及AI的影响
注:与空白组比较,△P<0.05,△△P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.3 GSP联合VE对造模大鼠血脂水平的影响 与空白组相比,模型组大鼠血清的TC、TG、LDL-C的含量均增加(P<0.05),且TC增加更显著(P<0.01),HDL-C的含量减少(P<0.05),各给药组血清TC、TG含量高于空白组,HDL-C、LDL-C含量无显著差异;与模型组相比,各给药组大鼠血清的TC、TG、LDL-C的含量均依次减少,HDL-C的含量依次增加(P<0.05),见表2。
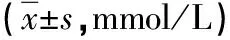
表2 GSP联合VE对大鼠血脂水平的影响
注:与空白组比较,△P<0.05,△△P<0.01;与模型组比较,#P<0.05。
3.4 GSP联合VE对造模大鼠抗氧化水平的影响 与空白组相比,模型组大鼠血清中T-SOD的活力、抑制O2-、-OH的能力、NO的含量降低,MDA的含量升高(P<0.05或P<0.01),各给药组抗氧化水平趋于空白组;与模型组相比,GSP+VE各剂量组大鼠血清中T-SOD的活力、抑制O2-的能力、NO的含量依次升高(P<0.05或P<0.01),其中低剂量组MDA含量及抑制-OH的能力无显著变化(P>0.05),高剂量组MDA含量降低,抑制-OH的能力增强(P<0.05),西药组中NO的含量、T-SOD的活力升高,MDA的含量降低(P<0.05),抑制O2-、-OH的能力无显著差异(P>0.05),见表3。

表3 GSP联合VE对大鼠抗氧化水平的影响
注:与空白组比较,△P<0.05,△△P<0.01;与模型组比较,#P<0.05,##P<0.01。
4 讨论
本实验参阅历年相关的国内文献,发现造模方法不尽相同,如杨小蓉等[10]报道,实验开始分4 次腹腔注射VD3共70万IU/kg,用有不同含量胆固醇的高脂饲料探讨对造模的影响,本实验在参考文献基础上用3%胆固醇联合腹腔注射大剂量VD3,9周后胸主动脉病理形态学显示有向腔内凸起的斑块,内膜增厚甚至断裂,平滑肌细胞排列紊乱,大量泡沫细胞、淋巴细胞聚集表明复制模型成功,与文献相符。
实验中,造模大鼠死亡率高的原因可能是:高脂饲料中胆固醇含量过高影响口感、食欲;灌药干预第1周,原花青素粉使用剂量过大,加之味苦,导致其厌食、体质量下降,研究人员根据相关文献调整给药剂量,停药1周后再次灌药干预,体质量增加状况良好;大剂量VD3导致高钙血症诱发消化、泌尿系统功能障碍和心律失常,解剖急性死亡的大鼠,发现肝脏、肾脏表面均有白色密集的钙化斑,甚至出现尿潴留。
实验结果显示:GSP联合VE能提高大鼠的免疫力,延长其存活时间,西药组虽有降血脂效果,却对机体造成的毒副反应极大,不能耐受的机体死亡率增高。与模型组相比,GSP+VE各剂量组大鼠血脂水平依次改善,另外中、高剂量组能明显改善血清抗氧化指标(P<0.05或P<0.01)。
大剂量VD3引发的高钙血症,会导致Ca的异位沉积。机体细胞处于氧化应激状态时,活性氧(ROS)产生过多,细胞内钙超载,Ca沉积线粒体使细胞色素氧化酶系统功能失调,氧自由基增多并作用于脂质发生过氧化反应,氧化终产物为MDA,具有细胞毒性,其含量可间接地反映出细胞损伤的程度。钙超载时,钙依赖性磷脂酶A2激活,使花生四烯酸(AA)生成增加,通过环加氧酶和脂加氧酶作用产生大量H2O2和-OH[11]。机体发生高脂血症时,内皮细胞损伤,一氧化氮合酶(NOS)基因表达减少,导致NO产生不足[12],抑制LDL被氧化的能力下降,从而产生泡沫细胞进一步发展为动脉硬化。内皮细胞损伤后,暴露出内皮下胶原,此时在Ca2+和NO减少的作用下,血流中血小板不断黏附聚集,血栓素A2和生长因子释放增多,一方面促进平滑肌细胞增殖和动脉基质层蛋白质合成,降低血管壁的顺应性;另一方面激活凝血因子,启动了内源性凝血过程,因此严重的As溃疡是导致血栓形成的常见原因。GSP联合VE的抗氧化机制是原花青素通过回收脂溶性维生素E和减少DNA氧化损伤来发挥作用[13]。与模型组相比,GSP+VE各剂量组也正是通过作用于以上机制的一个或多个途径从而达到降脂抗氧化的目的,使得AI1、AI2的值有所降低,其中高剂量组显著降低(P<0.01),AI值升高提示机体发生As的可能性增加,说明GSP联合VE能延缓大鼠As的形成。
本实验表明,GSP联合VE具有改善血脂水平和抑制脂质过氧化的作用,从而降低动脉粥样硬化过程中活性自由基对血管的损害,为其对As的抗氧化作用机制做了初步探究,为今后保健品的开发利用和临床中西联合用药提供新依据。

